三重基序蛋白28对乳腺癌细胞增殖能力和肿瘤免疫微环境的影响
2024-05-06付琳琳马保东张书娟霍彦平
付琳琳,马保东,张书娟,霍彦平
(1.郑州大学附属郑州中心医院乳腺外科,河南 郑州 450001;2.郑州大学附属郑州中心医院干细胞再生医学转化中心,河南 郑州 450001;3.郑州大学附属郑州中心医院检验科,河南 郑州 450001)
乳腺癌是女性最常见的恶性肿瘤,也是女性癌症死亡的主要原因[1]。据2020年全球癌症统计显示,全球新发乳腺癌病例230万例,占所有癌症患者的11.7%;其中2020年死亡人数超过 68.5万例[2]。近年来,乳腺癌的诊断和治疗取得了巨大进展,但乳腺癌患者的预后仍然较差。目前,乳腺癌的治疗仍以手术为主,联合化学治疗、放射治疗、内分泌治疗和靶向治疗等其他辅助治疗[3-4]。近期,针对不同亚型乳腺癌靶向免疫治疗研究取得了突破性进展,程序性死亡受体1 (programmed cell death protein 1,PD-1)/程序性死亡-配体1 (programmed cell death 1 ligand 1,PD-L1)通路的拮抗剂可以在一些转移性三阴性乳腺癌患者中诱导持久的临床效果[5-6]。因此,开发预测新的免疫治疗靶点将对治疗乳腺癌以及改善患者的预后带来更多希望。三重基序蛋白28(tripartite motif-containing 28,TRIM28)是1个包含多个结构域的大分子蛋白,属于人类三聚体蛋白家族中的一员,也被称为KRAB相关蛋白1或转录中间因子1β[7]。TRIM28参与调控多种生物进程,包括细胞增殖、侵袭、分化和衰老等[7]。不仅如此,TRIM28还在T细胞活化和T细胞耐受中起着至关重要的作用[8]。研究发现,黑色素瘤[9]、肾透明细胞癌[10]和肺腺癌[11]等均与TRIM28相关的免疫应答有关。目前,TRIM28对乳腺癌细胞的影响及其与肿瘤免疫微环境之间的关系尚不清楚。基于此,本研究旨在通过生物信息学方法结合体外实验探索TRIM28在乳腺癌中的表达水平及其对乳腺癌细胞的影响,并分析TRIM28与乳腺癌中免疫浸润细胞之间的关系,为后续进一步发掘乳腺癌免疫治疗的新靶点提供参考。
1 材料与方法
1.1 乳腺癌组织及癌旁组织标本收集
收集2020年9月至2022年1月在郑州大学附属郑州中心医院进行诊治的39例乳腺癌患者的石蜡包埋肿瘤组织标本及配对的癌旁组织标本。纳入标准:(1)所有标本经病理学检查确诊为乳腺癌;(2)所取癌组织标本位于瘤体中央,无出血、坏死及囊性病变。排除标准:(1)手术前经化学治疗、放射治疗和免疫治疗;(2) 乳腺癌合并其他器质性疾病及恶性肿瘤。本研究由郑州大学附属郑州中心医院伦理委员会批准,所有患者及家属知情同意并签署知情同意书。
1.2 细胞、主要试剂和仪器
MCF7乳腺癌细胞系购自武汉普诺赛生命科技有限公司。达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、40 g·L-1多聚甲醛、质量分数0.1%结晶紫染液购自北京索莱宝科技有限公司,Opti-MEM培养基购自美国赛默飞世尔科技有限公司,siRNA购自苏州吉玛基因股份有限公司,TRIM28抗体购自美国Cell Signaling Technology公司,山羊抗兔免疫球蛋白G(immunoglobulin,IgG)购自英国Abcam公司,Omni-ECL超灵敏化学发光检测试剂盒购自上海雅酶生物医药科技有限公司,二氨基联苯胺(diaminobenzidine,DAB)显色液购自美国Biogradetech公司,细胞计数盒-8(cell counting kit-8,CCK-8)购自上海雅酶生物医药科技有限公司;正置显微镜购自日本OLYMPUS公司,细胞恒温培养箱购自香港力康生物医疗科技控股有限公司,超净工作台、细胞计数仪购自美国赛默飞世尔科技有限公司,电泳仪、凝胶成像仪购自美国Bio-Rad公司,酶标仪购自美国Molecular Devices公司。
1.3 实验方法
1.3.1 免疫组织化学染色法检测乳腺癌组织及癌旁组织中TRIM28蛋白的表达
取石蜡包埋的乳腺癌组织和癌旁组织,应用二甲苯脱蜡,梯度乙醇水化,高温抗原修复,体积分数3% 过氧化氢溶液室温孵育15 min,滴加TRIM28一抗(滴度为1:50),4 ℃孵育过夜;滴加辣根过氧化物酶标记的山羊抗兔 IgG二抗(滴度为1:5 000),室温孵育30 min。DAB显色液显色,苏木精复染,自来水冲洗,梯度乙醇脱水,二甲苯透明,中性树脂封片,应用正置显微镜观察细胞染色结果;使用免疫组织化学评分(histochemistry score,H-score) 半定量评估染色强度和在特定强度范围内染色细胞的百分比。H-score=Σpi(i+1),式中pi表示阳性细胞数量占切片中所有细胞数量的百分数;i代表着色强度。H-score的范围为0~300,数值越大表示TRIM28蛋白表达水平越高。
1.3.2 细胞培养
将MCF7细胞接种于含体积分数10%胎牛血清和体积分数1%青霉素/链霉素的DMEM培养基,置于37 ℃、含体积分数5%CO2的恒温培养箱中培养,取对数生长期细胞进行后续实验。
1.3.3 siRNA干扰实验敲低TRIM28
取对数生长期MCF7细胞,随机分为si-control组和si-TRIM28组;在50 μL的Opti-MEM培养基中加入0.5 μg DNA制备为A液(si-control组加入空载质粒,si-TRIM28组加入敲低TRIM28的质粒);用50 μL Opti-MEM培养基稀释1 μg的RNAi-Mate制备为B液,室温孵育5 min。将A液和B液混匀后室温孵育30 min;将所得到的DNA/RNAi-Mate复合物加入到接种MCF7细胞(每孔1×105)的24孔板中,补充Opti-MEM培养基至500 μL,培养48 h后更换为含有体积分数10%胎牛血清的无双抗DMEM培养基,继续培养至细胞融合度达到80%~90%时进行后续实验操作。
1.3.4 Western blot法检测MCF7细胞中TRIM28蛋白表达
取转染后的si-control组和si-TRIM28组MCF7细胞,使用免疫沉淀裂解缓冲液裂解,提取细胞的总蛋白后定量测定蛋白浓度,将2组中等量的蛋白质在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate- polyacrylamide gel electrophoresis,SDS-PAGE)凝胶上进行电泳分离,在冰浴条件下以200 mA电流转膜2 h将其转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。室温下使用50 g·L-1的脱脂牛奶和含Tween20的三羟甲基氨基甲烷缓冲液将膜封闭2 h,滴加TRIM28、β-actin一抗(滴度为1:1 000)室温孵育1 h,并4 ℃孵育过夜;滴加相应二抗(滴度为1:5 000)室温下孵育2 h,每次10 min洗脱3次。使用Omni-ECL超灵敏化学发光检测试剂盒配制显影液,将显影液滴加至PVDF膜上,放至显影仪中曝光拍照保存。使用Image J 软件分析条带灰度值,以β-actin为内参,TRIM28蛋白相对表达量以目的蛋白灰度值与内参蛋白灰度值的比值表示。实验重复3次,取均值。
1.3.5 CCK-8实验检测MCF7细胞增殖能力
取转染后的si-control组和si-TRIM28组MCF7细胞,按每孔3×103个细胞接种于96孔板中,每组设3个复孔,置于37 ℃、含体积分数5%CO2培养箱中培养4 d。然后,每孔加入10 μL CCK-8溶液,并置于37 ℃、含体积分数5%CO2培养箱中孵育2 h,用酶标仪测定450 nm处的吸光度值。通过细胞存活率反映细胞的增殖能力,细胞存活率=[(As-Ab)/(Ac-Ab)]×100% (As为si-TRIM28组吸光度值,Ac为si-control组吸光度值,Ab为空白组吸光度值),细胞存活率越高表示细胞的增殖能力越强。
1.3.6 平板克隆形成实验检测MCF7细胞集落形成能力
取转染后的si-control组和si-TRIM28组对数生长期MCF7细胞,胰蛋白酶消化,使用完全培养基重悬成细胞悬液,按每孔3×103个细胞接种于6孔板,置于37 ℃、含体积分数5%CO2培养箱中培养至出现肉眼可见的克隆形成时停止培养。使用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤1次,每孔加入40 g·L-1多聚甲醛固定15 min,PBS洗涤1次;每孔加入1 mL体积分数0.1%结晶紫染色 20 min,PBS清洗后晾干并拍照,观察集落形成的数量。
1.3.7 基于美国癌症肿瘤基因图谱(The Cancer Genome Atlas,TCGA)数据库分析乳腺癌组织中免疫浸润细胞
从TCGA数据库下载乳腺癌患者的mRNA转录组数据,数据均为原始Count数据,对所有的数据进行归一化。通过CIBERSORT算法来计算所有样本组织中22种肿瘤浸润免疫细胞的差异。从CIBERSORT网站下载R脚本,使用R软件对所有样本的mRNA表达矩阵进行分析,基于P<0.05选择具有显著差异的肿瘤浸润免疫细胞。
1.3.8 基于基因组富集分析(gene set enrichment analysis,GSEA)获取TRIM28基因介导的免疫/癌症相关信号通路
为了阐明TRIM28基因表达水平信号通路的显著差异,使用GSEA软件4.3.2中的c2.cp.kegg.v7.2.symbols.gmt作为对照基因组;以标准化富集得分>1、P<0.05和错误发现率(false discovery rate,FDR)<0.25定义为具有显著差异的信号通路。
1.3.9 免疫调节因子的获取及富集分析
在TISIDB数据库中选择“Gene Symbol”,使用“Immunomodulator”模块获取与TRIM28蛋白具有相关性的免疫调节因子。将上述获得的免疫调节因子导入WebGestalt网站进行京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG) 信号通路富集分析。
1.4 统计学处理

2 结果
2.1 乳腺癌组织与癌旁组织中TRIM28蛋白表达水平比较
乳腺癌组织中TRIM28蛋白阳性染色定位于细胞质中,呈棕黄色细颗粒状。TRIM28蛋白在癌旁组织中呈阴性或弱阳性表达,在乳腺癌组织中呈强阳性表达,结果见图1。肿瘤组织和癌旁组织中TRIM28蛋白表达水平分别为75.91±54.99、50.96±41.71;肿瘤组织中TRIM28蛋白表达水平显著高于癌旁组织,差异有统计学意义(t=2.258,P=0.027)。
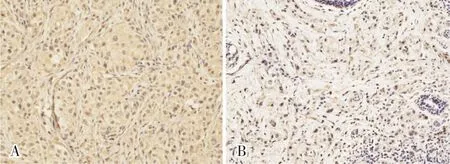
A:肿瘤组织;B:癌旁组织。图1 乳腺癌组织和癌旁组织中TRIM28蛋白表达(免疫组织化学染色,×200)Fig.1 Expression of TRIM28 protein in breast cancer tissues and paracancerous tissues(immunohistochemical staining,×200)
2.2 2组MCF7细胞中TRIM28蛋白相对表达量比较
si-control组和si-TRIM28组MCF7细胞中TRIM28蛋白相对表达量分别为1 058 456.33±21 557.87、206 617.00±10 389.57;si-TRIM28组MCF7细胞中TRIM28蛋白相对表达量显著低于si-control组,差异有统计学意义(t=61.654,P<0.05)。结果见图2。
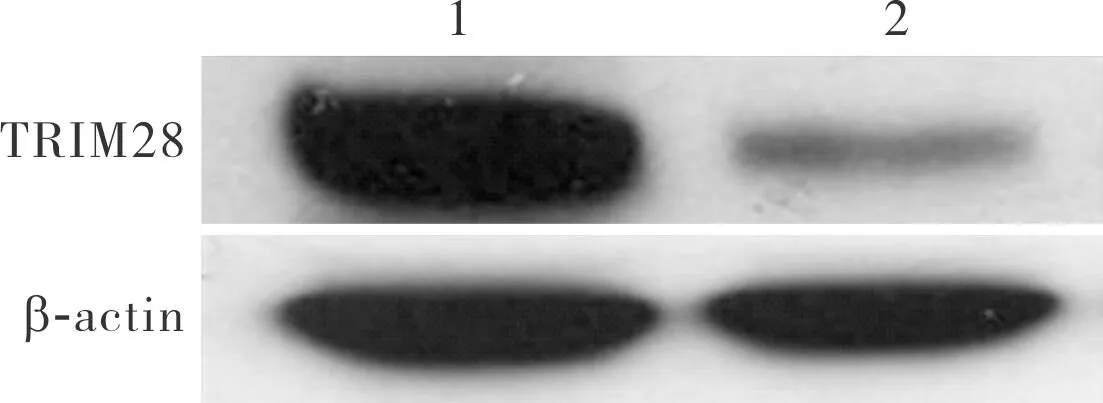
1:si-control组;2:si-TRIM28组。图2 si-control组和si-TRIM28组MCF7细胞中TRIM28蛋白的表达Fig.2 Expression of TRIM28 protein in MCF7 cells in the si-control group and si-TRIM28 group
2.3 2组MCF7细胞增殖能力比较
培养第0天,2组MCF7细胞存活率比较差异无统计学意义(P>0.05)。培养第4天,si-TRIM28组MCF7细胞存活率显著低于si-control组,差异有统计学意义(P<0.05)。结果见表1。
表1 si-control组和si-TRIM28组MCF7细胞增殖能力比较Tab.1 Comparison of MCF7 cell proliferation ability between the si-control group and si-TRIM28 group
2.4 2组MCF7细胞集落形成能力比较
si-control组和si-TRIM28组MCF7细胞克隆形成数分别为(338.0±9.2)、(236.3±12.2)个;si-TRIM28 组MCF7细胞克隆形成数量显著少于si-control组,差异有统计学意义(t=11.528,P<0.05)。结果见图3。

A:si-control组;B:si-TRIM28组。图3 si-control组和si-TRIM28组MCF7细胞克隆形成Fig.3 Clone formation of MCF7 cells in the si-control group and si-TRIM28 group
2.5 乳腺癌组织中免疫细胞浸润情况
基于TCGA分析乳腺癌组织中免疫浸润细胞结果显示,乳腺癌组织和癌旁组织样本中巨噬细胞亚群(M0、M1和M2)、B细胞亚群(初始B细胞和记忆B细胞)、T细胞亚群(CD8 T细胞、静息记忆CD4 T细胞、活化的记忆CD4 T细胞、滤泡辅助性T细胞和调节性T细胞)、活化的自然杀伤(natural killer,NK)细胞、单核细胞和嗜酸性粒细胞计数差异均有统计学意义(P<0.05),表明免疫微环境密切参与了乳腺癌的发生发展过程。结果见图4。

A:热图。B:小提琴图。Monocytes M0:单核细胞M0;B cells naive:幼稚B细胞;T cells CD8:CD8型T细胞;T cells follicular helper:滤泡辅助性T细胞;Macrophages M1:M1型巨噬细胞;Mast cells resting:静息肥大细胞;Plasma cells:浆细胞;T cells regulatory (Tregs):调节性T细胞;Dendritic cells resting:静息树突状细胞;T cells CD4 memory activated:活化的记忆CD4 T细胞;NK cells resting:静息NK细胞;Neutrophils:中性粒细胞; B cells memory:记忆B细胞;T cells gamma delta:γδT细胞;T cells CD4 naive:CD4幼稚型T细胞;Eosinophils:嗜酸性粒细胞;NK cells activated: 活化的NK细胞;Mast cells activated:活化的肥大细胞;T cells CD4 memory resting:静息的记忆CD4 T细胞;Macrophages M2:M2型巨噬细胞。图4 TCGA-BRCA组织样本中免疫细胞的差异Fig.4 Differences of immune cells in TCGA-BRCA tissue samples
2.6 乳腺癌组织中TRIM28蛋白表达水平与肿瘤浸润免疫细胞的关系
乳腺癌组织中TRIM28蛋白表达水平与浸润的单核细胞和调节性T细胞呈正相关(r=0.150、0.100,P<0.05),与活化的树突状细胞、活化的记忆CD4 T细胞、静息的记忆CD4 T细胞、γδ T细胞呈负相关(r=-0.100、-0.160、-0.099、-0.190,P<0.05),结果见图5。
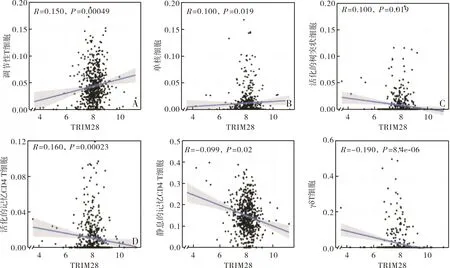
A:TRIM28与调节性T细胞的相关性;B:TRIM28与单核细胞的相关性;C:TRIM28与活化的树突状细胞的相关性;D:TRIM28与活化的记忆CD4 T细胞的相关性;E:TRIM28与静息记忆CD4 T细胞的相关性;F:TRIM28与γδT细胞的相关性。图5 乳腺癌组织中TRIM28蛋白表达水平与浸润免疫细胞的相关性Fig.5 Correlation between TRIM28 protein expression level and infiltrating immune cells in breast cancer tissues
2.7 TRIM28基因参与的免疫/癌症相关信号通路
GSEA分析结果表明,TRIM28参与了多种免疫/癌症相关的信号通路,包括癌症通路、T细胞受体信号通路、Notch信号通路和Wnt信号通路;结果见图6。
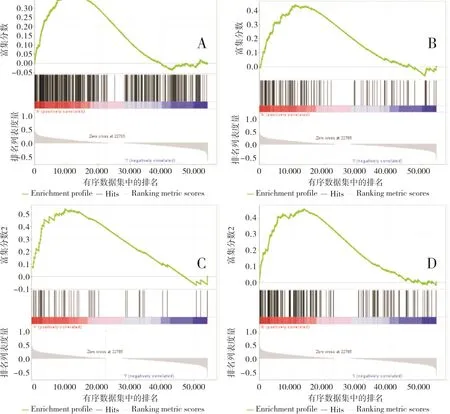
A:癌症通路;B:T细胞受体信号通路;C:Notch信号通路;D:Wnt信号通路。图6 TRIM28参与免疫/癌症相关信号通路Fig.6 TRIM28 is involved in immune/cancer-related signaling pathways
2.8 TRIM28基因相关的免疫调节因子
从TISIDB数据库中获取了TRIM28相关的58个免疫调节因子,其中免疫刺激因子包括C10orf54、CD27、CD276、CD28、CD40、CD40LG、CD48、CD80、CD86、C-X-C基序趋化因子配体12(C-X-C motif chemokine ligand 12,CXCL12)、C-X-C基序趋化因子受体4(C-X-C motif chemokine receptor 4,CXCR4)、外核苷三磷酸二磷酸水解酶1(ectonucleoside triphosphate diphosphohydrolase 1,ENTPD1)、诱导性T细胞共刺激分子(inducible T cell costimulatory,ICOS)及其配体、白细胞介素2受体α(interleukin-2 receptor subunit alpha, IL2RA)、白细胞介素-6(interleukin-6,IL-6)及其配体、杀伤细胞凝集素样受体亚家族成员(killer cell lectin-like receptor subfamily member,KLRC1,KLRK1)、淋巴毒素α(lymphotoxin alpha,LTA)、组织相容性复合体I类相关基因B (MHC class I polypeptide-related sequence B, MICB)、胞外5′-核苷酸酶(ecto-5′-nucleotidase,NT5E)、脊髓灰质炎病毒受体(poliovirus receptor,PVR)、视黄酸早期转录1e (retinoic acid early transcript 1E,RAET1E)、跨膜蛋白173(transmembrane protein 173,TMEM173)、UL16 结合蛋白 1 (UL16 binding protein 1,ULBP1)、TNF受体超家族成员(TNF receptor superfamily member,TNFRSF)和TNF超家族成员 (TNF superfamily member,TNFSF);免疫抑制因子包括ADORA2A、BTLA、CD160、CD244、CD274、CD96、 集落刺激因子1受体(colony stimulating factor 1 receptor,CSF1R)、细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte associated antigen 4,CTLA4)、甲型肝炎病毒细胞受体 2 (hepatitis A virus cellular receptor 2,HAVCR2)、人吲哚胺2,3-双加氧酶1 (indoleamine 2,3-dioxygenase 1,IDO1)、白细胞介素-10(interleukin-10,IL-10)及其受体,激酶插入域受体(kinase insert domain receptor,KDR)、淋巴细胞激活基因3(lymphocyte activation gene 3,LAG3)、细胞程序性死亡蛋白1配体2(programmed cell death protein 1 ligand 2,PDCD1LG2)、脊髓灰质炎病毒受体相关分子2(poliovirus receptor related protein 2,PVRL2)、转化生长因子β受体 1(transforming growth factor beta receptor 1,TGFBR1)、T细胞免疫球蛋白和ITIM结构域蛋白(T cell immune receptor with immunoglobulin and ITIIM domain,TIGIT)、 C10orf54、含V-Set域T-细胞激活抑制因子1(V-set domain containing T-cell activation inhibitor 1,VTCN1)。对这58个免疫调节因子进行KEGG信号通路富集分析结果显示,免疫调节因子CSF1R、CXCL12、CD27、CD40和CD40LG共同参与了T细胞受体信号通路、NK细胞介导的细胞毒性、NF-κB信号通路等信号通路,见图7。

图7 TRIM28相关免疫调节因子的KEGG通路富集分析Fig.7 KEGG enrichment analysis of TRIM28-related immunomodulatory factors
3 讨论
迄今为止,许多研究表明,乳腺癌组织中TRIM28蛋白的表达显著上调[12-13]。WEI等[12]研究发现,TRIM28蛋白在晚期乳腺癌组织中高度表达,并通过稳定TWIST1来增强乳腺癌转移,表明靶向TRIM28蛋白可能是乳腺癌治疗的有效策略。除此之外,有研究报道,TRIM28蛋白的高表达还是乳腺癌患者预后不良的预测指标[13]。本研究结果显示,肿瘤组织中TRIM28蛋白的表达显著高于癌旁样本,这与先前的研究结果一致[12-13]。此外,本研究使用siRNA敲低了MCF7乳腺癌细胞系中的TRIM28,结果发现,si-TRIM28组细胞中TRIM28蛋白相对表达量显著低于si-control组;2组细胞培养第0天的存活率比较差异无统计学意义,si-TRIM28组细胞培养第4天的存活率显著低于si-control组,si-TRIM28组MCF7细胞克隆形成数量显著少于si-control组;提示,TRIM28能够提高MCF7细胞的增殖和集落形成能力,从而促进乳腺癌的发生发展。
乳腺癌的发生发展受到导管微环境中多种因素的影响,既包含了免疫细胞、脂肪细胞、成纤维细胞和一系列微生物,也包括可溶性生长因子、细胞因子、趋化因子、前列腺素等[14]。在这些因素中,免疫细胞所发挥的作用至关重要。从正常乳腺组织的免疫监视,一直到原发性和转移性乳腺癌,免疫细胞贯穿整个乳腺癌发生过程[15]。本研究通过对TCGA数据库中乳腺癌组织样本分析发现,乳腺癌组织与癌旁组织中巨噬细胞亚群、B细胞亚群、T细胞亚群、活化的NK细胞、单核细胞和嗜酸性粒细胞计数均有显著差异。目前,免疫疗法在乳腺癌的临床治疗中取得了巨大的突破,发现新的免疫治疗靶标对乳腺癌的发生发展机制和防治具有重要意义[16]。为了明确TRIM28蛋白和乳腺癌中肿瘤浸润免疫细胞之间的关系,本研究计算了TRIM28蛋白和免疫细胞之间的相关性,结果显示,TRIM28蛋白与浸润的单核细胞和调节性T细胞呈正相关,与活化的树突状细胞、活化的记忆CD4 T细胞、静息的记忆CD4 T细胞和γδ T细胞呈负相关。CAR-T 细胞疗法是一种由过继性 T 细胞转移开发的免疫疗法[17-18],该治疗方法也是近些年乳腺癌免疫治疗的新方法[19]。本研究证实TRIM28蛋白与T细胞密切相关,这为后续进一步研究TRIM28蛋白是否成为CAR-T细胞治疗的潜在靶点提供了依据。
此外,本研究结果显示,TRIM28基因和相关的免疫调节因子参与了多种癌症/免疫信号通路,如癌症通路、T细胞受体信号通路、Notch信号通路、Wnt信号通路和NF-κB信号通路;对与TRIM28基因相关的58个免疫调节因子进行KEGG信号通路富集分析结果显示,免疫调节因子CSF1R、CXCL12、CD27、CD40和CD40LG共同参与了T细胞受体信号通路、NK细胞介导的细胞毒性、NF-κB信号通路等信号通路。而Notch信号通路是一种进化保守的细胞间通讯机制,在许多细胞类型和不同的发育阶段发挥作用[20]。在哺乳动物的发育过程中,Notch信号通路控制着器官发育的各个方面,还与细胞增殖和细胞死亡的调节有关[21-23]。Notch信号通路在乳腺癌中异常激活,主要通过如Notch1、2和3的PEST结构域激活性突变以及破坏NRR和异构化结构域的突变等诱导[22]。Notch还与其他的生长因子、促炎细胞因子、转录因子和促癌通路相互作用。Notch可以联合缺氧诱导因子1-α和G 蛋白偶联雌激素受体诱导癌细胞中的血管生成和上皮间充质转化促进乳腺癌的发展[21]。更重要的是,Notch还与Wnt通路相互串扰以调控乳腺癌发生发展[24]。Wnt信号通路不仅仅局限于健康乳房和乳腺的发育和维持,而且还在乳腺癌发病机制中也起着同样突出的作用[25]:一方面,激活的Wnt信号通路通过Notch依赖性机制触发人乳腺上皮细胞的致癌转化[26];另一方面,异常的Wnt/β-连环蛋白信号传导也是乳腺癌的一个重要特征[24]。因此,NF-κB信号通路参与细胞因子的产生,调节癌症和炎症中的免疫反应。在乳腺癌基质中浸润的白细胞通过NF-kB信号通路导致乳腺上皮细胞恶性肿瘤的增加[27]。因此,推测TRIM28基因通过以上信号通路交叉作用参与调节乳腺癌中的免疫微环境。
4 结论
TRIM28蛋白在乳腺癌中高度表达,敲低TRIM28基因可抑制乳腺癌细胞的增殖能力和集落形成能力;TRIM28蛋白与肿瘤浸润免疫细胞密切相关,可能通过多种免疫/癌症相关信号通路参与调节乳腺癌免疫微环境。因此,TRIM28蛋白与乳腺癌的肿瘤免疫微环境密切相关,这为临床靶向免疫治疗转化提供了基础。但是还需进一步的实验验证乳腺癌中TRIM28蛋白与免疫细胞之间的联系和相关作用机制。
