皮肤常驻记忆T细胞参与白癜风皮损发生、发展研究
2024-05-06董炳琦雷铁池
董炳琦 雷铁池
白癜风是一种常见的难治性慢性自身免疫性色素脱失性疾病,在世界范围内的患病率为0.5%~1.0%,其黑素细胞的破坏造成皮肤色素脱失,形成白斑,严重影响患者美观,给患者带来严重的心理和精神压力,甚至会导致抑郁[1]。目前白癜风的总体治疗选择有限,缺乏持续的疗效,停止治疗后复发概率高(大约40%的白癜风患者在停止治疗后1年内复发)等问题仍亟待解决,这些问题促使人们不断探索白癜风的发病机制[2,3]。然而目前对于白癜风的发病机制尚不明确,自身免疫、氧化应激、神经精神等多种因素可能参与了疾病的发生和发展,其中异常的免疫应答导致白癜风黑素细胞破坏的免疫学机制被认为在白癜风发病中具有突出作用,特别是T细胞[4]。
记忆T细胞最初被认为是仅存在于循环系统的,只有在机体需要时才会进入组织,以清除感染或炎症。近年来,一个新发现的记忆T细胞亚群,它长期维持在皮肤、肠道、肺、肾脏和生殖道等外周组织中,被称为组织常驻记忆T细胞(tissueresident memory T cells,TRM),TRM有对试图破坏皮肤上皮细胞的病原体或外来抗原产生快速反应的倾向[5]。然而,TRM异常对炎症性疾病有害,很多研究报道了白癜风患者皮肤中存在TRM,并表明他们在白癜风的发生和发展中发挥一定的作用。
一、白癜风皮损中存在常驻记忆T细胞
在2011年的国际色素细胞大会(International Pigment Cell Conference,IPCC)期间,白癜风全球问题共识会议明确指出白癜风是一种自身免疫性疾病,所有形式的白癜风都可能涉及自身免疫或炎症机制[6]。Boorn等[7]通过皮肤外植体技术,证实白癜风是由CD8T细胞攻击黑素细胞导致的色素脱失;临床上,白癜风通常在治疗停止后在同一部位再复发,表明皮肤中存在常驻记忆细胞,当相同抗原再次刺激后重新被激活[8]。
多面研究已经证实了白癜风中TRM的存在,例如Malik等[9]一项关于皮肤中的介导对黑色素瘤的持久免疫的研究结果显示,黑色素瘤相关白癜风小鼠模型皮肤中存在TRM,且对于黑素细胞有持久攻击性; Stanley Cheuk等[10]对白癜风患者的病灶皮肤活检检出含有抗原特异性CD8TRM,且CD8+TRM位于基底角质形成细胞之间的基膜。Richmond等[11]对白癜风患者的皮损进行了分析显示病变皮损中含有表达IL-15受体的TRM,这种TRM在白癜风小鼠模型中也存在,且在表皮和真皮中可持续存在1年以上,通过给患白癜风的小鼠注射针对IL-15受体的抗体,阻断IL-15的表达,可使TRM减少或耗尽,恢复小鼠皮肤的色素沉着。Kok等[12]通过对效应T细胞、循环记忆T细胞和TRM池进行谱系追踪和单细胞转录组分析,证实T细胞克隆的一个亚群具有较高的形成TRM的能力,且该亚群在进入皮肤前生成TRM的能力是永久性的。
二、皮肤常驻记忆T细胞的演化及其发育过程
皮肤中存在大量的效应记忆T细胞,TRM是这些效应记忆T细胞的亚群,它们在组织中长期存在,对病原体的入侵做出及时反应,对防止病原体再感染发挥重要保护作用。然而,越来越多的证据表明,这些细胞的异常激活可能会导致自身免疫性疾病和炎症性疾病,不同部位或不同疾病的常驻记忆T细胞表型不尽相同,CD69和CD103通常是TRM细胞的关键表面标记,如在肠和肺部中存在不表达CD103的TRM,而胰脏、唾液腺和阴道发现很大比例的TRM中CD69和CD103都是阴性[13~16]。这些研究说明,TRM亚群间可能存在较大的表型异质性,它说明了组织来源的信号是确定TRM功能及其适应局部环境的关键[17]。
在白癜风的皮损中TRM的免疫表型主要是CD8+CD103+CD49a+,TRM借助CD103+和CD49a+牢固的定植在表皮,不再进入血液循环[18]。TRM是由未成熟的CD8+T细胞在受到抗原刺激后增殖、分化成效应CD8+细胞,进一步分化为短寿命效应细胞(short-lived effector cells,SLECs)和记忆前体效应细胞(memory-precursor effector cells,MPECs),这些效应T细胞在抗原被清除后在血液及次级淋巴器官形成循环记忆T细胞,在病原体进入的部位则形成组织常驻记忆T细胞[16,19]。在这一演化过程中(图1),SLECs/MPECs的命运取决于T-bet的水平,在T细胞启动过程中,低水平的T-bet会促进MPECs形成,对T细胞的命运起决定作用[20]。Mackay等[21]研究结果表明,T-box转录因子与细胞因子转化生长因子TGF-β和IL -15结合,控制组织驻留记忆T细胞的命运;Eomesodermin(Eomes)是一种T-box转录因子(TF),与它同源的T-bet一起,二者协同调节细胞发育方向,在长寿命细胞中Eomes表达高,短寿命细胞中T-bet表达高,在TRM发育过程中,二者协调下调,成熟后的CD8+CD103+TRM中Eomes消失,残留部分T-bet,此时T-bet通过促进白细胞介素-15受体(IL-15R) β链(CD122)的表达,与角质形成细胞分泌的IL-15结合,通过IL-15信号通路维持TRM的生存[22]。而TGF-β信号负向调节T-bet表达,缺乏TGF-β的细胞表达高水平的Eomes和T-bet,TFs和细胞因子TGF-β受体信号在Trm细胞发育构成前馈环路。TGF-β增加使T-box下调,T-box的下调又进一步增加TGF-β受体数量,使T-box进一步减少,促进TRM形成。
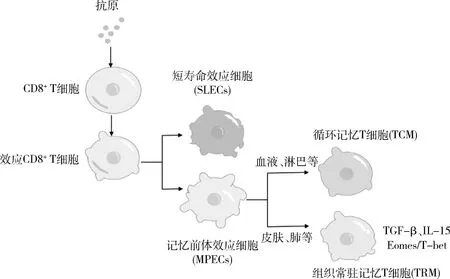
图1 皮肤常驻记忆T细胞的演化及其发育过程示意图
三、常驻记忆T细胞在白癜风发生和发展中的作用
TRM具有中等程度的细胞毒性活性,在IL-15刺激后分泌促炎性细胞因子IFN-γ、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、穿孔素和颗粒酶B等,这些分子对于诱导白癜风的黑素细胞凋亡至关重要,通过分泌这些细胞因子,TRM可能具有定向细胞毒性,尽管它具有细胞毒性,但是单独的TRM并不足以诱导和维持色素脱失,它必需与再循环记忆T细胞(recirculating memory T cells,TCM)一起发挥作用[10,23,24]。TRM能够分泌趋化因子CXCL9和CXCL10,将黑素细胞特异性的再循环的记忆T细胞募集到表皮组织,靶向杀伤再生的黑素细胞,Willemsen等[25]在小鼠白癜风模型中用FTY720阻断TCM招募到皮肤或低剂量Thy1.1抗体消耗TCM会逆转疾病也支持了这一观点。此外,皮肤中存在调节性T细胞已被证明对毛囊干细胞的再生至关重要,常驻记忆T细胞分泌的细胞因子和趋化因子可以通过局部调节性T细胞(regulatory cell,Treg)干扰毛囊中干细胞再生来阻止黑素细胞的补充,从而使白斑区域缺乏来自毛囊的黑素细胞迁移,使白斑面积扩大[26]。
四、针对白癜风皮肤中常驻记忆T细胞的潜在治疗靶点
白癜风的治疗存在已复色皮损再次复发、复色进程阻滞等问题,这表明白癜风的发展与皮肤中TRM和TCM有关,因此针对TRM和TCM的治疗成为新的研究方向[8]。例如,Azzolino等[27]研究发现,JAK抑制剂(如托法替尼和鲁索替尼)可抑制白癜风皮损中TRM的功能,但不能减少或删除TRM。如前所述,TRM的发育和维持是一个极其复杂的过程,对TRM的形成和驻留机制仍不十分清楚,目前研究已经证实T-box转录因子对于形成TRM至关重要,IL-15和TGF-β等是TRM的维持必不可少的[18];因此,笔者针对TRM的发育和生存,提出如下可能存在的治疗靶点。
1.减少TGF-β信号,干扰T-box转录因子:T-box转录因子调节细胞发育方向。设想,在细胞发育起始,干扰Eomes和T-bet的表达水平,可以调节细胞向短寿命细胞分化,致长寿命细胞所占比例较小,从而减少TRM数量,可能对白癜风的治疗有帮助。由于TGF-β信号负向调节T-bet表达,也可通过降低TGF-β的水平或者阻TGF-β受体减少TRM形成。
2.阻断IL-15信号通路:IL-15信号通路维持TRM的生存,因此通过阻断IL-15R b链(CD122) 成为一种治疗靶点。Richmond等[11]通过对白癜风小鼠模型每周3次腹腔注射100μg抗鼠CD122抗体, 阻断IL-15信号转导通路,证实CD122阻断剂可用于治疗白癜风,可导致自反应性TRM和其他记忆T细胞池的耗尽。目前John Harris实验室正在开发研制CD122单克隆抗体生物制剂可删除皮损中的TRM。另一方面,减少角质形成细胞分泌IL-15,使IL-15信号通路受损,可加速TRM的死亡,从而清除皮肤中已存在的TRM,对白癜风的治疗有积极意义。
3.调节脂质代谢:Pan等[28,29]研究表明,TRM的生存率依赖于外源性脂肪酸的摄取和代谢,利用脂肪酸-氧化磷酸化来支持其使用寿命这表明调节脂质代谢也可以消除皮肤中TRM以治疗白癜风。
4.阻断CXCL9/10-CXCR3 通路:Willemsen等[25]研究发现,趋化因子受体CXCR3(趋化因子类CXCL9和CXCL10的受体)对效应器T细胞的表皮定位和TRM的发育很重要,针对 CXCL9/10-CXCR3 通路也可能是治疗白癜风的一种策略。
另一方面,通过抑制循环记忆T细胞进入皮肤,也对白癜风的治疗有一定帮助,例如Richmond等[30]在白癜风小鼠模型中发现发现不仅皮肤TRM,而且TCM在白癜风的发展中起着重要作用,并证FTY720可抑制循环记忆体细胞进入皮肤。
综上所述,本研究进一步揭开了TRM在白癜风发病中所扮演的角色,为白癜风的治疗提供了一种新的理论支持。希望通过靶向TRM能为白癜风患者提供更为有效、复发率低的治疗策略。
利益冲突声明:所有作者均声明不存在利益冲突。
