低叶酸联合甲氨蝶呤诱导神经管畸形胎鼠的神经组织转录组学分析
2024-05-06李建婷
王 芳 李建婷 谢 秋 张 霆
神经管畸形(neural tube defects, NTDs) 是由于胚胎发育过程中神经管闭合不全引起的出生缺陷,主要表现为无脑儿、脊柱裂及脑膨出。NTDs发生率高,后果严重。流行病学研究表明,母亲在孕期和围孕期补充叶酸可以降低后代患NTDs的风险[1,2]。实验研究证明,叶酸缺乏可通过影响胚胎表观遗传修饰的改变导致NTDs的发生,然而机制还不完全清楚[3,4]。小鼠的神经管闭合过程在细胞、组织、基因及代谢水平上与人类相似,是被用于研究NTDs的最广泛的模式动物。本研究拟在前期建立的低叶酸联合甲氨喋呤诱导NTDs小鼠模型的基础上,检测小鼠胚胎神经发育关键时期(受孕9.5天)脑组织和脊髓组织基因的表达变化,分析寻找差异表达基因及可能影响神经发育的差异转录因子基因,为进一步阐明叶酸预防NTDs的机制提供理论依据[5]。
材料与方法
1.实验材料:采用物体特定病原体(SPF)级、6~8周龄的健康雌性ICR小鼠(体质量为18~22g)及健康雄性ICR小鼠(体质量为20~22g),均购自北京维通利华实验动物技术有限公司。低叶酸饲料及正常饲料购自北京科澳协力饲料有限公司,甲氨蝶呤(methotrexate,MTX)购自美国Sigma公司,0.9%氯化钠溶液购自中国大冢制药有限公司,磷酸盐缓冲溶液(phosphate buffered solution,PBS)购自美国Gibco公司,RNA文库制备试剂盒(TruSeq RNA sample Preparation kit V2)购自美国Illumina生物技术公司,核酸片段筛选试剂盒(Agencourt SPRIselect Reagent Kit)和核酸纯化试剂盒(Agencourt AMPure XP)购自美国Beckman Coulter公司,反转录酶(SuperScriptⅣ)购自美国Thermo Fisher Scientific公司。
2.NTDs胎鼠模型制备:将雌性小鼠分为正常饲喂组(对照组)与低叶酸联合MTX诱导NTDs组(低叶酸联合MTX实验组),对照组的雌性小鼠及全部雄性小鼠均提供正常繁殖饲料喂养,低叶酸联合MTX实验组小鼠采用特制低叶酸饲料。小鼠喂养4周后,按雌雄比例2∶1交配过夜,于次日8:00时观察到阴道栓,指定为受孕0.5天;受孕7.5天时以1.5mg/kg用量对低叶酸联合MTX实验组雌性小鼠腹腔注射MTX,对照组雌性小鼠使用等剂量0.9%氯化钠溶液进行腹腔注射;至受孕9.5天,对妊娠小鼠实施颈椎脱白处死,取出胎鼠,详细NTDs胎鼠模型建立方法参考课题组既往报道[5]。
3.组织样本收集:取出胎鼠后置于预冷的PBS中,其中对照组选取发育正常胎鼠,低叶酸联合MTX实验组选取NTDs表型明显的胎鼠,解剖其神经组织,自前脑嘴端至后脑微端,尽可能地分离中胚层或非神经组织,胎脑、脊髓组织分别收集于液氮中保存备用。
4.总RNA提取:采用TRIzol法提取总RNA,用DnaseⅠ消化DNA,琼脂糖凝胶电泳检测和Agilent 2100检测RNA完整度;Nanodrop检测RNA的浓度和纯度。琼脂糖凝胶电泳图3条rRNA带清晰可见,RNA完整性RIN≥6.5,RNA浓度≥100ng/μl,总量≥2μg,A260/A280为1.8~2.2。则RNA质量满足建库要求。提取的RNA于-80℃冻存,用于后续文库制备和测序。
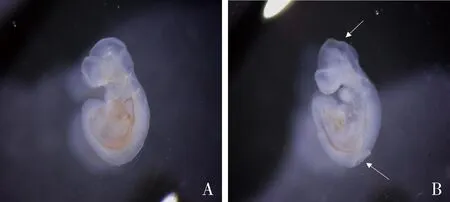
图1 对照组和低叶酸联合MTX实验组受孕9.5天胎鼠外观
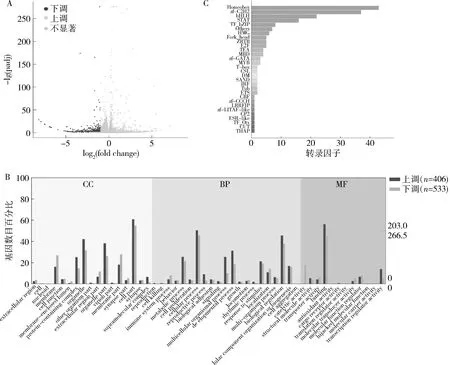
图2 低叶酸联合MTX实验组NTDs胎鼠脑组织DEGs
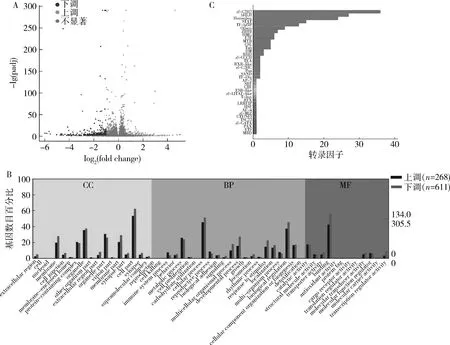
图3 低叶酸联合MTX实验组NTDs胎鼠脊髓组织差异表达基因
5.文库制备与测序:文库制备以及测序由安诺优达基因科技(北京)有限公司完成。cDNA文库的构建方法参照美国Illumina生物技术公司的样品制备试剂盒说明书,文库构建完成后使用Qubit3.0和Agilent 2100分别检测文库浓度与文库片段长度。浓度>5ng/μl,且片段长度集中为300~400bp,为库检合格。利用Illumina HiSeq2500平台,以2×150bp双端测序模式进行高通量测序,并使用TrimGalore法对原始测序数据过滤,得到高质量的Clean Data。使用HISAT2软件将过滤和质量控制后的序列和参考基因组进行比对,利用FPKM(Fragments per Kilobase per Million Mapped Fragments)方法对已知的基因和转录本进行表达定量。
6.差异表达基因(differentially expressed genes,DEGs)分析:采用DESeq软件分析低叶酸联合MTX实验组与对照组的差异表达基因。Type为筛选结果,满足P<0.05且|log2(fold change)|>1的为差异基因。其中log2(fold change) >1标记为上调基因(up);log2(fold change)<-1标记为下调基因(down),不满足上述条件的为非显著差异表达基因。
7.差异表达基因的GO (gene ontology)分析:基于筛选出的DEGs,采用R包 cluster Profiler对差异表达基因进行基因功能分类分析,来全面描述生物体中基因和基因产物的属性。GO是国际标准化的基因功能分类体系,GO总共有3类,分别描述基因的生物学过程(biological process, BP)、细胞组分(cellular component, CC)、分子功能(molecular function, MF)。本研究按照此3类对差异表达基因进行筛选。
8.差异表达转录因子基因分析:转录因子(transcription factor,TF)是一群能与基因5′-端上游特定序列专一性结合,从而保证目的基因以特定的强度在特定的时间与空间表达的蛋白质分子。选取筛选出的DEGs,通过与动物物种AnimalTFDB(Animal Transcription Factor DataBase)比较,预测DEGs是否是差异表达转录因子基因,以及所属的转录因子家族。
9.统计学方法:应用SPSS 23.0统计学软件对数据进行统计分析。组间均数比较采用独立样本t检验,以P<0.05 为差异有统计学意义。
结 果
1.低叶酸联合MTX诱导小鼠NTDs模型构建情况:通过对适龄母鼠喂养低叶酸饲料,并在受孕7.5天时对母鼠进行腹腔注射MTX,可成功诱导出具有明显NTDs表型的胎鼠。受孕9.5天取出胎鼠,通过体式显微镜观察可见:对照组胎鼠外观上较为饱满圆润,各脑室发育良好,神经管已完全闭合;低叶酸联合MTX实验组表现出脊柱裂、脑裂等,提示NTDs的表型,详见图1。
2.低叶酸联合MTX实验组NTDs胎鼠的脑组织基因表达分析:对低叶酸联合MTX实验组和对照组的胎鼠脑组织转录组分别进行测序、分析,使用DESeq软件确定DEGs。结果显示,低叶酸联合MTX实验组与对照组比较,共有939个DEGs,其中406个显著上调,533个显著下调,P<0.05,DEGs火山图详见图2A。
从BP、CC和MF 3类对差异表达的上调和下调基因进行筛选、分析,结果显示按CC分类,上调的基因主要是细胞、细胞器及蛋白复合物的基因,下调的基因主要是细胞、细胞器及细胞膜的基因,下调的基因和上调的基因在该分类基本一致;按BP分类,上调的基因主要是细胞过程、生物调节、发育过程及代谢过程的基因,下调的基因和上调的基因在该分类基本一致;按MF分类,上调的基因主要是蛋白结合、转录调节活性、分子功能调节因子及催化活性的基因,下调的基因和上调的基因在该分类一致,详见图2B。
差异转录因子分析显示,筛选出的DEGs,通过与Animal TFDB数据库比较,预测脑组织中有191个基因属于差异表达转录因子基因,其中104个显著上调,87个显著下调,P<0.05,通过与蛋白家族比对,发现转录因子主要聚焦在Homeobox、zf-C2H2、bHLH、STAT等家族,结果详见图2C。
3.低叶酸联合MTX实验组NTDs胎鼠的脊髓组织基因表达分析:对低叶酸联合MTX实验组和对照组的胎鼠脊髓组织转录组分别进行测序、分析,使用DESeq软件确定DEGs。结果显示,低叶酸联合MTX实验组与对照组比较,共有879个DEGs,其中268个显著上调,611个显著下调,P<0.05,DEGs火山图详见图3A。
从BP、CC和MF3类对差异表达的上调和下调基因进行筛选、分析,结果显示按CC分类,上调和下调的基因主要是细胞、细胞器及蛋白复合物等的基因;按BP分类,上调和下调的基因主要是细胞过程、生物调节及发育过程的基因;按MF分类,上调和下调的基因主要是蛋白结合、转录调节活性、分子功能调节因子及催化活性的基因。脊髓组织DEGs与脑组织的基本一致,详细结果详见图3B。
差异转录因子分析显示,脊髓组织中有195个基因属于差异表达转录因子基因,其中41个显著上调,154个显著下调,P<0.05,通过与蛋白家族比对,发现转录因子主要聚焦在zf-C2H2、bHLH、Homeobox、STAT等家族,结果详见图3C。
4.低叶酸联合MTX实验组NTDs胎鼠的脑和脊髓组织DEGs比较分析:比较两种组织中的DEGs发现,9.5天的NTDs胎鼠的脑组织和脊髓组织的DEGs分别有939、879个,其中有185个DEGs同时在脑组织和脊髓组织中的转录表达受到影响。对比两种组织中预测的差异转录因子发现,在脑组织和脊髓组织中分别有的191、195个差异转录因子中,有31个为相同的转录因子,结果详见图4。
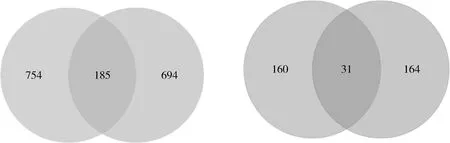
图4 低叶酸联合MTX实验组NTDs胎鼠的脑和脊髓组织DEGs对比图
讨 论
叶酸在体内经酶催化生成活性的四氢叶酸,四氢叶酸作为一碳基团转移酶的辅酶,参与碱基的合成、氨基酸之间的相互转化以及DNA和蛋白质等多种物质的甲基化,进而影响体内多种与发育相关的基因和通路的调控。胎儿早期生长发育中,对核酸和蛋白质的合成需求最为旺盛,这一阶段如果叶酸缺乏,对胎儿发育的影响更为严重。
MTX作为抗叶酸类抗代谢药,可抑制有生理活性的四氢叶酸合成。本研究使用的小鼠模型采用低叶酸饮食喂养,模拟动物体内低叶酸的生理环境,神经管闭合关键期在孕鼠腹腔注射MTX,既排除了单纯叶酸缺乏饲喂并不能导致小鼠NTDs的不足,又排除了单纯NTX诱导小鼠NTDs不能更好模拟体内叶酸缺乏生理状态的缺陷[5]。因此在该动物模型基础上检测胚胎神经发育关键时期脑组织和脊髓组织基因的表达变化,对推论低叶酸环境可能影响人胚胎期神经组织发育的功能基因及转录因子的参考意义较大。
本研究选取受孕9.5天胎鼠脑组织和脊髓组织,转录组测序结果直接反映了神经管发育当时基因转录表达变化,而不是神经管发育完成状态下的情况。通常小鼠神经管发育时期为7.5~10.5天。从受孕7.5天开始出现神经板;受孕8天,后脑和颈部交界的第一闭合点以拉链方式同时向头侧方向和尾侧方向进行,分别形成将来的脑和脊髓;受孕9天,位于中前脑和中脑的第二闭合点向头尾两端闭合;位于前脑喙末端的第三闭合点单向闭合[6]。本研究在受孕7.5天通过腹腔注射MTX进行诱导NTDs,并在受孕9.5天可以观察到神经管正常完整发育外观以及畸形外观时取材,能更准确反映发育阶段的即时情况。与同类型畸形胎鼠研究取材时间10.5、11.5、13.5天比较,能更好地反映发育当时的情况[4,7,8]。
RNA-seq结果显示,低叶酸联合MTX实验组转录组学发生明显改变,DEGs功能主要与神经细胞发育、转录调节有关。脑组织DEGs功能不论是按BP、CC还是MF进行分类,DEGs的上调和下调基因出现同时富集在同一生物学功能的情况,说明该生物学功能的基因出现了表达的紊乱。脊髓组织DEGs功能在各分类中结果与脑组织的相似。该结果反映出低叶酸联合MTX同时影响胎鼠脑组织和脊髓组织的发育,并且产生了相似的影响。
叶酸代谢对细胞中发生的甲基化反应至关重要,包括DNA和组蛋白甲基化。DNA甲基化是由叶酸代谢产生的一碳基团作为甲基供体来源,可以调控基因的表达及沉默,参与胚胎发育及多种疾病的进展,是表观遗传修饰研究中最广泛、最具特征的一类。组蛋白甲基化也是叶酸代谢产生的一碳基团作为甲基供体来源,研究表明大量与组蛋白H3第79位赖氨酸二甲基化(H3K79me2)相结合的基因处于转录激活的状态,H3K79me2对基因的转录调控发挥着激活作用[9]。在全基因组范围内有280个发育相关的基因在人胚胎干细胞中接受H3K79me2的调控。研究还表明,叶酸还可以影响组蛋白乙酰化水平,从而影响下游基因的转录和表达[10]。因此叶酸通过表观遗传修饰作用对基因的转录和表达的影响相当广泛。在本实验研究中,实验组与对照组比较,脑、脊髓组织基因转录组分别有939、879个DEGs,受影响的基因数量较多。其中分别有191、195个基因属于差异表达转录因子基因。
在脑组织和脊髓组织的差异表达转录因子基因中,通过与蛋白家族比较,发现转录因子主要聚焦在zf-C2H2、bHLH、Homeobox、STAT等转录因子家族。因转录因子家族涉及到转录因子数量较多,还需要后续进一步深入的研究。课题组的另一项通过抑制叶酸代谢物参与DNA合成诱导小鼠NTDs的研究结果发现,bHLH 家族的一员Hes3表达异常,同时有研究发现,该转录因子与神经管的发育密切相关[11,12]。本研究仅是在低叶酸饲喂联合MTX诱导的小鼠NTDs模型的基础上,对可能影响的神经组织发育的功能基因及转录因子的初步探索,可为NTDs发生机制的研究提供思路。
综上所述,低叶酸联合MTX能够引起胎鼠神经组织基因组的转录改变,DEGs主要是以神经细胞发育、转录调节基因为主,叶酸可能通过调节功能相关基因的表达来影响胚胎神经组织的发育,但其具体机制尚有待于进一步探讨。
利益冲突声明:所有作者均声明不存在利益冲突。
