延迟亚低温对新生幼鼠脑白质损伤的改善作用
2024-05-06梁穗新提运幸黄骏荣李秀红周雯嘉
梁穗新 提运幸 黄骏荣 李秀红 周雯嘉
脑白质损伤是婴幼儿手术后常见的并发症,及早产儿出生时易发的一类脑损伤[1]。先天性心脏病是人类最常见的先天性异常,约有25%患儿需要在生命的第1年进行密集的外科干预[2]。然而,对脑白质尚处于发育过程的新生儿,心脏外科手术后极易诱发脑白质损伤[3]。研究显示,手术中体外循环和深低温停循环仍是脑白质损伤的重要危因[4,5]。在前期研究中,为模拟先天性心脏病患儿大脑在经历心脏手术中体外循环/深低温停循环的过程,笔者构建了离体新生幼鼠的脑切片灌流及氧糖剥夺(oxygen glucose deprivation, OGD)模型,结果发现,脑部中的小胶质细胞呈过度活化状态和出现了脑损伤[6]。亚低温在新生儿缺氧缺血性脑病治疗的安全性及远期疗效已得到证实[7]。然而,亚低温在复温阶段适当延迟是否更具有脑损伤保护效果,目前国内外相关报道仍鲜少。基于此,本研究率先探讨延迟亚低温对OGD-复氧复糖诱导新生幼鼠脑白质损伤的改善作用及其可能机制。现报道如下。
材料与方法
1.主要仪器试剂:主要仪器:-80℃冰箱 (Thermo 700 SERIES,美国Thermo公司)、荧光倒置显微镜 (Nikon IX7,日本Nikon公司)、电子分析天平 (Kern770,德国Kern公司)、pH计 (Satorius PB-10,德国Satorius公司)、超净台(Thermo d-63415,美国Thermo公司)、实时荧光定量PCR仪(Biorad CFX96 Touch,美国Biorad公司);主要试剂:Hoechst 33342活细胞染色液(碧云天 C1028,中国碧云天公司)、MBP Antibody(Santa Cruz sc-271524,美国Santa Cruz公司)、O4 Antibody(Merk MAB345,美国Merk公司)、山羊抗小鼠IgG H&L(Abcam ab175473,英国Abcam公司);引物序列由上海生工合成,CD32正向引物:5′-AGGCCTGGTTTGCAGCTTT-3′,反向引物:5′-CTGCCTCGCAGGGTCTTG-3′;iNOS正向引物:5′-TCACGCTTGGGTCTTGTTCA-3′,反向引物:5′-CCTTTTCC TCTTTCAGGTCACTT-3′; CD206正向引物:5′-TGTATTCTTTGCCTTTCCCAGTCTC-3′,反向引物:5′-CCTCAAAACAGACTTACCCAATAGCTG-3′;IL-10正向引物:5′-CCCAGAAATCAAGGAGCATTTG-3′,反向引物:5′-CAGCTGTATCCAGAGGGTCTTCA-3′。
2.实验动物:7天龄SD大鼠40只,雌雄不拘,选取体质量在10~16g之间[实验动物使用许可证号:SYXK(粤)2022-0002],由广东省医学实验动物中心提供[实验动物生产许可证号:SCXK(粤)2022-0002],本研究方案已由该动物中心动物伦理委员会审批通过(审批号:B202008-13)。
3.全脑灌流和OGD模型建立:该模型建立方法参照前期研究,具体操作步骤为:将全部7天龄SD大鼠麻醉,无菌条件下迅速解剖大脑,并马上放入人工脑脊液(section artificial cerebrospinal fluid, SaCSF)内[6]。以400μm厚沿冠状将大脑制成脑切片。马上将脑切片放于氧合SaCSF培养皿中,培养条件为:37℃,95% 湿度,5% CO2,培养时间不少于1h。然后将脑切片转入有灌流用人工脑脊液(perfusion artificial cerebrospinal fluid, PaCSF)的定制培养皿中。用管道将定制培养皿连接起来,构建成一个灌流系统。整个定制培养皿放于温度可调的培养箱内,用以模拟体外循环灌注。通过改变溶液,模拟OGD,如用10mmol/L的蔗糖替换PaCSF中的葡萄糖,用95% N2/5% CO2进行气体混合。当OGD结束时,灌流液重新用PaCSF溶液和继续行24h灌流。
4.亚低温干预及分组:OGD完成后,用灌流溶液换成PaCSF溶液,将40个脑片随机均分为4组,即对照组、24h组、48h组和72h组,即复温至亚低温(32℃)阶段进行持续灌流,维持不同时长(0、24、48和72h)。亚低温维持结束后再继续复温至36℃,并继续维持灌注24h。对照组保持在36℃和维持同样阶段继续灌流氧合PaCSF。
5.免疫荧光鉴定:灌注流程走完,马上拿出脑切片,加入4%多聚甲醛(paraformaldehyde, PFA)在室温下固定1h,用磷酸盐缓冲生理盐水(phosphate buffered saline, PBS)洗3遍。再加30%蔗糖溶液,放4℃冰箱一夜。第2天将其完全脱水,用OCT包埋剂将脑切片包埋;再用冰冻切片机将其制成20μm厚并放于载玻片上。室温下用含10%山羊血清(goat serum,GS)及5%牛血清白蛋白(bovine serum albumin,BSA)的封闭液封闭1h。按说明书稀释好少突胶质前体细胞(oligodendrocyte precursor cell,O4)、髓鞘碱性蛋白(myelin basic protein, MBP)的一抗,对切片进行孵育,放湿盒后在4℃冰箱一夜。第2天,用PBS洗玻片3次,再联有荧光的二抗,孵育玻片的步骤与一抗相同,室温避光1.0~1.5h。取出来用PBS冲洗3遍。再用防淬灭封片剂进行封片,镜下观察。其中,定性观察比较MBP蛋白荧光强度;定量分析O4阳性细胞数量,每张切片随机取3个视野,计数阳性细胞数量后求均值。
6.实时荧光定量PCR测定:切取脑切片部分组织,选取出其中的脑白质,用TRI Reagent提取各组织中的总RNA,用反转录试剂盒合成cDNA。按SYBR Green PCR kit说明书建立PCR反应体系,实时荧光定量PCR反应在CFX96 Touch实时荧光定量PCR仪。内参基因选用β-actin,采用2-△△Ct法计算CD32、一氧化氮合酶(inducible nitric oxide synthase,iNOS)、CD206和白细胞介素-10(interleukin-10,IL-10)基因的相对表达量。

结 果
1.延迟亚低温减轻脑白质损伤:用免疫荧光定性分析不同延迟时间下亚低温对MBP表达的影响,结果表明在亚低温32℃延迟24、48和72h组MBP蛋白荧光强度均高于对照组,并且MBP蛋白荧光强度随着延迟亚低温时长的增加而呈递增的趋势,详见图1。
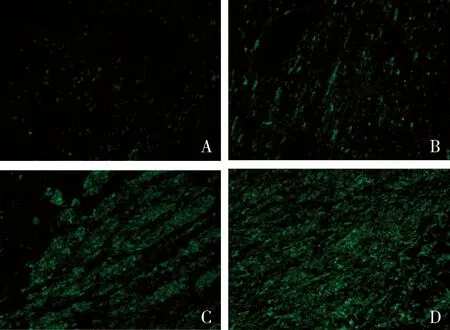
图1 各组离体脑切片MBP免疫荧光鉴定
2.延迟亚低温增加O4阳性细胞数量:用免疫荧光分析不同延迟时间下亚低温对O4阳性细胞数量的影响,结果表明在亚低温32℃延迟24、48和72h组O4阳性细胞数量均高于对照组(F=314.907,P<0.001),且发现O4阳性细胞数量的增加与延迟亚低温时长呈显著正相关(r=0.968,P<0.001),详见图2和表1。
表1 各组离体脑切片O4阳性细胞数量、M1和M2型小胶质细胞的变化比较
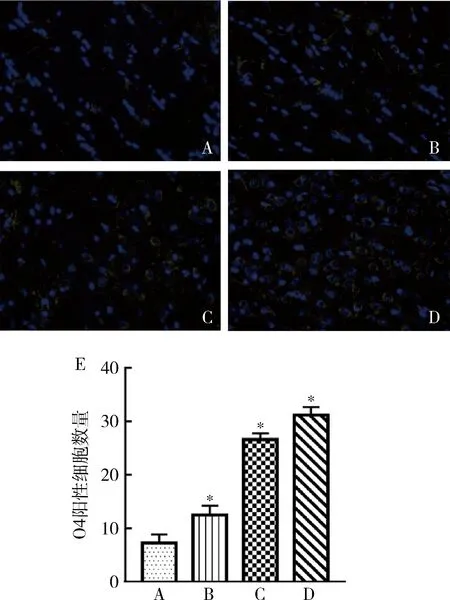
图2 各组离体脑切片O4阳性细胞数量
3.延迟亚低温降低M1型小胶质细胞的极化并促进M2型的极化:用实时荧光定量PCR分析不同延迟时间下亚低温对小胶质细胞极化的影响,结果表明在亚低温32℃延迟24、48和72h组M1型小胶质细胞的CD32、iNOS表达均低于对照组(F分别为41.451、92.912,P均<0.001),且CD32、iNOS表达均与延迟亚低温时长呈显著负相关(r分别为-0.868、-0.916,P均<0.001);M2型小胶质细胞的CD206、IL-10表达均高于对照组(F分别为79.699、63.839,P均<0.001),且CD206、IL-10表达均与延迟亚低温时长呈显著负相关(r分别为0.862、0.910,P均<0.001),详见表1。
讨 论
先天性心脏病是一类十分常见的出生缺陷性疾病[8]。在英国,婴儿先天性心脏病的发生率为0.9%;而我国则高达2.4%~10.4%[9]。随着医学外科技术、体外循环和重症监护技术等发展,先天性心脏病的致死率也随之降低[10]。然而,据统计显示,高达67%的患儿术后发生脑损伤[11]。目前,对手术中体外循环和深低温停循环诱发的脑白质损伤的研究主要集中于改进体外循环和主动脉阻断方式,对于术后复温至亚低温的研究仍为空白。
MBP是中枢神经的髓鞘膜蛋白,是少突胶质髓鞘最丰富的结构蛋白。当缺血缺氧性脑病发生后,脑白质脱髓鞘致使神经转导受累,损害机体行为认知功能[12]。当脑损伤发生时,MBP水平会明显变高[13]。MBP表达的改变可作为脑白质损伤程度的指标。本研究发现在亚低温32℃延迟24、48和72h组MBP蛋白荧光强度均高于对照组,且MBP蛋白荧光强度随着延迟亚低温时长的增加而呈递增的趋势,提示延迟亚低温能有效减轻脑白质损伤。亚低温治疗在缺血缺氧神经元中的积极作用已经得到证实[14]。据研究表明,适当的体温下降有助于维持脑皮质的正常生理功能、降低脑部氧的代谢、保障血-脑脊液屏障功能、控制神经递质大量分泌、减轻炎性反应、加快神经干的增殖和增加神经元数量,从而起到保护中枢神经的作用,以上研究结论与本研究基本一致[15]。
少突胶质细胞是脑部白质胶质细胞群中最为重要的成员[16]。O4是少突胶质细胞的前体,在胚胎成长和婴幼儿期的中枢神经系统完善进程中起着重要作用[17]。本研究发现,在亚低温32℃延迟24、48和72h组O4阳性细胞数量均高于对照组,且发现O4阳性细胞数量的增加与延迟亚低温时长呈显著正相关,提示延迟亚低温发挥脑白质损伤的作用,其机制可能与增加O4阳性细胞数量有关。未发育完善的少突胶质细胞易损性特征如下:30周胎龄中的脑白质最主要细胞是O4,一旦发生缺氧缺血时,炎性细胞因子、兴奋性氨基酸和氧自由基等将对O4造成严重损伤。早期MBP的表达减少是少突胶质细胞功能障碍所致,持续的MBP表达受抑制则是反映了少突胶质细胞数量的损伤。有研究表明,新生大鼠脑白质损伤的改善与O4细胞存活量呈相关性,通过移植O4细胞能有效发挥脑白质损伤的保护作用,该发现与本研究结果基本一致[18]。
脑白质损伤后一般可激活小胶质细胞,而活化态的小胶质细胞主要分为两类,即促炎M1型和抗炎M2型[18]。本研究结果发现,在亚低温32℃延迟24、48和72h组M1型小胶质细胞的CD32、iNOS表达均低于对照组,且CD32、iNOS表达均与延迟亚低温时长呈显著负相关;M2型小胶质细胞的CD206、IL-10表达均高于对照组,且CD206、IL-10表达均与延迟亚低温时长呈显著负相关,提示延迟亚低温发挥脑白质损伤的作用,其机制可能也与降低小胶质细胞M1型的极化和促进M2型极化有关。其可能的原因是延迟亚低温促进小胶质细胞的M2型极化,进而减缓了炎性反应的加剧和改善神经功能修复,从而保护神经系统[19]。在体内外实验中均发现,低温可明显抑制小胶质细胞OGD-复糖复氧时向M1型极化,并促进M2型极化[20]。从而诱导少突胶质细胞的分化成熟,抑制炎性反应,发挥对脑缺血后脑白质损伤的保护作用。以上结论与本研究基本一致。故在脑部早期抗炎防治过程中,除控制小胶质细胞过度活化外,平衡小胶质细胞M1/M2活化的比例,也是一种神经炎症的治疗策略。然而,本研究并无使用干预手段,少突胶质前体细胞、小胶质细胞是否确切参与治疗作用,仍有待于进一步探究。
综上所述,延迟亚低温能有效改善OGD-复氧复糖诱导的新生幼鼠脑白质损伤,其机制可能与增加O4数量和促进小胶质细胞向M2型极化有关。该研究有望为制订新生儿和婴幼儿心脏外科术后脑保护策略提供重要线索和思路。然而,本研究仍存在一定的局限性,目前只用离体新生幼鼠的脑切片灌流及OGD模型体外模拟大脑在经历手术中体外循环/深低温停循环的过程,仍需进一步开展体内研究予以证实。
利益冲突声明:所有作者均声明不存在利益冲突。
