贺兰山西坡不同海拔梯度土壤氨基糖积累特征
2024-05-06赵娅茹吴梦瑶袁丽丽王晓勤李学斌周金星庞丹波
赵娅茹,吴梦瑶,袁丽丽,王晓勤,杨 娟,陈 林,李学斌,周金星,万 龙, 庞丹波,*
1 宁夏大学生态环境学院,西北土地退化与生态恢复国家重点实验室培育基地,西北退化生态系统恢复与重建教育部重点实验室,宁夏贺兰山森林生态系统国家定位观测研究站,银川 750021 2 宁夏大学林业与草业学院,银川 750021 3 北京林业大学水土保持学院云南建水荒漠生态系统国家定位观测研究站, 北京林业大学水土保持国家林业和草原局重点实验室,北京 100083 4 内蒙古贺兰山国家级自然保护区管理局,阿拉善左旗 750306
土壤中蕴藏着大量的微生物,每立方厘米土壤微生物数量可达几百万,被誉为地球的“活皮肤”[1]。土壤微生物在陆地生态系统几乎所有生物地球化学循环中发挥着关键作用,如有机物分解、养分循环和温室气体排放等[2]。土壤微生物群落是土壤有机碳(soil organic carbon,SOC)转化的核心驱动力,对土壤和气候变化异常敏感[3],气候变暖会增加土壤有机碳矿化[4]。土壤微生物除了能参与SOC矿化外,还能在增殖—死亡过程产生大量的微生物残体直接贡献于SOC,微生物残体碳可占SOC总量的一半[5],且微生物残体缓慢的周转速率可以反映SOC的动态变化[6]。随着研究技术的发展和微生物残体标识物的应用,越来越多的学者开始关注微生物残体在评估土壤碳库组成、质量和动态变化中扮演的角色[7]。
微生物残体作为SOC的重要来源持续积聚在土壤中,在长期土壤碳动态中发挥着关键作用[8]。因此,研究全球变化背景下土壤微生物残体含量及影响因素对于理解SOC固存和稳定性过程具有重要意义。氨基糖(Amino sugars, AMs)是微生物细胞壁的组成成分,超过90%的氨基糖来源于微生物残体,而高等植物几乎不合成氨基糖,并且在土壤中的滞留时间较长[9]。目前土壤中能够被准确测定的氨基糖:主要来源于真菌细胞壁的氨基葡萄糖(Glucosamine, GluN)、来源于细菌细胞壁的胞壁酸(Muramic acid, MurN)、来源不明确的氨基半乳糖(Galactosamine, GalN)和氨基甘露糖(Mannosamine, ManN)。已有研究表明MurN和GluN分别对细菌和真菌具有高度特异性,GalN和ManN是非特异性微生物标志物[10]。GluN/MurN可以表征真菌和细菌对土壤有机碳积累的相对贡献[11]。基于氨基糖的稳定性和异源性,因此可以作为微生物残体的标识物,以量化微生物残体对SOC积累的贡献。
山地生态系统是陆地生态系统重要的生物多样性中心和生态功能区。近年来关于氨基糖的研究快速增加,然而关于山地生态系统海拔梯度变化引起的氨基糖含量响应特征及其对土壤有机碳贡献变化的研究相对不足,且得到的结论并不一致。Mou[12]等在鼎湖山的研究表明,氨基糖含量以及对SOC的贡献沿海拔梯度呈线性升高或先增高后降低的变化趋势。Zhang[13]等在长白山的研究发现,沿海拔梯度上升氨基糖含量变化规律不明显。Chen等[14]研究发现从中国东部的热带森林到北方森林土壤微生物残体含量显著增加,且主要受温度和土壤总氮的影响。Deng等[15]通过meta发现微生物和土壤C∶N共同调控微生物残体对SOC的贡献。Zeng等[16]在青藏高原和神农架的研究发现,温度、土壤属性和微生物性状可能主要通过对微生物残体的调控间接影响SOC的累积。然而,关于旱区山地不同海拔梯度土壤氨基糖的积累受哪些因素调控尚不清楚,一定程度上限制了人们对旱区山地森林土壤微生物固碳机理的认识。
贺兰山地处我国西北干旱区,其山体高耸,地质条件和内部环境复杂多样,既有因水分条件差异造成的东、西坡的分异,也有随温度变化的垂直地带性变化[17],气候和土壤在较小范围内发生显著变化,是理想的科研实验平台[18]。近年来,贺兰山海拔梯度土壤微生物群落的研究受到重视,关于土壤氨基糖含量、氨基糖对SOC的贡献以及影响因素未见有相关研究。因此,本文以贺兰山西坡不同海拔梯度土壤为研究对象,以氨基糖为指示物,探究不同海拔梯度土壤氨基糖的累积特征以及对土壤有机碳的贡献,拟解决以下科学问题:(1)贺兰山西坡土壤氨基糖含量以及对SOC的贡献率沿海拔梯度如何变化?(2)形成该分布特征的主要驱动因素是什么?本研究结果可为准确预测贺兰山微生物来源碳组分对全球气候变化的响应提供一定数据支撑,以期为旱区山地生态系统不同海拔梯度微生物对土壤碳库的贡献研究提供理论基础和科学依据。
1 材料与方法
1.1 研究地区与研究方法
贺兰山(38°27′—39°30′N,105°41′—106°41′E)位于宁夏回族自治区与内蒙古自治区交界处,银川平原和阿拉善高原之间[19]。东坡为宁夏自治区管辖,与草原连接,水热条件较好;西坡为内蒙古自治区管辖,与荒漠相连,气候寒冷干燥[20]。贺兰山处于典型大陆性气候范围内,具有山地气候特征。年均气温8.5—9.0℃,年均降雨量200—400 mm,年均蒸发量2000 mm,贺兰山降雨量有明显的垂直分布规律[21],平均上升100 m,降雨量增加13.2 mm,其降水主要集中在6—8月份,占全年降水量的60%—80%[22]。
1.2 样地设置
2021年8月,在宁夏贺兰山西坡海拔1800—3000 m之间,分别选取具有代表性的荒漠草原(HM)、灰榆林(HY)、灌木林(GM)、油松林(YS)、山杨杜松混交林(HJ)、云杉杜松混交林(QHJ)、青海云杉林(QH)、高山草甸(CD)等8种海拔植被带,在每个植被带内按等高线设置6个标准样地作为重复,森林样地选取20 m×20 m,灌木样地选取5 m×5 m,草地样地选取1 m×1 m[23]。对植物群落进行调查,样地信息见表1。

表1 样地基本信息表Table 1 Basic information of sample plots
1.3 土壤样品采集
2021年8月在贺兰山西坡按照海拔高度和主要植被类型采集土壤样品。在每个标准样地采样时,去除表面的凋落物,利用五点取样法采集表层土(0—20 cm)并混合,随后置于提前准备的自封袋装入冰盒带回实验室,去除土壤样品的植物根系和石块过2 mm筛后分成2份,一部分自然风干,用于土壤理化性质以及氨基糖的测定,另一部分在-80℃下冷藏保存,用于土壤微生物PLFAs的测定。
1.4 数据测定
1.4.1土壤理化性质测定
采用pH计测定土壤pH(水土比2.5∶1);土壤容重采用烘干法;土壤含水量用环刀法测定;土壤有机碳采用重铬酸钾外加热法测定;土壤全氮采用凯氏定氮法;全磷采用HClO4-浓H2SO4外加热消煮法、分光光度法[24]。
1.4.2土壤微生物群落测定
磷脂脂肪酸常被用来用作微生物群落标记物,土壤微生物群落测定采用磷脂脂肪酸分析法,采用Frostrgard等[25]和Bossie等[26]方法,具体操作步骤为:土壤样品经冷藏干燥处理后,称取8.0 g鲜土样品,按照1:2:0.8的比例加入氯仿、甲醇和磷酸缓冲液提取,后在SPE(Solid-phase extraction)硅胶柱上分离得到磷脂脂肪酸。样品经温和碱性甲醇分解形成脂肪酸甲酯(Fatty acid methyl esters,FAMEs)后,在己烷中溶解,以19:0正十九烷酸甲酯作为内标物,用气相色谱仪(Agilent 6890 N)测定,结合MIDI Sherlock微生物鉴定系统(Version 4.5;MIDI Inc., Newark, DE)对PLFAs进行鉴定。表征微生物的PLFAs标志物有:细菌(i15:0,a15:0, i16:0,16:1w7c, i17:0,a17:0,17:1w8c,cy17:0,18:1w8c,cy19:0);真菌(18:2w6c,18:1w9c);放线菌(16:0 10-methy1,17:0 10-methy1,18:0 10-methy1)。
1.4.3土壤氨基糖测定
土壤氨基糖测定采用Indorf等[27]邻苯二酚(O-Phthalaldehyde,OPA)柱前衍生-高效液相色谱法(High-performance liquid chromatograghy method,HPLC)。具体操作步骤为:取1g干土于水解中,加入10 mL 6 mol/L盐酸,在烘箱中105℃下放置6 h后进行水解,并使用OPA衍生,使用配备十八烷基硅化硅胶凝胶柱(Octadecylsily,ODS)的高效液相色谱仪分离,使用激发波长330 nm和发射波长为445 nm的荧光检测器检测,采用混合氨基糖的标准溶液色谱图对氨基糖进行鉴定和定量。根据以下公式计算真细菌残体碳[28]:真菌残体碳(mg/kg)=(氨基葡萄糖含量(mg/kg)/氨基葡萄糖摩尔质量(179 g/mol)-2×胞壁酸含量(mg/kg)/胞壁酸摩尔质量(251 g/mol)×氨基葡萄糖摩尔质量(179 g/mol)×9;细菌残体碳(mg/kg)=胞壁酸含量(mg/kg)×45。采用土壤细菌、真菌残体碳占SOC含量的比例来表征土壤细菌、真菌残体对SOC积累的贡献。
1.5 数据分析
采用Excel、IBM SPSS Statistics 27和Canoco 5对数据进行整理、分析和统计,利用Origin 2022对数据进行作图。通过One sample Kolmogorov-Smirnov检验数据正态分布,采用单因素方差分析(One-way ANOVA)和最小差异显著法(LSD)比较各个变量分别在不同海拔之间的差异(P<0.05)。采用方差分解分析(Variance partitioning analysis,VPA)的方法分析各影响要素对土壤氨基糖含量及对其SOC相对贡献。其中土壤理化性质(含水率、pH、TN、TP、SOC和C:N)和微生物PLFAs含量(真菌PLFAs含量和细菌PLFAs含量)作为自变量,氨基糖含量及氨基糖对SOC贡献率(GluN、MurN、GalN、T-AMS、BR/SOC、FR/SOC、TR/SOC)作为因变量,相对贡献的结果采用韦恩图进行描述。采用冗余分析(Redundancy analysis,RDA)的方法来检验土壤理化性质、微生物PLFAs含量和海拔梯度对土壤氨基糖含量及其对SOC贡献率的影响是否显著。在Excel中对微生物PLFAs含量和氨基糖单体和总氨基糖含量进行Log转换,GP:GN、F:B和GluN/MurN为原始数据,用于分析其沿海拔梯度上升的变化规律。
2 结果分析
2.1 不同海拔梯度土壤理化性质
贺兰山不同海拔梯度土壤理化性质存在显著差异(P<0.05,表2)。随着海拔梯度的升高,土壤含水率、全氮和有机碳整体呈现升高趋势,而容重整体表现为降低趋势;全磷没有明显的规律,在2183 m最大、1848 m最小;pH整体呈现降低趋势,但土壤总体偏碱性(pH>7),1848 m最小而2707 m最大;C:N先降低后升高,在海拔2183 m最小,在2940 m达到最大值。

表2 不同海拔梯度土壤基本理化性质Table 2 Soil physical and chemical properties at different elevation gradients
2.2 不同海拔梯度土壤微生物PLFAs含量
研究发现贺兰山西坡微生物含量随海拔梯度不同表现出明显的变化规律(P<0.01,图1)。细菌、真菌、放线菌、丛枝菌根真菌、革兰氏阳性菌、革兰氏阴性菌和微生物总PLFAs都沿海拔梯度上升表现为先升高后降低的趋势,在海拔2360 m含量最高,1848 m含量最低。GP:GN在1848—1910 m表现为降低趋势,1910—2910 m无明显变化,该比值介于0.360—0.940之间;F:B在1848—2707 m无明显变化,比值在0.239—0.535之间,即在此海拔区间土壤微生物是以细菌为主体的群落结构,海拔2940 m处F:B显著增大,比值在0.311—2.699之间,平均值为1.355。
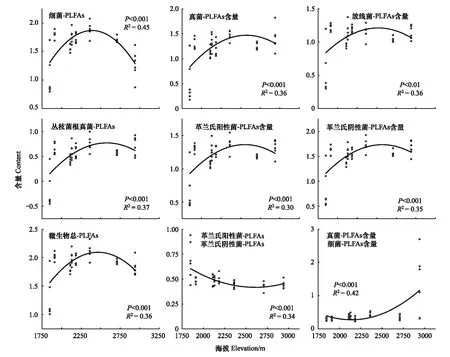
图1 不同海拔梯度土壤微生物PLFAs含量Fig.1 Phospholipid fatty acids (PLFAs) contents at different elevation gradientsPLFAs:磷脂脂肪酸Phospholipid fatty acids;AMF:丛枝菌根真菌Arbuscular mycorrhizal fungi;GP:革兰氏阳性菌Gram-positive bacteria;GN:革兰氏阴性菌Gram-negative bacteria
2.3 不同海拔梯度土壤氨基糖积累特征
贺兰山西坡氨基糖单体和总氨基糖含量随海拔梯度表现出明显的变化规律(P<0.001,图2)。沿海拔梯度上升,MurN和ManN含量在海拔1848—2360 m表现为降低趋势,在2707—2940 m表现为升高趋势;GluN以及总氨基糖含量总体呈上升趋势;GalN含量在低海拔到中海拔区域略有降低,而后在高海拔处升高,无论是氨基糖单体含量还是总氨基糖含量最大值都出现在2940 m;除MurN含量最小值在2360 m,其余氨基糖单体和总氨基糖含量最小值都在1848 m。GluN/MurN沿海拔梯度上升表现为先升高后降低的变化趋势。

图2 不同海拔梯度氨基糖含量Fig.2 Amino sugars contents at different elevation gradients
2.4 不同海拔梯度土壤氨基糖对有机碳的贡献
由图3可知,沿海拔梯度上升,真菌、细菌残体碳以及总残体碳对SOC的贡献率都表现为低海拔区域(1848—1910 m)高、中海拔区域(2110—2360 m)和高海拔区域(2707—2940 m)低的变化规律;真菌以及总残体碳对SOC的贡献率在1910 m最大而2110 m最小;细菌残体碳对SOC的贡献率在海拔2707 m最小。真菌残体碳对SOC的贡献率明显高于细菌,说明真菌主导了贺兰山西坡不同海拔梯度土壤微生物残体碳对SOC的贡献。
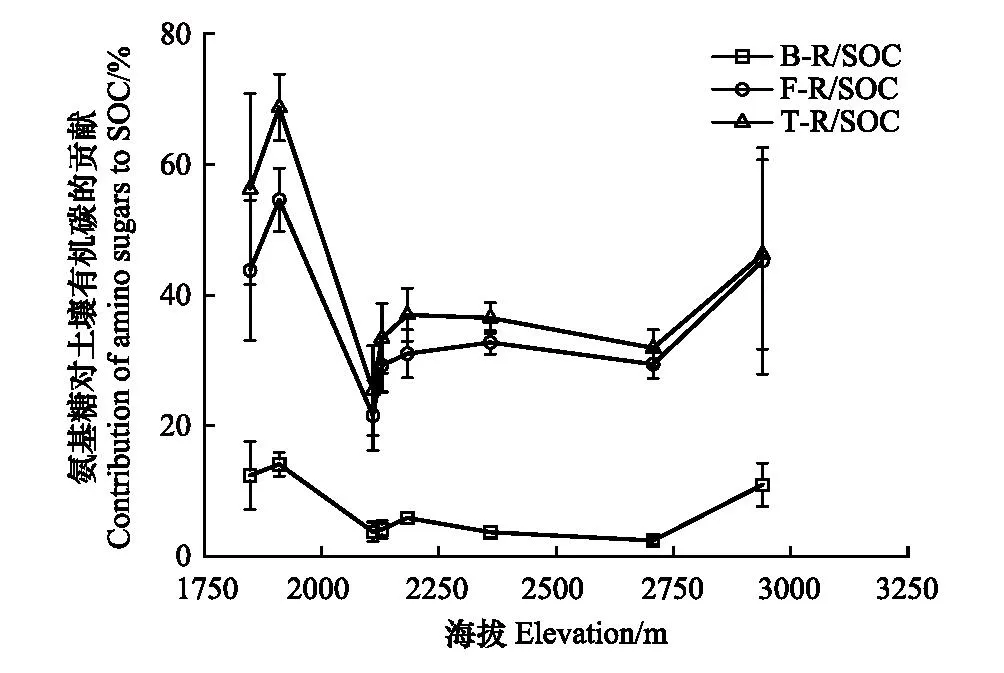
图3 不同海拔梯度氨基糖对土壤有机碳的贡献Fig.3 Contribution of amino sugars to soil organic carbon at different elevation gradientsB-R/SOC:细菌残体碳对土壤有机碳贡献率;F-R/SOC:真菌残体碳对土壤有机碳贡献率;T-R/SOC:总残体碳对土壤有机碳贡献率
2.5 不同海拔梯度土壤氨基糖及其对SOC贡献的调控因素
方差分解结果表明(图4),两组解释变量总共解释了土壤氨基糖含量及氨基糖对SOC贡献率变异的55.2%。其中,土壤理化性质解释了变异的52.9%,磷脂脂肪酸含量解释了变异的26.9%,两组变量交互作用共同解释的变异为24.6%。去除共同解释部分后,土壤理化性质净解释了变异的28.3%,微生物PLFAs含量净解释了变异的2.3%。

图4 微生物 PLFAs含量和土壤理化性质对土壤氨基糖的方差分解(VPA)Fig.4 Variation partitioning analysis (VPA) of soil amino sugars by PLFAs contents and soil physicochemical properties
冗余分析结果表明(图5,表3,表4),RDA1和RDA2分别解释了土壤氨基糖含量及氨基糖对SOC贡献率的36.24%和22.67%。由图5,土壤容重、pH与真菌、SOC、海拔、SWC以及TN负相关;真菌、细菌残体碳和总残体碳对SOC的贡献率与pH正相关,而GluN/MurN、全氮以及土壤含水量与真细菌残体碳和总残体碳对SOC的贡献率负相关。GalN、GluN及总氨基糖含量与碳氮比正相关。由表3,各调控因素中解释量最大的为SOC,解释量最小的为TP,SOC、TN、SWC、C:N、pH以及海拔梯度(P<0.05)是土壤氨基糖含量及氨基糖对SOC贡献率的主要调控因素。
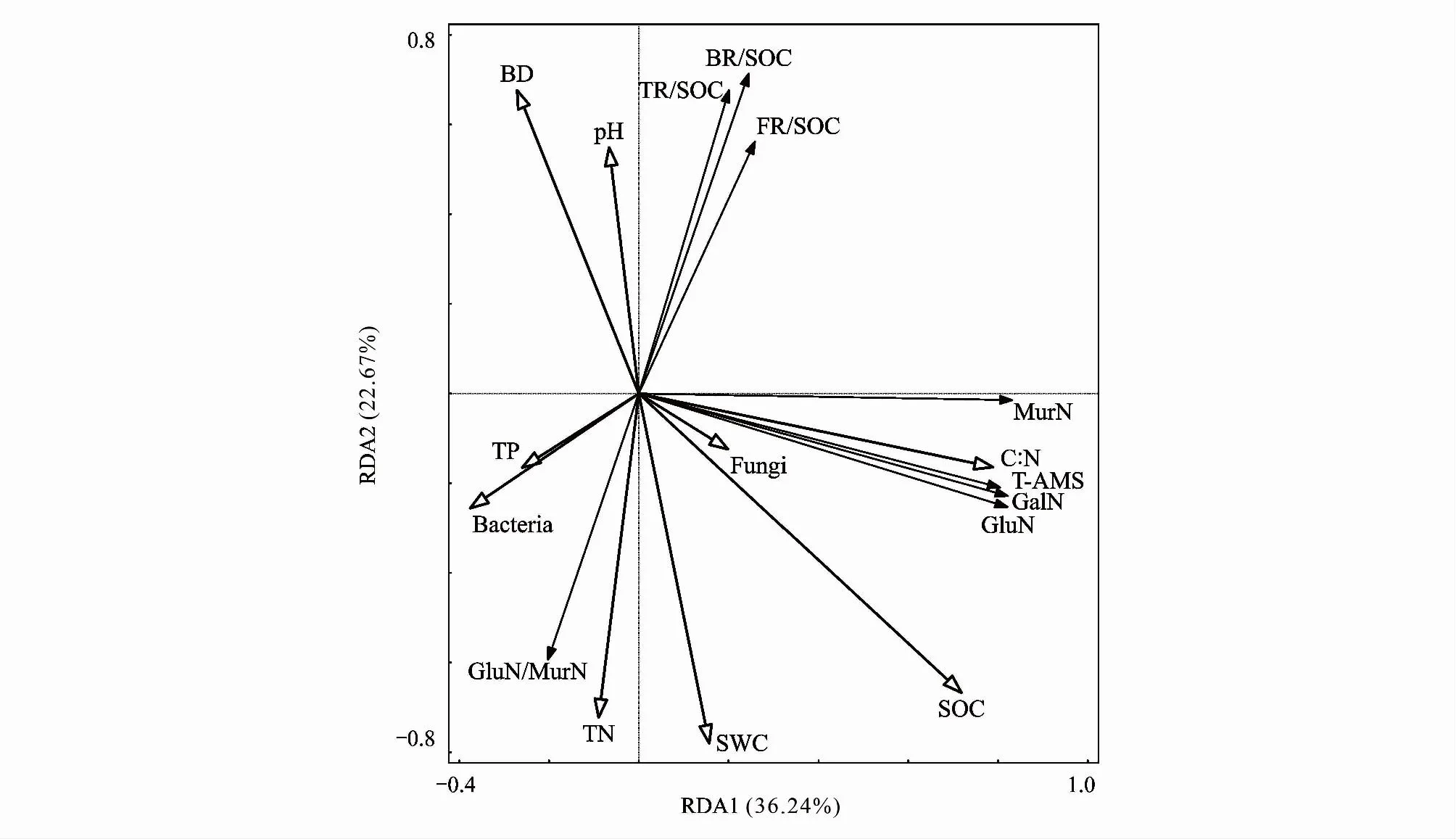
图5 土壤氨基糖与土壤理化性质和微生物PLFAs含量的冗余分析Fig.5 Redundancy analysis of soil amino sugars with soil physicochemical properties and microbial PLFAs contentsT-AMS:总氨基糖Total Amino sugars;Fungi:真菌PLFAs含量;Bacteria:细菌PLFAs含量;MurN:胞壁酸;GalN:氨基半乳糖;GluN:氨基葡萄糖;ManN:氨基甘露糖;GluN/MurN:氨基葡萄糖含量与胞壁酸含量之比

表3 土壤理化性质和微生物PLFAs含量对土壤氨基糖的解释量和显著性检验结果Table 3 Results of interpretation and significance tests of soil physicochemical properties and microbial PLFAs contents

表4 土壤氨基糖与土壤理化性质和微生物PLFAs含量的冗余分析结果Table 4 Results of the redundancy analysis of soil amino sugars with soil physicochemical properties and microbial PLFAs contents
3 讨论
3.1 海拔梯度对土壤微生物生物量的影响
土壤微生物的海拔分异格局是气候条件和土壤性质空间异质性共同作用的结果[29]。研究结果显示,沿海拔梯度上升,微生物各类群PLFAs含量呈现先增加后减少的变化趋势,在海拔2360 m高于其他海拔,这一结果与马进鹏等[30]在贺兰山东坡研究土壤微生物各类群PLFAs含量沿海拔梯度变化的趋势相同。曹丽花等[31]在色季拉山研究不同海拔梯度土壤微生物各类群PLFAs含量发现,随海拔上升细菌和放线菌无明显变化规律而真菌PLFAs含量增加[31],可见不同海拔区域微生物PLFAs含量的变化规律并不完全相同。学术界普遍认为植物多样性沿海拔梯度上升呈现典型的单调递减[32—34]或者中海拔区域高的单峰曲线变化规律[35—37],贺兰山2360 m分布着云杉杜松混交林,林下物种相对丰富(表1),丰富的凋落物和植物光合碳输入刺激微生物增殖与周转过程,导致该海拔土壤具有更多的微生物[38]。荒漠草原(1848 m)凋落物相对较少,凋落物的转化效率和土壤碳输入量较低,导致营养状况低(TN和SOC较低),由于缺乏能源物质,微生物数量少且活性较低[39]。因此,高海拔处微生物各类群以及总PLFAs含量都略有下降,可能是因为随着海拔梯度的升高温度降低,尽管高海拔地区的低温可能有利于养分积累,但其矿化的限制也会抑制养分可用性和微生物积累[40]。
一般认为F:B可判断土壤生态系统稳定性[41]和两种类群的相对丰富程度[42],比值越高说明生态系统越稳定[22]。本研究中,F:B在2940 m最大,1810—2707 m比值小且无明显差异,可能是因为2940 m土壤具有较低的pH和最大的C:N(表2),真菌倾向于利用低pH和高C:N的难分解底物,而细菌相反[43—44],因此导致真菌含量高于细菌含量。土壤养分与微生物群落显著相关[45],有研究表明,GP:GN可作为土壤有机碳有效性的指示因子,GP:GN比值越小,则该土壤环境营养越丰富[45],GN倾向于使用相对不稳定的植物来源碳,而GP倾向使用更顽固的土壤有机质来源碳[46];GP的比例高则表明资源可用性低[47]。在本研究中,该比值在1848 m最大,1910—2940 m比值小且无明显差异,荒漠草原微生物含量低是由于植物物种单一、植被覆盖度低、枯落物输入量少,土壤环境较为贫瘠,因此微生物可利用的养分含量低且微生物生长受到抑制[18]。另外,荒漠草原含水量低,低含水量也会限制微生物生长[48]。
3.2 海拔梯度对土壤氨基糖累积特征的影响
四种氨基糖单体和总氨基糖含量在贺兰山西坡的累积特征受到海拔梯度的显著影响,随海拔梯度上升,GluN和GalN表现为上升趋势,而MurN和ManN为先降低后增加的变化趋势(图2),表明不同来源的氨基糖对海拔梯度上升的响应存在显著差异。土壤氨基糖和SOC含量随海拔梯度升高增加(图2,表2),说明高海拔地区土壤能积累更多的氨基糖。凋落物降解过程中会产生大量的可溶性有机碳,有利于微生物周转过程中氨基糖的积累[49]。Chen等[14]发现森林SOC与微生物残体碳呈显著正相关。贺兰山西坡2940 m分布着高山草甸,其中SOC含量较高,微生物能快速同化SOC并形成残体积累在土壤中,因此具有较高的氨基糖含量[50]。而其他海拔梯度SOC含量相对较少,因此土壤氨基糖含量偏低。
GluN/MurN可以在一定程度上反映真菌和细菌在土壤有机碳积累过程的相对贡献[44, 51],比值越大表明真菌残体对SOC积累的贡献提高,该比值随海拔梯度上升先增大,在2707 m达到最大值而后减小,说明1848—2707 m真菌残体碳对SOC的贡献大于细菌残体碳,在2940 m细菌残体的贡献增加。由于GluN的化学稳定性和MurN的快速周转使得GluN含量始终较高,而高海拔处低温和潮湿的水热条件以及pH的降低促进了微生物残体积累[16],因此MurN含量增加导致GluN/MurN减小。此外,细菌残体碳对SOC贡献率始终维持在一个较低的水平,且真菌残体碳对SOC的贡献率始终高于细菌残体碳(图3),表明贺兰山西坡不同海拔梯度土壤中真菌残体碳在SOC的积累中具有主导作用[52],这与Liang等在温带农田、草地以及森林生态系统得到的结论相吻合[8]。姚宏佳等[53]在黄土高原的研究发现农田细菌残体含量高于真菌残体碳,草地细菌残体含量低于真菌残体碳,说明不同地区微生物残体对SOC贡献的主导类群不同。
3.3 真菌和细菌对土壤有机碳累积的贡献
SOC主要有两个累积途径:植物碳收入(凋落物与根系分泌物)和微生物代谢产物及微生物残体[38]。由图3可知,低海拔和高海拔区域真菌和细菌残体碳对SOC的贡献高于中海拔地区,这与Yang等在武夷山得到的结果一致[54],说明在中海拔区域植物来源碳占据SOC的大部分。贺兰山中海拔地区分布着以油松、云杉、杜松为优势物种的针叶林或山杨和杜松为优势物种的针阔混交林,凋落物中含有木质素、单宁等顽固的化学组分难以被微生物利用,因此导致土壤中植物来源碳大于微生物来源碳[55—56],但中海拔良好的水热条件促进微生物代谢与积累,导致中海拔区域具有较高的微生物含量[30]。本研究推测植物来源碳大于微生物来源碳,今后应采用木质素作为植物来源碳指示物,对其进行更加科学合理的解释[57]。同时,不同海拔梯度下气候差异也是导致氨基糖含量产生差异的原因,氨基糖比有机碳更易受到水热条件变化的影响[58],Shao等[58]在半干旱草地模拟气候变化实验的结果显示,总氨基糖和氨基葡萄糖含量均随降水的增加而显著增加,随温度的升高而降低,而降水增加和变暖均不影响胞壁酸含量。Zeng等[16]在青藏高原和神农架的研究表明温度随海拔梯度增加而降低,真菌与细菌来源氨基糖含量随着温度的上升而降低,随土壤水分的减少而降低,说明土壤水分和温度对土壤氨基糖产生影响,不同地区真菌和细菌来源的氨基糖对水分和温度的变化响应不同。本研究中,土壤含水率随海拔上升而增加(表2),温度随海拔梯度上升而降低[4],这可能是各个氨基糖单体和总氨基糖总体呈现出升高趋势的原因之一。
真菌主导了贺兰山西坡微生物残体碳对SOC的贡献(图3),这可能是因为真菌残体与细菌残体化学稳定性不同,真菌残体会与土壤团聚体和矿物结合获得物理保护而具有更大的稳定性[59],因此真菌残体更易在土壤中积累。有研究显示,贺兰山土壤环境受N和P元素的限制[60],细菌残体会优先降解满足N限制土壤中微生物生长的需求[61],不利于细菌残体碳对SOC的贡献。冗余分析结果表明,SOC、TN、SWC等对氨基糖含量及其对SOC的贡献率解释量更大(表3),说明土壤理化性质是调控氨基糖积累的主要因素,且VPA分析表明土壤理化性质(52.9%)相比微生物PLFAs含量(26.9%)和它们之间的交互作用(24.6%)对氨基糖含量及其对SOC的贡献率更大。Zhang等[13]在长白山研究发现土壤pH和C:N是微生物残体分布格局的最重要驱动因素。杨家明等[62]在高寒草甸的研究显示土壤pH、TN和SOC是细菌和真菌残体碳及微生物残体碳的主要影响因子。张世良等[63]在马尾松纯林和马尾松木荷混交林研究发现TN和凋落物C:N是影响土壤氨基糖变化的主要因素。因此,不同地区土壤氨基糖含量的影响因素会产生差异。以往的诸多研究都表明虽然微生物PLFAs含量为瞬时指标,但是在一定程度上与死亡残体的累积量成正比[54]。而本研究表明土壤氨基糖的积累与微生物PLFAs含量并未完全耦合,土壤理化性质是主要影响因素,这与牟之建等[12]在鼎湖山、王全成等[64]在亚热带森林以及Ma等[65]在半干旱草原上得到的结论一致。
4 结论
本研究发现,贺兰山西坡海拔梯度对土壤微生物群落结构和土壤氨基糖的积累产生显著影响,微生物PLFAs含量表现为中海拔区域高、低海拔区域和高海拔区域低。高海拔区域土壤能积累更多的氨基糖,氨基糖单体和总氨基糖含量表现为高海拔区域高,低海拔区域和中海拔区域低。在不同海拔梯度上,与细菌残体碳相比,真菌残体碳占SOC比例更高,表明在贺兰山西坡不同海拔梯度真菌残体碳对SOC贡献率占据主导地位。海拔梯度通过改变土壤理化性质,间接影响氨基糖在土壤中的积累,土壤理化性质相比微生物PLFAs含量对氨基糖在土壤中积累的影响更为重要。因此,在研究微生物驱动SOC存储与转化机制过程中,不能将氨基糖积累的差异单一归因于微生物含量的变化。
