太湖底栖动物时空分布特征及基于底栖动物完整性指数的水生态健康评价
2024-05-05陶艳茹董稳静罗明科李则婵许秋瑾
陶艳茹,董稳静,罗明科,李则婵,庞 燕*,许秋瑾*
1.中国环境科学研究院,湖泊水污染治理与生态修复技术国家工程实验室,北京 100012
2.中国环境科学研究院,国家环境保护湖泊污染控制重点实验室,北京 100012
3.中国环境科学研究院,北京 100012
4.安庆师范大学,安徽 安庆 246133
随着我国城市化进程和经济社会的快速发展,许多流域进行了高强度开发,污染排放和大坝建设等人类活动严重影响了湖泊生态环境[1-2].21 世纪环境面临着生物多样性的衰退,这是全球性的问题[3].国外对流域水生态保护的重视起步较早.2000 年,欧盟颁布了《水框架指令》(WFD),重视水生态系统的结构和功能[4].2002 年,美国颁布了新的《清洁水法》(CWA),强调水体的化学、物理和生物完整性[5].相较于国外,我国前期更注重水环境保护.根据2022 年《中国生态环境状况公报》,我国Ⅰ~Ⅲ类水质(GB 3838-2002《地面水环境质量标准》)断面比例为87.9%,较2021年高3.0%,劣Ⅴ类水质断面比例较2021 年降低0.5%.然而,在水污染防治工作取得显著成效的同时,我国水生态系统失衡问题依然存在,水生生物数量减少、生物多样性下降等成为建设美丽中国的突出短板和瓶颈问题[6-7].
基于生物群落信息对水生态环境进行评估,是评价湖泊生态健康的有效手段之一[8-9].1981 年,Karr 建立了鱼类生物完整性指数(F-IBI)评价方法[10];而后,衍生出基于大型底栖无脊椎动物、浮游生物和着生藻类的生物完整性评价方法,也被用于水生态健康状况评价[11-13].底栖动物体积小、繁殖效率高,对湖泊生态系统的环境变化高度敏感,其丰富度和群落结构等被视为水质和生态评价的重要指标,在水生态平衡方面发挥着重要作用[14-15].基于底栖动物完整性指数(B-IBI),我国多位学者开展了生态健康评价研究,为生态保护与管理提供了重要依据.例如,冯治远等[16]对黄河干流进行了B-IBI 指数构建,探究全河段水沙异质差异下的生态健康状况;姚琦等[17]针对东洞庭湖构建了B-IBI 指数,探究不同季节的生态健康状况;王瑜等[18]对松花江流域B-IBI 指数进行研究,评价松花江流域的水生态系统健康状况.
太湖位于长江下游,是我国五大淡水湖之一,处于我国东部人口稠密、高度工业化的地区,其淡水资源为流域内居民、工农业用水和其他生物的生存提供了重要保障[19].1960s,太湖水体处于中营养状态;自1980s 以来,太湖富营养化程度加剧,威胁到水质和生态健康,严重影响了太湖周边和流域下游地区的供水安全[20].底栖动物群落结构对生态系统健康有重要作用,然而,太湖不同湖区间底栖动物群落结构以及水生态健康状况受水期变化影响的研究较少.因此,摸清太湖底栖动物种类组成和多样性格局、评估生态健康状况,对太湖水生态系统的保护具有重要意义.鉴于此,本研究在太湖不同湖区布设了16 个采样点,通过分析底栖动物的种类组成和时空格局,并构建B-IBI 指数,对湖泊水生态进行健康评价,以期为太湖水生态系统保护提供预警和数据支撑.
1 材料与方法
1.1 样品采集与分析
根据太湖的水文特征,将太湖水域划分为5 个湖区并设置16 个采样点(见图1),分别为北部湖区(TH1、TH2、TH3 和TH4)、西部湖区(TH5、TH6 和TH7)、南部湖区(TH8、TH9、TH10)、东部湖区(TH11、TH12、TH13)和中部湖区(TH14、TH15 和TH16).2023 年,在枯水期(2 月)、平水期(5 月)、丰水期(8 月)分别采集水样、底泥及底栖动物,每个采样点均采集3 个平行样品,并将底栖动物样品进行混合.

图1 太湖采样点示意Fig.1 Sampling points of Taihu Lake
现场采用多参数水质监测仪〔YSI 6600 V2,赛莱默分析仪器(北京)有限公司〕测定水温、电导率、总溶解固体、酸碱度、氧化还原电位和溶解氧等物理环境因子,用塞氏盘测定透明度(SD).根据《湖泊富营养化调查规范(第二版)》和《湖泊沉积物调查规范》,采集水面以下0.5 m 深度的水样和底泥样,在冷藏箱低温保存并及时运回实验室进行后续处理.根据《水和废水监测分析方法(第四版)》[21]测定常规指标(见表1).用彼得生采泥器〔1/(16 m2)〕采集底栖动物样品,现场过0.425 mm 孔径网筛,95%酒精固定,回实验室后进行底栖动物的挑样、鉴定与计数[22].
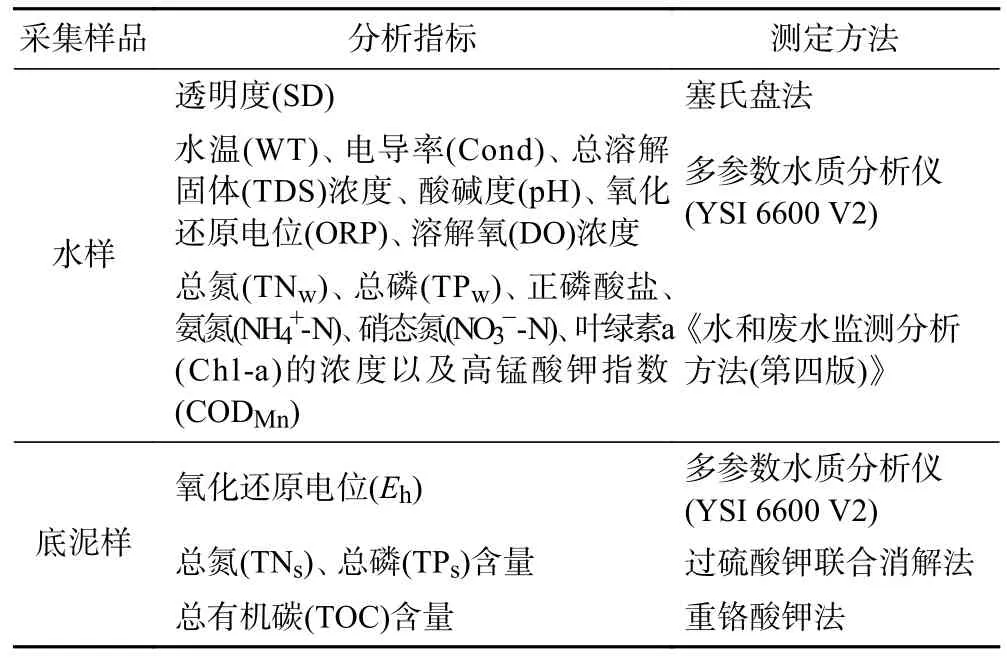
表1 样品分析指标及测定方法Table 1 Sample analysis indicators and measurement methods
1.2 生物多样性分析
计算不同水期生物多样性指数,包括Shannon-Weiner 指数、Simpson 指数、均匀度指数和丰富度指数,见式(1)~(4).
Shannon-Weiner 指数(H):
Simpson 指数(D):
均匀度指数(J):
丰富度指数(dM):
式中,S为该采样点所有底栖动物物种数,Pi为i种生物个体数与采样点底栖动物总个体数的比值,N为样本个体总数.
1.3 B-IBI 构建
1.3.1 参照点选取
蠡湖是一个既相独立又与太湖相通的水体[23];阳澄湖紧邻太湖,承担饮用水源地和生态湿地等功能,生态环境质量较好[24].这两个湖泊的生态环境质量较太湖有一定参考意义.为了扩大参照点的选取范围,增加参照点的科学性,选择太湖、蠡湖、阳澄湖作为参照点的选取区域.2023 年5 月,共选取28 个采样点采集水样,包括太湖16 个采样点、蠡湖6 个采样点和阳澄湖6 个采样点,参考何晨凤[25]的方法,计算采样点的综合营养状态指数(TSI),并对其进行排序,选取TSI<30 的采样点作为参照点.综上,本研究选取6 个采样点作为参照点,包括太湖的TH11、TH12、TH15、TH16,蠡湖的LH1,以及阳澄湖的YCH1.
1.3.2 候选生物指标
根据已有的分类方法[9,15-18]确定32 个候选指标(见表2).

表2 候选生物指数Table 2 Candidate biological index for B-IBI
1.3.3 指标筛选
通过分布范围、判别能力和相关性分析对生物指标进行筛选,剔除冗余指标.
生物指标数据的赋值:分别应用三分法、四分法和比值法计算参照点和受损点的分值,选取判别能力较高的方法进行记分以统一量纲.
评分标准确定:以参照点B-IBI 值分布的理想值作为湖泊健康评价标准,对各采样点进行健康评价.
1.4 统计分析
使用SPSS 25.0、Origin 2018、ArcGIS 10.8.1 软件进行数据分析、统计检验和图形绘制.
2 结果与讨论
2.1 水质及底质
2023 年太湖水质和底质状况分析结果如表3 和表4 所示.从枯水期到平水期再到丰水期,太湖水体TDS、ORP、TNw 浓度整体呈下降趋势,TPw、Chl-a、CODMn浓度呈升高趋势;底泥的含水率、TPs、TOC含量随水期呈现先升高后降低的趋势,TNs含量变化幅度较小,整体较稳定.丰水期的Chl-a 浓度明显升高,平均值为51.13 µg/L,部分采样点达到214.10 µg/L.这是因为丰水期气温高且大量降水带来外源有机质,更容易形成富营养化[26].Yin 等[27]的研究也表明,太湖Chl-a 浓度从1984 年的12.8 μg/L 升至2019 年的32.3 μg/L,太湖水体富营养化问题不容忽视.

表3 太湖不同水期水体及底泥的环境状况Table 3 Environmental conditions of water and sediment in different water periods of Taihu Lake

表4 太湖不同湖区水体及底泥的环境状况Table 4 Environmental conditions of water and sediment in different regions of Taihu Lake
从不同区域来看,太湖西部和北部湖区的水污染程度较重,尤其是Chl-a 浓度明显高于其他湖区.这可能是因为太湖西部和北部属于河口区,受陆地污染源和河流污染源沿河口汇入的双重影响[28].这两个湖区TNw、TPw浓度较高,促进了浮游植物生物量显著增加,水华风险较高[29].南部、中部和东部湖区受污染影响相对较小,水质优于西部和北部湖区,环境质量较好.
2.2 底栖动物群落结构
2.2.1 物种组成
太湖生境复杂,造就了不同的底栖动物群落特征.2023 年,在太湖16 个采样点共采集到1 116 个底栖动物,共包含3 门(环节动物门、节肢动物门、软体动物门)7 纲(寡毛纲、多毛纲、蛭纲、甲壳纲、昆虫纲、腹足纲、双壳纲)15 目18 科38 种(见表5).其中节肢动物和软体动物种类较多,分别为16 种和15 种;环节动物最少,为7 种.
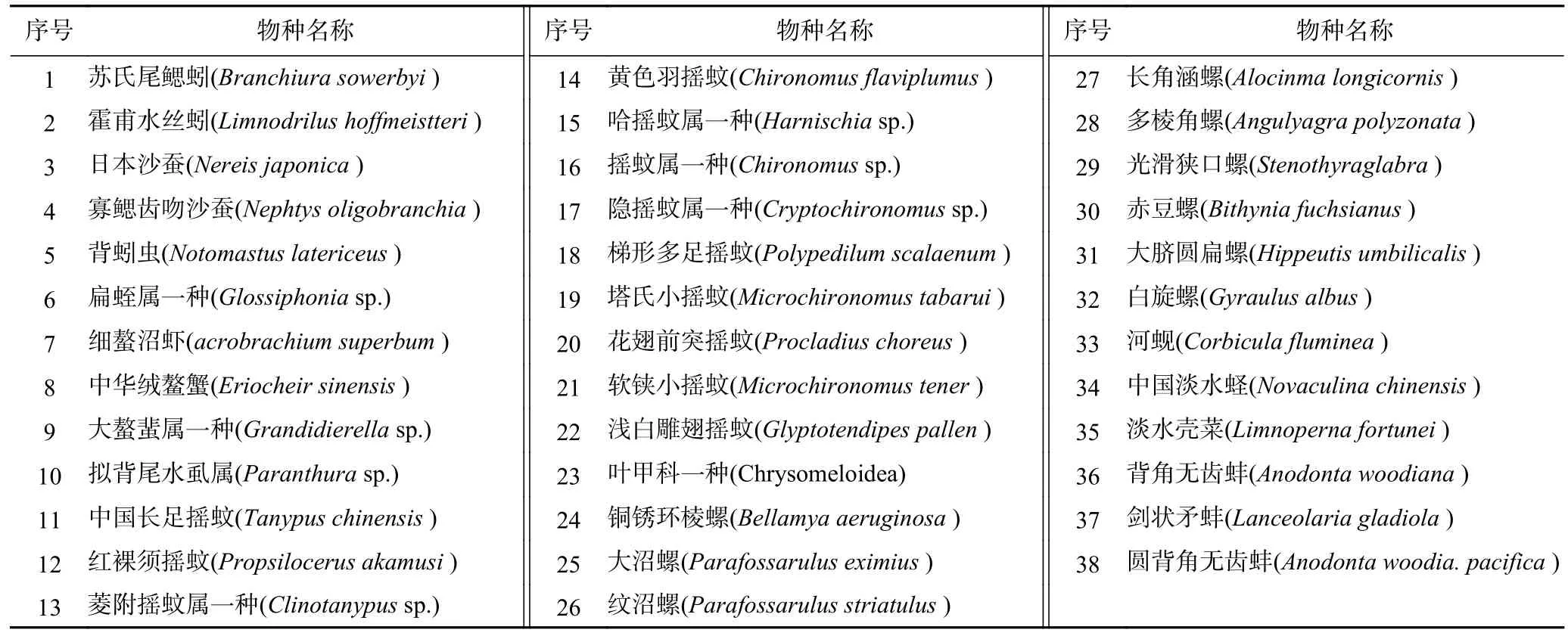
表5 太湖底栖动物物种Table 5 Benthos in the Taihu Lake
从生物个体数来看,平均每个采样点采集到底栖动物23 个,最大值出现在北湖的TH1 采样点.软体动物数量(482 个)最多,其中河蚬占57%;其次为节肢动物(341 个),摇蚊科占67%;环节动物最少(293 个),主要为寡鳃齿吻沙蚕,占69%.寡鳃齿吻沙蚕、大螯蜚属一种、拟背尾水虱属、铜锈环棱螺、河蚬为优势种(优势度˃0.02).这与温舒珂等[30]的研究结果类似,太湖北部的梅梁湾以摇蚊幼虫和软体动物为主,优势种经历了由较敏感的软体类为主到以耐污寡毛类、摇蚊幼虫等为主的转变.
1960s 以来,太湖底栖动物种类数最高纪录为59种[31].2012 年,蔡琨等[9]对太湖32 个采样点的底栖动物进行了调查,鉴定出底栖动物68 种.2014 年,许浩等[31]在太湖记录底栖动物55 种,隶属3 门7 纲18目27 科52 属.此外,温舒珂等[30]调查了太湖北部的梅梁湾,1980-2019 年共记录到44 属(种)底栖动物.与以往研究对比,本研究中太湖底栖动物的种类数量整体较低,表明太湖的生境可能受到一定程度的破坏.这可能是因为城镇化等多种人类活动导致湖泊营养状态发生改变,整体上呈现出富营养化程度逐渐加重的趋势,水体DO 浓度降低,底栖动物的饵料来源减少,导致底栖动物种类和数量降低[32].
2.2.2 空间差异
太湖不同湖区的底栖动物个体数量存在差异,总体呈现出北部湖区˃西部、南部、中部湖区˃东部湖区的趋势〔见图2(a)〕.在北部湖区,节肢动物最多,占60.78%;软体动物最少,占5.45%.相反,在其他湖区,软体动物最多,节肢动物最少.这主要是由湖区间的生境质量、底质组成和水生植物覆盖度差异引起的.

图2 太湖不同湖区底栖动物的分布情况Fig.2 Community characteristics of benthos in different regions of the Taihu Lake
各湖区均有分布的物种有7 种,分别为苏氏尾鳃蚓、寡鳃齿吻沙蚕、背蚓虫、大螯蜚属一种、铜锈环棱螺、河蚬和中国淡水蛏.耐污物种霍甫水丝蚓、寡鳃齿吻沙蚕、中国长足摇蚊、红裸须摇蚊和黄色羽摇蚊多分布于北部湖区,拟背尾水虱属在北部湖区基本不出现.底栖动物物种组成空间差异可能归因于人为活动影响.北部湖区受到农业污染,富营养化最严重,因此耐污能力较强的底栖动物较多,这与蔡永久等[33]得出的太湖北部的梅梁湖的指示种为霍甫水丝蚓的结论一致.西部湖区汇入河口较多,外源污染较多,耐污物种大螯蜚属一种、铜锈环棱螺的数量也显著高于其他湖区.东部湖区水环境质量最好、水生植物覆盖度最高,为底栖动物提供食物和庇护场所,生物多样性明显优于其他湖区〔见图2(b)〕.河蚬在中部湖区分布最多,这是因为中部湖区常年受风力扰动,水体营养盐水平低,底质沉积物少,个体小的类群难生存,因此,个体较大的河蚬在中部湖区分布更多,这与张爱菊等[34]得到的中部湖区河蚬较多的结论一致.
2.2.3 水期差异
太湖不同水期的底栖动物种类存在差异,枯水期的底栖动物种类最少,为21 种,平水期和丰水期的底栖动物种类数相同,为26 种.其中,在不同水期共同检测到的底栖动物有14 种;枯水期特有的物种有3 种,分别为红裸须摇蚊、梯形多足摇蚊、花翅前突摇蚊;平水期特有的物种有7 种,分别为哈摇蚊属一种、软铗小摇蚊、浅白雕翅摇蚊、多棱角螺、赤豆螺、大脐圆扁螺、背角无齿蚌;丰水期特有的物种有6 种,分别为细螯沼虾、摇蚊属一种、叶甲科一种、白旋螺、剑状矛蚌、圆背角无齿蚌.寡鳃齿吻沙蚕、河蚬和铜锈环棱螺在不同水期均是常见物种(出现频率˃50%);大螯蜚属一种是枯水期特有的常见种;中国淡水蛏是平水期特有的常见种;丰水期特有的常见种最多,有拟背尾水虱属、背蚓虫、大螯蜚属一种.此外,随着水期变化,蚌目种类逐渐增多,这可能是因为水体富营养化,以藻类和浮游生物为主要食物的蚌目生境适宜性上升[35].
不同水期生物个体数量表现为平水期(435 个)˃枯水期(381 个)˃丰水期(300 个)〔见图3(a)〕.枯水期,河蚬数量最多,为106 个,其次为红裸须摇蚊66 个、寡鳃齿吻沙蚕58 个,这3 种生物占比达到60%;平水期,黄色羽摇蚊数量最多,为130 个,其次为河蚬88 个、铜锈环棱螺56 个,这3 种生物占比达到63%;丰水期,摇蚊数量明显减少,寡鳃齿吻沙蚕数量最多,为94 个,其次为河蚬81 个、铜锈环棱螺39 个,这3种生物占比达到71%.太湖底栖动物个体数量变化主要由摇蚊类变化占主导地位,尤其北部湖区摇蚊类的数量受水期变化的波动较大.这是因为摇蚊的幼虫生活在水体中,丰水期的气温高,摇蚊的幼虫会羽化并飞离水体,种类和数量均降低[36].丰水期铜锈环棱螺和河蚬的数量明显减少,前3 种优势生物占比达到71%,且常见种较多,物种组成相对单调,生物多样性较低〔见图3(b)〕.
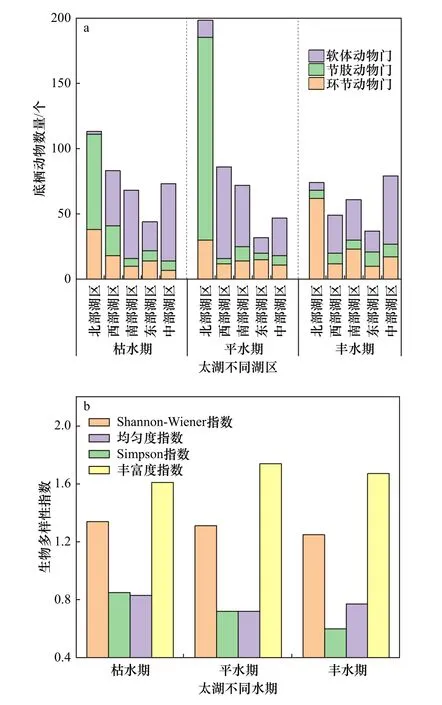
图3 太湖不同水期的底栖动物群落特征Fig.3 Community characteristics of benthos during different water periods in Taihu Lake
2.3 太湖B-IBI 体系构建
2.3.1 指标筛选
分布范围分析:分析6 个参照点的32 个候选指标分布情况.其中,M2、M4、M5、M6、M7、M8、M15、M17、M18、M19、M20、M21、M27、M30 和M31 的零值过多,M9、M24 的分布范围过窄,不适宜B-IBI指标体系的构建,均予以剔除.
判别能力分析:对剩余15 个指标,比较参照点和受损点的25%分位数至75%分位数范围(箱体IQ值重叠情况)并赋值,各自的中位数均在对方箱体内,IQ=0;只有一个中位数在对方箱体内,IQ=1;各自的中位数均不在对方箱体内,IQ=2.由图4 可知,M12、M13、M16、M22、M23、M25、M28、M29 和M32 的生物指数的IQ 值≥1,保留以做下一步分析.

图4 候选生物指标参照点和受损点箱线图Fig.4 Box plot of reference points and damaged points for candidate biological indicators
相关性分析:对余下的9 个生物指标进行Pearson相关分析.由图5 可知,M12 与M28 呈显著负相关,M13 与M25 呈正相关,M16 与M29 呈显著正相关.因此删除M25、M28、M29.最终筛选M12、M13、M16、M22、M23、M32 这6 个指标构建B-IBI 指数.

图5 候选生物指标相关性分析热图Fig.5 Heat map for correlation analysis of candidate biological indicators
2.3.2 指标赋值及健康评价标准
将各采样点的B-IBI 值通过三分法、四分法和比值法进行计算,并对各采样点最终B-IBI 值进行判断能力分析(见图6).结果表明,三分法对湖泊生态健康状况具有较好的判别能力.

图6 指标赋值方法的B-IBI 判别能力分析Fig.6 Discriminatory power of B-IBI indicator assignment methods
以参照点25%分位数(B-IBI 值为24)为健康评价的标准,将B-IBI 值分布范围(0~24)四等分,建立不同健康程度的评价标准:B-IBI 值为0~6,很差;B-IBI值˃6~12,较差;B-IBI 值˃12~18,一般;B-IBI 值˃18~24,亚健康;B-IBI 值˃24,健康.
2.4 太湖健康评价
根据B-IBI 指数评价标准,对太湖样点生态系统健康状况进行评价,结果(见图7)表明,不同湖区的B-IBI 值表现为东部湖区(25.1±2.7)˃南部湖区(23±4.5)˃西部湖区(23±3.0)˃中部湖区(21.8±4.8)˃北部湖区(18.6±6.8),其中北部湖区的THl 采样点在枯水期和平水期的B-IBI 值均低于12,水生态状况较差.这是因为太湖北部为无锡和常州等经济发达城市,污染排污量大,西部河口汇入也是污染物进入太湖的主要通道,生态环境较差[37];其次,北部湖区有“引江济太”工程,水流迁移、底质再悬浮与释放等影响了太湖北部调水沿线的生态环境,特别是入湖口附近水域[38].
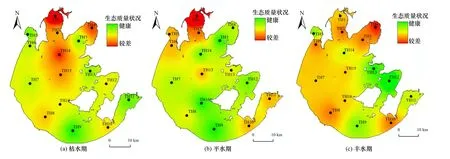
图7 B-IBI 指示的不同水期太湖生态质量状况Fig.7 Ecological quality of the Taihu Lake in different water periods indicated by B-IBI
从水期变化来看,枯水期的B-IBI 值范围为7~30,健康点位占比为43.75%,南部和东部湖区的水生态整体比较健康.平水期的B-IBI 值范围为8~30,健康点位占比达到62.50%,水生态健康状况最好,南部和东部湖区的大部分区域都达到了健康状态.进入丰水期后,B-IBI 值范围为16~28,健康点位明显减少,占全部采样点的25.00%,西部湖区的水生态状况呈现明显恶化,且逐渐向中部和南部湖区蔓延.这与部分河流研究结论不同.例如,冯治远等[16]对黄河干流的研究表明,较大的来水量提高了水体的自净能力,整体完整性水平较高于春季,丰水期的健康状况优于枯水期;姚琦等[17]的研究表明,东洞庭湖丰水期的B-IBI 值略高于枯水期,且枯水期入湖河道附近的采样点健康情况相对较差.由图7 可知,本研究中太湖不同水期的健康状况表现为平水期˃枯水期˃丰水期,尤其是丰水期西部湖区健康状况明显变差.丰水期,太湖入湖水量增加,西部、北部湖区外源输入的污染物通量特别是面源污染物通量也会随之增加,给湖泊带来更大的污染负荷,导致湖泊生态状况恶化[39].而中部湖区的流动性较差,当其他湖区的生态环境恶化时,也会逐渐影响中部湖区的水生态状况.这表明西部湖区的水生态健康对整个太湖的影响不容忽视,关注西部湖区对太湖湖泊环境保护具有重要意义.
2.5 B-IBI 指数影响因素
采用冗余分析(RDA)揭示B-IBI 指数关键指标与环境因子的关系.如图8 所示,腹足纲相对丰度与环境中的碳、氮、磷含量均呈相关性,尤其是与底泥的TNs、TPs含量,以及水体中Chl-a、TNw、TPw浓度均呈显著正相关.耐污类群百分比与水体和底泥中的氧化还原电位均呈正相关.粘附者相对丰度与Cond、TDS 和水温均呈正相关.底栖动物的群落结构对环境变化十分敏感,多种环境因子均会导致底栖动物结构发生变化,尤其是水体和底泥中的氮、磷元素以及Chl-a.这说明环境中的营养盐对太湖的健康状况影响较大,富营养化会影响水体DO,降低底栖动物的生物多样性,进而影响湖泊的生态状况[40-41].
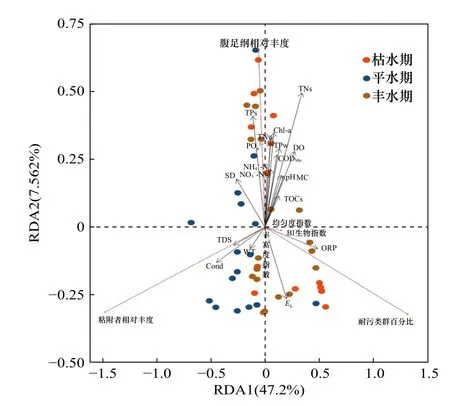
图8 B-IBI 关键指标与环境因子的RDA 分析Fig.8 RDA analysis of B-IBI key indicators and environmental factors
RDA 分析显示,第1 排序轴和第2 排序轴分别能解释47.20%和7.56%的B-IBI 关键指标差异,响应关系不强.这是因为影响B-IBI 的环境因子复杂,除湖泊水质、底质理化胁迫因子外,还有人类活动如航运、捕捞和水利工程等的影响.底栖动物群落的退化和恢复一个长期的过程,应该从各湖区污染特征和周边生态环境情况出发,制定科学的治污措施和生态规划,促进太湖生态系统的良性发展.
3 结论
a) 2023 年枯水期(2 月)、平水期(5 月)、丰水期(8 月),太湖北部、西部、南部、东部和中部湖区16 个采样点共采集到1 116 个底栖动物,包含3 门7 纲15 目18 科38 种,其中软体动物门种类和个数均最多,其次为节肢动物门,环节动物门最少.
b) 太湖北部湖区的节肢和环节动物较多,分别占北部底栖动物的60.78%、33.77%,且霍甫水丝蚓、寡鳃齿吻沙蚕以及摇蚊科等耐污物种显著多于其他湖区;软体动物最少,占比为5.45%.
c) 太湖丰水期摇蚊类种类和数量明显降低,铜锈环棱螺和河蚬的数量明显减少,前3 种优势生物占比达到71%,且特有的常见种增多,物种组成相对单调,生物多样性较低.
d) 太湖北部湖区的水生态状况较差,河流汇入口较多的西部湖区的水生态健康对整个太湖的影响不容忽视,随着枯水期-平水期-丰水期的变化,生态状况恶化逐渐向中部和南部湖区蔓延,东部湖区水生态较健康.生态健康状况受水期变化的波动较大,枯水期、平水期和丰水期的健康点位占比分别为43.75%、62.50%和25.00%.水体和底泥中的氮、磷元素以及Chl-a 是影响B-IBI 值的关键因子.
