腹主动脉瘤病人血清线粒体衍生肽的表达及其临床意义
2024-04-29李飞飞,侯欣,欧敬民,杨祖尉,施丽娟
李飞飞,侯欣,欧敬民,杨祖尉,施丽娟

摘要 目的:探讨血清线粒体衍生肽(MDP)在腹主动脉瘤治疗前后的表达及其临床意义。方法:选取2017年6月—2020年6月我院收治的88例经腹主动脉CT血管造影明确诊断为腹主动脉瘤的病人作为研究对象。将肿瘤最大直径≥5 cm采取腹主动脉瘤腔内修复术治疗的59例病人作为腔内修复组,肿瘤最大直径<5 cm予以动态观察的29例病人作为动态观察组。两组分别于治疗前和治疗3、6、12个月采集病人血清标本,采用酶联免疫吸附试验检测血清MDP水平,比较两组病人治疗前后血清MDP水平,并分析血清MDP水平与瘤体最大直径的相关性。结果:两组病人性别、年龄、高血压、糖尿病、高血脂、瘤颈长度、瘤颈直径、瘤腔内血栓、瘤体扭曲成角、D-二聚体水平等资料比较,差异均无统计学意义(P>0.05),而腔内修复组病人瘤体最大直径、累及髂总动脉情况、初始血清MDP水平明显高于动态观察组病人(P<0.05)。治疗后3、6、12个月各时间点腔内修复组病人瘤体最大直径较治疗前明显缩小(P<0.05),而动态观察组在3、6、12个月各时间点瘤体最大直径有逐渐增大趋势,但差异无统计学意义(P>0.05)。治疗后3、6、12个月各时间点腔内修复组病人血清MDP水平逐渐升高(P<0.05),而动态观察组病人3个月后血清MDP水平变化不明显(P>0.05),但治疗6、12个月后血清MDP水平较治疗前和治疗3个月后明显升高(P<0.05)。相关性分析结果显示,血清MDP水平与肿瘤最大直径呈负相关(r=-0.436,P<0.05)。腔内修复组病人术前血清MDP水平降低与病人性别、瘤体最大直径有关(P<0.05),而与病人年龄、高血压、累及髂总动脉、瘤腔内血栓、瘤体成角无关(P>0.05)。结论:血清MDP水平与腹主动脉瘤病人瘤体最大直径呈负相关,其水平随瘤体最大直径的缩小而升高,术前MDP水平降低与病人性别和瘤体直径有关,可为腹主动脉瘤腔内修复术前瘤体直径评估提供指导依据,指导治疗方案的制定。
关键词腹主动脉瘤;线粒体衍生肽;瘤体直径;腔内修复术
doi:10.12102/j.issn.1672-1349.2024.04.030
腹主动脉瘤是一种较为严重的主动脉退行性疾病,腹主动脉扩张累积髂动脉及其分支,导致动脉瘤破裂,瘤体直径过大导致的动脉瘤破裂是腹主动脉瘤病人死亡的主要原因,死亡率约为40%[1]。腔内修复术是以血管支架隔绝瘤腔,减小对瘤体的压力,尽量避免瘤体扩张破裂,是腹主动脉瘤外科手术的重要治疗方式,需术前对病人瘤体参数进行准确测量和评估,才能降低解剖局限,提高手术效果,进而为手术方案的选择提供可靠参考[2]。目前,影像学检查是评估瘤体直径大小的主要方式,但在临床应用中受限,因此,找到一种方便、快捷评估瘤体直径大小的血清指标对明确腹主动脉瘤修复术病人瘤体直径变化具有重要意义[3]。血清线粒体衍生肽(MDP)在人体发挥重要生理作用,可通过调节抗氧化应激、促进炎性因子表达,导致内皮细胞功能障碍,进而参与动脉血管病变发生、发展过程[4-5]。本研究以88例腹主动脉瘤病人作为研究对象,观察各时间点血清MDP水平及瘤体直径变化情况,进而为临床治疗方案的制定及实施提供指导。
1资料与方法
1.1一般资料
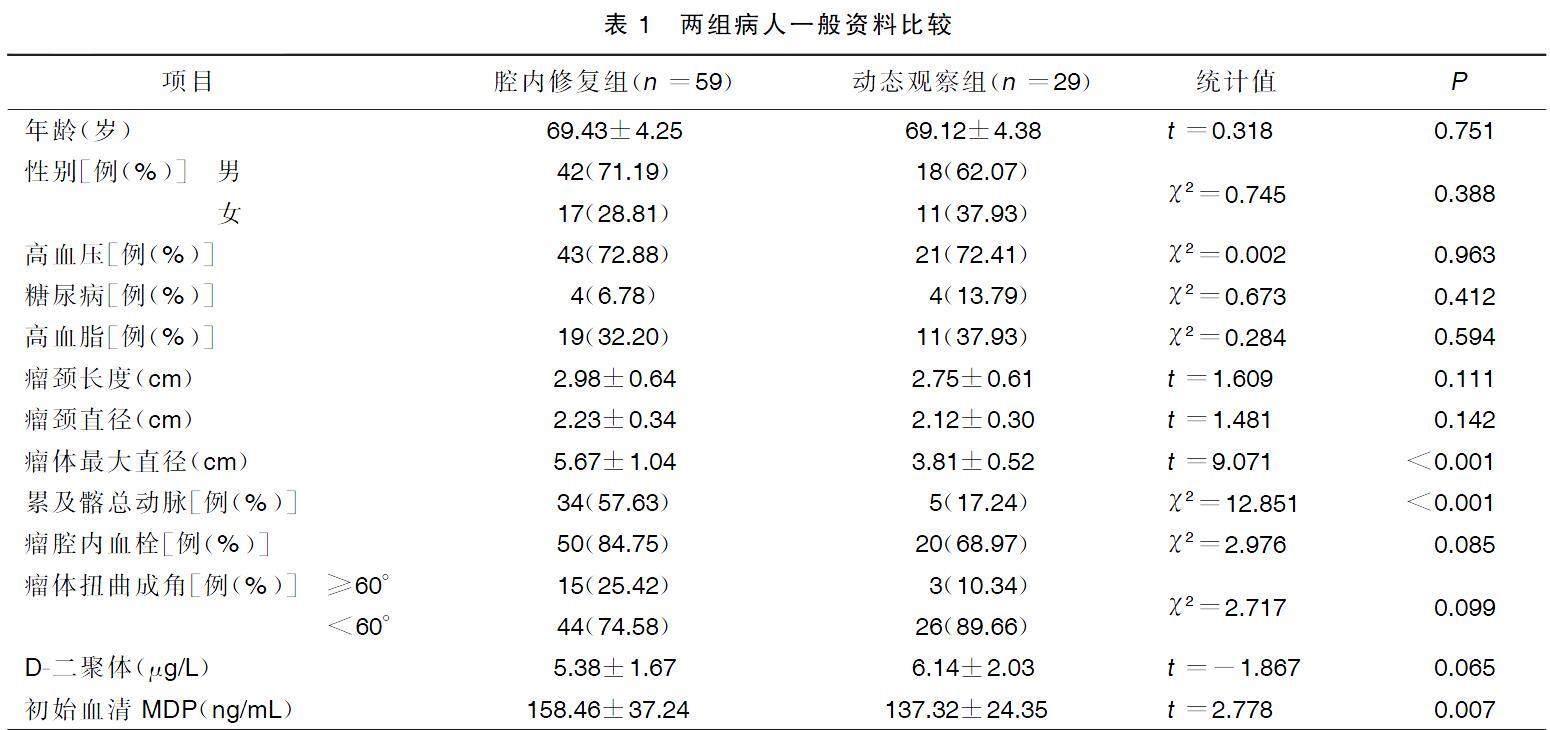
选取2017年6月—2020年6月我院收治的88例经腹主动脉CT血管造影明确诊断为腹主动脉瘤的病人作为研究对象,其中,男60例,女28例;年龄51~82(69.35±4.22)岁。将肿瘤最大直径≥5 cm采取腹主动脉瘤腔内修复术治疗的59例病人作为腔内修复组,肿瘤最大直径<5 cm予以动态观察的29例病人作为动态观察组。本研究经医院伦理委员会批准。
1.2纳入与排除标准
纳入标准:经影像学检查确诊为腹主动脉瘤,年龄<85岁;腹主动脉瘤腔内修复术病人符合手术指征者;临床资料完整者;签署知情同意书者。排除标准:腹主动脉假性动脉瘤;腹主动脉瘤破裂;合并心、肝、肾功能障碍或凝血功能障碍者;感染性腹主动脉瘤;肱动脉狭窄或迂曲无法通过支架。
1.3方法
腹主动脉瘤腔内修复术:病人于平卧位下常规麻醉和消毒后行双侧股动脉穿刺,行全主动脉造影,麻醉满意后刺双侧股总动脉并置入5F导管鞘,引入导丝至腹主动脉上段高压造影,明确动脉瘤形态、大小,瘤颈长度及宽度、瘤体直径、瘤体成角、是否有肾动脉狭窄、双侧髂总动脉是否受累、是否有造影剂外溢及附壁血栓形成等。然后更换8F导管鞘,预留双侧股动脉针线,使用血管扩张器引入并更换超硬导丝。然后置入合适血管支架进行内隔绝术。术后常规予以血压控制、营养支持等治疗,并监测心、肺、肾功能,对术后反应予以针对性对症治疗。
1.4观察指标
1.4.1一般资料
收集两组病人性别、年龄、高血压、糖尿病、高血脂等资料,影像学检查时测定瘤颈长度、瘤颈直径、瘤腔内血栓、瘤体扭曲成角、瘤体最大直径,并观察累及髂总动脉情况,采用免疫比浊法检测血清D-二聚体水平。
1.4.2瘤体最大直径变化情况
记录两组病人治疗前及治疗3、6、12个月后瘤体最大直径变化情况。
1.4.3血清MDP水平
采集病人清晨空腹静脉血3 mL,3 000 r/min,离心10 min,取上清液置于-70 ℃冰箱待测。使用武汉云克隆公司试剂盒(编号EX132Hu),采用酶联免疫吸附试验检测血清MDP水平。记录两组病人治疗前及治疗3、6、12个月后血清MDP水平。
1.4.4血清MDP水平与瘤体最大直径的相关性分析
采用Pearson法分析血清MDP水平与瘤体最大直径的相关性。
1.4.5腔内修复组病人术前血清MDP水平与临床参数的关系
腔内修复组病人术前血清MDP水平在不同临床参数的分布情况,分析其水平与临床各参数的关系。
1.5统计学处理
采用SPSS 19.0软件进行数据分析。符合正态分布的定量资料以均数±标准差(x±s)表示,采用t检验或重复测量的方差分析。定性资料以例数或百分比(%)表示,采用χ2检验。以P<0.05为差异有统计学意义。
2结果
2.1两组病人一般资料比较
两组病人性别、年龄、高血压、糖尿病、高血脂、瘤颈长度、瘤颈直径、瘤腔内血栓、瘤体扭曲成角、D-二聚体水平比较,差异均无统计学意义(P>0.05);腔内修复组病人瘤体最大直径、累及髂总动脉情况、初始血清MDP高于动态观察组,差异均有统计学意义(P<0.05)。详见表1。
2.2两组病人肿瘤直径变化情况比较
重复测量方差分析结果显示,治疗后3、6、12个月各时间点腔内修复组病人瘤体最大直径较治疗前明显缩小(P<0.05);动态观察组在3、6、12个月各时间点瘤体最大直径呈逐渐增大趋势,但差异无统计学意义(P>0.05)。详见表2。
2.3两组治疗前后血清MDP水平比较
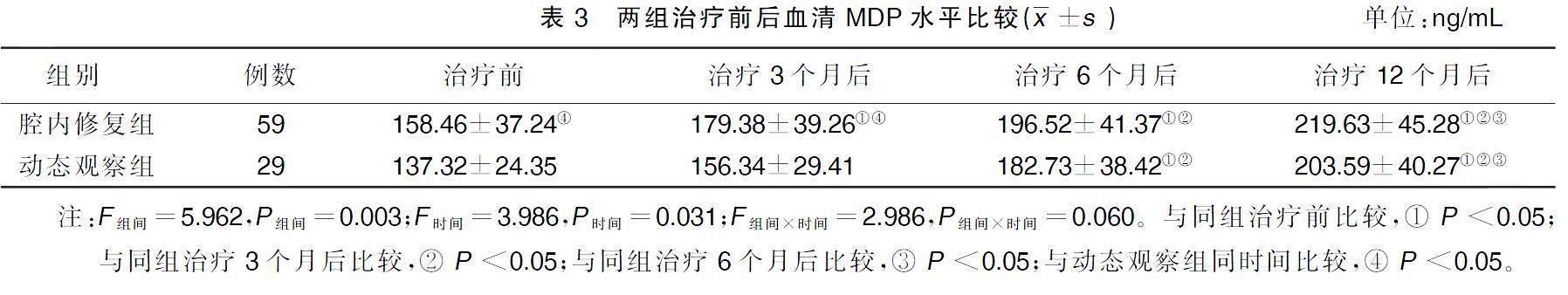
治疗后3、6、12个月各时间点腔内修复组病人血清MDP水平逐渐升高(P<0.05);动态观察组病人3个月后血清MDP水平变化不明显(P>0.05),但动态观察组治疗6、12个月后血清MDP水平较治疗前和治疗3个月后明显升高(P<0.05)。采用重复测量方差分析,提示腔内修复组对动脉瘤病人的主效应有统计学意义,时间因素对动脉瘤修复有统计学意义。详见表3。
2.4血清MDP水平与瘤体最大直径的相关性
Pearson相关性分析结果显示,血清MDP水平与瘤体最大直径呈负相关(r=-0.436,P<0.05)。
2.5腔内修复组治疗前血清MDP水平与临床参数的关系
单因素分析结果显示,腔内修复组病人术前血清MDP水平降低与病人性别、瘤体最大直径有关(P<0.05),而与病人年龄、高血压、累及髂总动脉、瘤腔内血栓、瘤体成角无关(P>0.05)。详见表4。
3讨论
腹主动脉瘤腔内修复术具有创伤小、并发症少、术后恢复快等优点,但需借助影像学引导,存在一定锚定区和解剖局限,且术前需对瘤体形态、大小、位置、成角、长度等具有清晰认识,术前准确评估瘤体直径大小对手术实施效果,降低术后心血管并发症具有重要意义[6-7]。本研究通过观察治疗前后各时间血清MDP水平变化情况,结果发现,术前腹动脉瘤病人血清MDP水平明显降低,且随着治疗后瘤体直径的缩小,其水平逐渐升高,提示血清MDP可作为腹动脉瘤修复术前瘤体直径大小评估的依据,进而指导治疗方案的选择及实施。
本研究结果显示,腔内修复组病人瘤体最大直径、累及髂总动脉情况、初始血清MDP明显高于动态观察组病人(P<0.05),且治疗后3、6、12个月各时间点腔内修复组病人瘤体最大直径较治疗前明显缩小(P<0.05),而动态观察组各时间点瘤体最大直径无明显变化,说明腔内修复术可有效减缓瘤体扩张,抑制瘤体生长,促进瘤体缩小,而瘤体较小,病人若不采取干预措施可导致瘤体进一步增大,进而增加破裂风险,需予以药物治疗。究其原因,瘤体直径<5 cm的腹主动脉瘤瘤体较小,对髂总动脉及分支影响相对较小,通常予以内科药物治疗即可延缓动脉瘤进展[8-9]。对于瘤体直径较大累积髂总动脉及分支,极可能导致破裂风险的腹动脉瘤通常无法以药物进行控制,需进行修复手术,修复术可通过隔绝腔内血管阻止血液流入瘤腔,防止瘤腔增大,减轻血管压力,防止动脉瘤破裂,这与相关研究中瘤体直径>5 cm病人发生瘤体破裂的风险较高[10-11]的报道一致。因此,及时评估瘤体直径大小并予以有效干预措施对防治腹主动脉瘤病人疾病进一步发展及预后具有重要作用。
治疗后3、6、12个月,腔内修复组病人血清MDP水平逐渐升高(P<0.05),其水平随瘤体直径的缩小而升高,说明血清MDP水平与腹主动脉瘤瘤体直径大小密切相关。而动态观察组病人3个月后血清MDP水平变化不明显(P>0.05),但治疗6、12个月后血清MDP水平较治疗前和治疗3个月后明显升高(P<0.05),说明<5 cm的动脉瘤早期瘤体生长较慢,通常在6~12个月时出现增长,这与相关研究中临床通常以6个月为单位进行持续观察[12-13]的结论一致。并且,动态观察组病人血清MDP水平变化趋势与腹主动脉瘤瘤体直径变化趋势一致,说明血清MDP水平与瘤体直径密切相关。究其原因,动脉瘤是弹力蛋白胶原降解,动脉硬化对动脉基质层的破坏以及强大的动脉压力使管壁力量薄弱,导致动脉扩张所致,因此,动脉硬化在动脉瘤的发生、发展中起到重要作用[14-15]。MDP具有抗氧化应激、抗凋亡、减少黏附分子、调节细胞代谢、抑制炎症反应等作用,可维持血管稳态,在抗动脉硬化中发挥重要作用;MDP可通过增加成纤维细胞胶原蛋白表达,导致胶原蛋白减少,纤维帽变薄,促进斑块破裂的发生[16-17]。并且,MDP可能通过激活活化的5-单磷酸腺苷活化蛋白激酶(AMPK)/磷脂酰肌醇3激酶(PI3K)蛋白激酶B(AKT)/内皮型一氧化氮合酶(eNOS)通路调节炎症反应,影响多种黏附分子及诱导酶表达,影响血管内皮细胞与血管平滑肌细胞功能,其水平降低,保护作用减弱,内皮功能异常,导致动脉粥样硬化的发生、发展,进而参与动脉瘤疾病进展[18-19]。
腔内修复组病人术前血清MDP水平降低与病人性别、瘤体最大直径有关(P<0.05),这可能与腹主动脉瘤男性发病率明显高于女性有关,男性病人因吸烟、饮酒等不良习惯,且随着年龄增长,合并高血压、糖尿病、冠心病、慢性阻塞性肺疾病等慢性疾病发生率较高;代谢异常、炎症反应发生,腹主动脉壁内胶原及弹力蛋白降解作用降低,MDP水平降低,血流对血管压力造成扩张,加速动脉瘤体的形成和进展。瘤体直径过大可增加血管压力,进而导致血管内皮功能损害,MDP水平降低,抑制血管生成和血管扩张作用降低[20-21]。因此,血清MDP水平可辅助临床评估术前动脉瘤瘤体直径大小,进而指导临床治疗方案的选择。
综上所述,腹主动脉瘤病人血清MDP水平降低是腹主动脉瘤破裂的保护因素,其水平与病人性别及瘤体直径有关,检测血清MDP水平可为术前动脉瘤瘤体直径大小评估提供可靠依据。
参考文献:
[1]貟清玲,吴世勇,宋薇.腹主动脉瘤破裂患者预后的相关危险因素[J].实用癌症杂志,2022,37(3):464-466.
[2]LU H Y,SHIH C M,HUANG C Y,et al.Galectin-3 modulates macrophage activation and contributes smooth muscle cells apoptosis in abdominal aortic aneurysm pathogenesis[J].International Journal of Molecular Sciences,2020,21(21):8257.
[3]宋雨杰,彭红梅,张东威.关注主动脉血管异常形变,预防腹主动脉瘤的形成[J].中国全科医学,2020,23(11):1355-1360.
[4]BRAET D J,TAAFFE J P,SINGH P,et al.Readmission and utilization after repair of ruptured abdominal aortic aneurysms in the United States[J].Journal of Vascular Surgery,2021,73(4):1468.
[5]VAN LAARHOVEN C J,VAN SETTEN J,VAN HERWAARDEN J A,et al.Polygenic susceptibility of aortic aneurysms associates to the diameter of the aneurysm sac:the aneurysm-express biobank cohort[J].Scientific Reports,2019,9:19844.
[6]王丽艳,徐哲龙.线粒体功能障碍在心血管疾病中作用机制的研究进展[J].天津医药,2020,48(2):146-151.
[7]POLZER S,GASSER T C,VLACHOVSK R,et al.Biomechanical indices are more sensitive than diameter in predicting rupture of asymptomatic abdominal aortic aneurysms[J].Journal of Vascular Surgery,2020,71(2):617-626;e6.
[8]BELLAMKONDA KIRTHI S,SAMEH Y,ZHANG Y W,et al.Endograft type and anesthesia mode are associated with mortality of endovascular aneurysm repair for ruptured abdominal aortic aneurysms[J].Vascular,2020:1708538120947859.
[9]王文文,邓乐乐,柏永全,等.线粒体源性肽MOTS-c的功能及作用机制研究进展[J].河南大学学报(自然科学版),2021,51(2):161-168.
[10]LINDQUIST L M,HULTGREN R,BERGMAN O,et al.Tunica-specific transcriptome of abdominal aortic aneurysm and the effect of intraluminal thrombus,smoking,and diameter growth rate[J].Arterioscler Thromb Vasc Biol,2020,40(11):2700-2713.
[11]GOLLEDGE J,MORRIS D R,PINCHBECK J,et al.Metformin prescription is associated with a reduction in the combined incidence of surgical repair and rupture related mortality in patients with abdominal aortic aneurysm[J].Journal of Vascular Surgery,2019,69(2):624.
[12]朱玮华,尚画雨,李顺昌,等.线粒体衍生肽的病理生理功能[J].生命的化学,2020,40(5):668-677.
[13]HWANG D,KIM J,KIM H K,et al.Suitability of the aortic neck anatomy for endovascular aneurysm repair in Korean patients with abdominal aortic aneurysm[J].Vascular Specialist International,2020,36(2):71-81.
[14]SINGH T P,MOXON J V,GASSER T C,et al.Author response to:peak wall stress and peak wall rupture index in ruptured and asymptomatic intact abdominal aortic aneurysms[J].British Journal of Surgery,2021,108(7):e256.
[15]冯松林,余皓,吴欣择,等.microRNA在腹主动脉瘤发生和发展中的调控机制[J].心血管病学进展,2020,41(11):1168-1172.
[16]FERREL B,PATEL S,CASTILLO A,et al.The effect of abdominal aortic aneurysm size on endoleak,secondary intervention,and overall survival after endovascular aortic aneurysm repair[J].Journal of Vascular Surgery,2019,70(3):e62.
[17]GURUNG R,CHOONG A M,WOO C C,et al.Genetic and epigenetic mechanisms underlying vascular smooth muscle cell phenotypic modulation in abdominal aortic aneurysm[J].International Journal of Molecular Sciences,2020,21(17):6334.
[18]方超,丁勇,符伟国,等.非编码RNA在腹主动脉瘤中的研究进展[J].中国临床医学,2019,26(5):767-771.
[19]LIU C,GIDLUND E K,WITASP A,et al.Reduced skeletal muscle expression of mitochondrial-derived peptides humanin and MOTS-C and Nrf2 in chronic kidney disease[J].American Journal of Physiology-Renal Physiology,2019,317(5):F1122-F1131.
[20]陈阳,张永兴,倪焕尔,等.SUMO特异性蛋白酶3通过调控巨噬细胞极化促进磷酸钙诱导的小鼠腹主动脉瘤形成[J].中国病理生理杂志,2020,36(5):769-778.
[21]LU H,TANG S,XUE C,et al.Mitochondrial-derived peptide MOTS-c increases adipose thermogenic activation to promote cold adaptation[J].Int J Mol Sci,2019,20(10):2456.
(收稿日期:2022-01-06)
(本文编辑邹丽)
