上调lncRNA MEG3对大鼠心肌细胞系缺氧/复氧损伤的影响
2024-04-29余敏,崔跃,黎鹏飞,谢丹,陈芬
余敏,崔跃,黎鹏飞,谢丹,陈芬

摘要 目的:探究長链非编码RNA(lncRNA)母系表达基因3(MEG3)对大鼠心肌H9c2细胞缺氧/复氧(H/R)的保护作用及其与核因子E2相关因子2(Nrf2)/抗氧化反应元件(ARE)通路的关系。方法:将H9c2细胞分为Control组、H/R组、H/R+Ad-绿色荧光蛋白(GFP)组、H/R+Ad-MEG3组、H/R+Ad-MEG3+si-NC组及H/R+Ad-MEG3+si-Nrf2组。实时荧光定量逆转录酶聚合酶链式反应(RT-qPCR)检测MEG3表达;噻唑蓝(MTT)法检测细胞活力;流式细胞仪检测细胞凋亡率;2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)法检测活性氧(ROS)水平;酶联免疫吸附测定法(ELISA)检测超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性;蛋白质印迹(Western Blot)检测Nrf2/ARE通路相关蛋白表达。结果:与Control组比较,H/R组细胞凋亡率、细胞中ROS水平及Nrf2、血红素氧化酶1(HO-1)和醌氧化还原酶-1(NQO-1)蛋白水平均增高,而细胞活力、细胞中MEG3表达水平、SOD和CAT活性均降低(P<0.05)。MEG3过表达可部分逆转H/R对H9c2细胞和Nrf2/ARE通路蛋白的影响(P<0.05);敲低Nrf2可削弱MEG3过表达对H/R损伤的保护作用(P<0.05)。结论:MEG3过表达可抑制氧化应激和细胞凋亡减轻H/R心肌损伤,可能与激活Nrf2/ARE抗氧化信号有关。
关键词缺氧/复氧;长链非编码RNA母系表达基因3;心肌细胞H9c2;实验研究
doi:10.12102/j.issn.1672-1349.2024.04.013
Effect of Up-regulated lncRNA MEG3 on Hypoxia/Reoxygenation Injury of Rats Myocardial Cell Lines
YU Min, CUI Yue, LI Pengfei, XIE Dan, CHEN Fen
Wuhan Red Cross Hospital, Wuhan 430015, Hubei, China, E-mail: yumin662@163.com
AbstractObjective:To explore the protective effect of maternal expression of long non-coding RNA(lncRNA) maternally expressed gene 3(MEG3) on hypoxia/reoxygenation(H/R) in rat myocardial H9c2 cells and its relationship with the nuclear factor E2 related factor 2(Nrf2)/antioxidant response element(ARE) pathway.Methods:H9c2 cells were divided into control group,H/R group,H/R+Ad-Green fluorescent protein(GFP) group,H/R+Ad-MEG3 group,H/R+Ad-MEG3+si-NC group and H/R+Ad-MEG3+si-Nrf2 group.Real-time fluorescent quantitative reverse transcriptase polymerase chain reaction(RT-qPCR) was used to detect MEG3 expression.Methyl thiazolyl tetrazolium(MTT) method was used to detect the viability of cells.Flow cytometry was used to detect the apoptosis rate.2′,7′-dichlorofluorescent yellow diacetate(DCFH-DA) method was used to detect the level of reactive oxygen species(ROS).Enzyme-linked immunosorbent assay(ELISA) was used to detect the activities of superoxide dismutase(SOD) and catalase(CAT).Western Blot was used to detect the expression levels of Nrf2/ARE pathway related proteins.Results:Compared with the control group,the H9c2 cell apoptosis rate,cell ROS level and Nrf2,heme oxidase 1(HO-1) and quinone oxidoreductase-1(NQO-1) protein levels increased in the H/R group,while the cell viability,the MEG3 expression level in the cells,SOD and CAT activities reduced(P<0.05).MEG3 overexpression partially reversed the effects of H/R on H9c2 cells and Nrf2/ARE pathway proteins(P<0.05).Knockdown of Nrf2 could weaken the protective effect of MEG3 overexpression on H/R injury(P<0.05).Conclusion:Up-regulating the expression of MEG3 could inhibit oxidative stress and apoptosis to protect H/R myocardial Injury,which may be related to the activation of Nrf2/ARE antioxidant signals.
Keywordshypoxia/reoxygenation; long non-coding RNA maternally expressed gene 3; cardiomyocyte H9c2; experimental study
缺血性心脏病是由冠状动脉闭塞或狭窄引起的,冠状动脉血流恢复是减轻心肌缺血性损伤的有效干预措施[1]。但血流的恢复会诱发活性氧(reactive oxygen species,ROS)的产生和氧化损伤的恢复[2]。因此,防止氧化损伤是保护心脏免受心肌缺血/再灌注损伤的有效途径之一。长链非编码RNA(long non-coding RNA,lncRNA)是一类不编码蛋白质的RNA,可参与各种疾病的发生发展[3]。母系表达基因3(maternally expressed gene 3,MEG3)已被证明参与肿瘤、肺纤维化等多种疾病过程[4]。已有研究证实,MEG3可促进心肌缺血再灌注损伤的恢复[5]。然而其在心肌细胞缺血/再灌注损伤中的具体作用机制还未可知。核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)/抗氧化反应元件(antioxidant responsive element,ARE)通路在缺血/再灌注损伤中发挥着重要的作用[6]。本研究通过构建心肌H9c2细胞缺氧/复氧(hypoxia/reoxygenation,H/R)模型,探讨MEG3在H/R心肌细胞中的作用及对Nrf2/ARE通路的影响,以期为进一步靶向治疗缺血/再灌注损伤提供依据。
1材料与方法
1.1实验材料
大鼠心肌H9c2细胞系(美国ATCC公司);DEME培养基(上海联迈生物工程有限公司);LipofectamineTM2000(Invitrogen公司);总RNA提取试剂、实时荧光定量逆转录酶聚合酶链式反应(real-time fluorescence quantitative polymerase linkage reaction,RT-qPCR)试剂盒、膜联蛋白V-异硫氰酸荧光素/碘化丙锭(annexin V-fluorescein isothiocyanate/propidium iodide,Annexin V-FITC/PI)凋亡检测试剂盒、双荧光素酶报告基因检测试剂盒(南京诺唯赞医疗科技有限公司);反转录试剂盒(TaKaRa公司);噻唑蓝(methyl thiazolyl tetrazolium,MTT)细胞增殖及细胞毒性检测试剂盒、ROS检测试剂盒、放射免疫沉淀测定(radioimmunoprecipitation assay,RIPA)裂解缓冲液(Bestbio公司);超氧化物歧化酶(superoside dismutase,SOD)酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)试剂盒、过氧化氢酶(catalase,CAT)ELISA试剂盒(江西艾博因生物科技有限公司);一抗:Nrf2、醌氧化还原酶-1(quinine oxidoreductase 1,NQO-1)、血红素氧化酶1(heme oxygenase 1,HO-1)及内参β-肌动蛋白(β-actin)(Abcam 公司)。
1.2方法
1.2.1细胞的分组及处理
将H9c2细胞分为Control组、H/R组、H/R+Ad-绿色荧光蛋白(GFP)组、H/R+Ad-MEG3组、H/R+Ad-MEG3+si-NC组及H/R+Ad-MEG3+si-Nrf2组。Control组不做任何处理。H/R组构建H/R模型,即将H9c2细胞保存在无糖无血清的DEME培养基中,并在5%CO2、94%N2和1%O2的37 ℃培养箱中培养6 h,以模拟缺氧损伤[7];后更换为正常培养基,并在5%CO2、95%空气的37 ℃潮湿培养箱中培养。在不同的时间点(12 h、24 h、48 h)收集细胞。H/R+Ad-GFP组转染Ad-GFP后进行H/R处理;H/R+Ad-MEG3组转染Ad-MEG3后进行H/R处理;H/R+Ad-MEG3+si-NC组转染Ad-MEG3和si-NC后进行H/R处理;H/R+Ad-MEG3+si-Nrf2组转染Ad-MEG3和si-Nrf2后进行H/R处理。
1.2.2RT-qPCR检测MEG3表达
TRIZOL法提取总RNA,反转录形成cDNA,并进行RT-qPCR检测。以GAPDH为内参,2-ΔΔCt计算MEG3的相对表达。引物序列如下:MEG3正向为5′-TCGCTCTTCTCCATCGAACCG-3′,反向为5′-GTAGGGCGACGACTTTGAGT-3′;GAPDH正向为5′-CAAGGTCATCCATGACAACTTTG-3′,反向为5′-GTCCACCACCCTGTTGCTGTAG-3′。
1.2.3MTT法测定细胞活力
将细胞接种在96孔板中(1×104个/孔),24 h后添加20 mL MTT(0.5 g/L)孵育1 h,添加二甲基亚砜。检测各孔细胞在490 nm处的吸光度,Control组的吸光度设置为100%。
1.2.4流式细胞仪检测细胞凋亡率
500 mL Annexin V结合缓冲液悬浮细胞,添加Annexin V-FITC和PI孵育5 min,流式细胞仪检测细胞凋亡情况。
1.2.52′,7′-二氯荧光黄双乙酸盐(DCFH-DA)法检测细胞内ROS水平
PBS洗涤细胞后添加10 mmol/L的DCFH-DA孵育30 min,酶标仪检测DCF荧光(488 nm激发波长和525 nm发射波长)。
1.2.6ELISA检测细胞内SOD和CAT活性
RIPA裂解液制备细胞裂解物,BCA法测定蛋白浓度,分别使用SOD和CAT ELISA试剂盒检测其活性。
1.2.7蛋白质印迹法(Western Blot)检测细胞内Nrf2/ARE通路相关蛋白表达
使用RIPA裂解缓冲液提取细胞总蛋白,10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白后转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%脱脂奶粉孵育1 h后,加一抗Nrf2、NQO-1、HO-1及β-actin在4 ℃下过夜孵育,隔日添加二抗孵育2 h后增强型化学发光(ECL)液显影,在凝胶成像仪中使条带可视化,通过Image-J软件分析条带的吸光度值。
1.3统计学处理
采用SPSS 25.0软件进行数据分析。符合正态分布的定量资料以均数±标准差(x±s)表示,采用单因素方差分析和SNK-q检验。以P<0.05为差异有统计学意义。
2结果
2.1H/R后H9c2细胞中MEG3表达水平
与Control组比较,H/R组MEG3表达水平随着再复氧时间的增加而降低,故后续选择复氧的时间均为48 h(P<0.05)。详见图1。
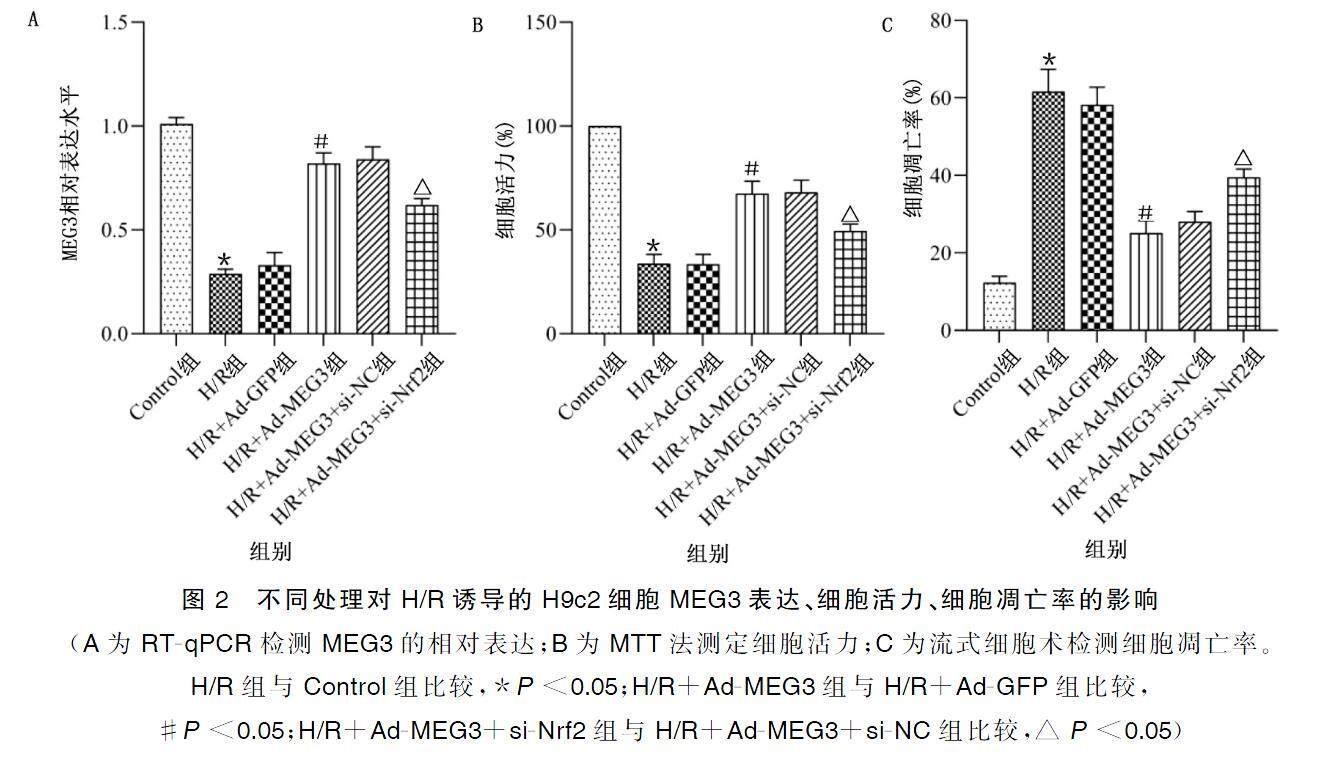
2.2不同处理对H/R诱导的H9c2细胞中MEG3表达、细胞活力、细胞凋亡率的影响
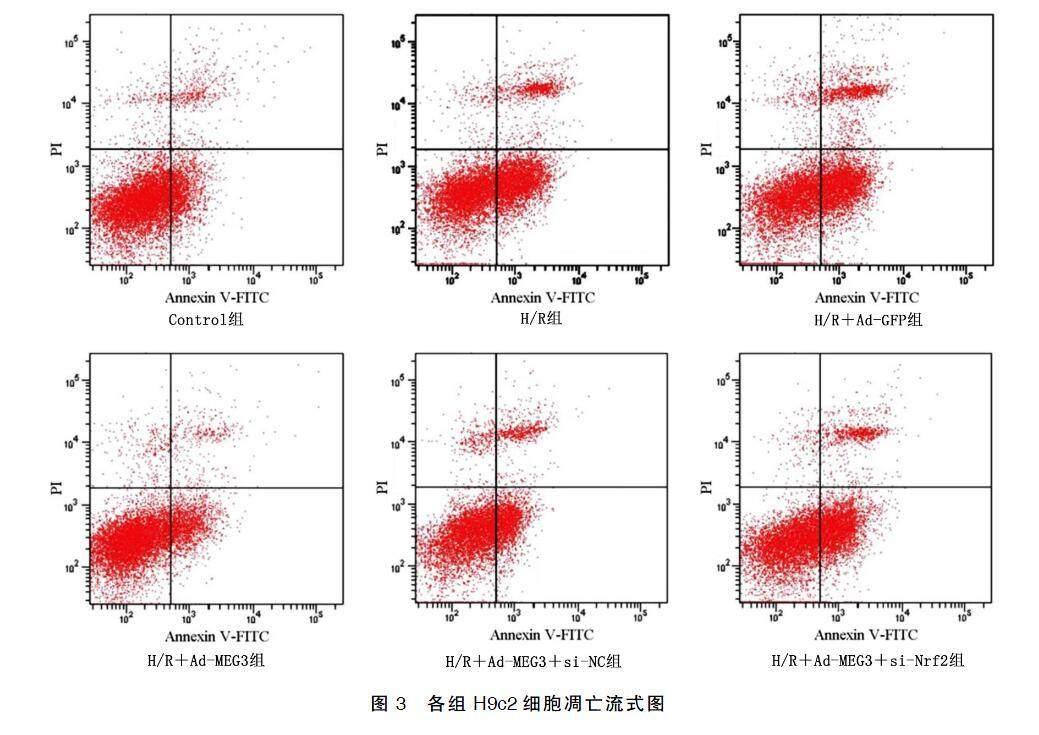
与Control组比较,H/R组细胞MEG3表达水平与细胞活力降低,细胞凋亡率均增高(P<0.05);与H/R+Ad-GFP组比较,H/R+Ad-MEG3组H9c2细胞MEG3表达水平与细胞活力增高,细胞凋亡率均降低(P<0.05);与H/R+Ad-MEG3+si-NC组比较,H/R+Ad-MEG3+si-Nrf2组细胞MEG3表达水平与细胞活力降低,细胞凋亡率增高(P<0.05)。详见图2、图3。
2.3不同处理对H/R诱导的H9c2细胞中氧化应激反应的影响
与Control组比较,H/R组细胞ROS水平增高,SOD和CAT活性降低(P<0.05);与H/R+Ad-GFP组比较,H/R+Ad-MEG3组细胞ROS水平降低,SOD和CAT活性增高(P<0.05);与H/R+Ad-MEG3+si-NC组比较,H/R+Ad-MEG3+si-Nrf2组H9c2细胞ROS水平增高,SOD和CAT活性降低(P<0.05)。详见图4。
2.4不同处理对H/R诱导的H9c2细胞中Nrf2/ARE通路的影响
与Control组比较,H/R组H9c2细胞中Nrf2、HO-1及NQO-1蛋白表达水平均增高(P<0.05);与H/R+Ad-GFP组比较,H/R+Ad-MEG3组H9c2细胞中Nrf2、HO-1及NQO-1蛋白表达水平均增高(P<0.05);与H/R+Ad-MEG3+si-NC组比较,H/R+Ad-MEG3+si-Nrf2组H9c2细胞中Nrf2、HO-1及NQO-1蛋白表达水平均降低(P<0.05)。详见图5、图6。
3讨论
ROS是缺血再灌注损伤中的信号介质[8]。血流的快速恢复增加了组织氧合水平,并导致第2次ROS生成爆发,通过诱导氧化应激和细胞凋亡导致组织再灌注损伤[2]。地黄多糖通过提高细胞活力和抗氧化酶SOD、CAT等的活性,降低细胞凋亡率和氧化应激损伤,从而对H/R损伤的心肌细胞发挥保护作用[9]。MEG3是一种抑癌因子,研究显示,MEG3在肝细胞和组织中下调,可通过调控miR-34a/Nrf2信号通路保护肝细胞免受H/R损伤[10]。本研究结果显示,MEG3过表达通过提高抗氧化酶SOD和CAT的活性,抑制氧化应激,保护H9c2细胞。然而,研究显示,MEG3通过抑制miR-7-5p表达促进心肌缺血再灌注损伤[5],与本研究结果不同,这种差异可能与H/R造模方式不同、采用检测的平台不同、细胞微环境或实验操作方法的不同有关。因此,有必要对MEG3的作用机制进行深入探究。
ROS可影响包括Nrf2/ARE在内的多种信号通路[11],Nrf2/ARE处于氧化应激的中心地位。减少ROS的产生和调节Nrf2/ARE通路可能是减少与缺血再灌注相关的组织损伤的新治疗策略。研究表明,Nrf2/ARE信号通路在保护心肌缺血再灌注损伤中发挥重要作用,并可作为治疗靶点[6-7]。Nrf2是细胞抗氧化反应的关键调节因子,通过两方面发挥氧化应激作用,1)通过加速Nrf2 mRNA转录增加蛋白合成;2)从细胞质中释放出来,转移到细胞核,与基因启动子区域的ARE结合,包括HO-1和NQO-1,参与氧化还原调节[12]。淫羊藿苷调节Nrf2/HO-1通路抑制H/R心肌细胞损伤[13]。本研究结果显示,上调MEG3表达增加了H/R刺激的H9c2细胞中Nrf2、HO-1及NQO-1表达水平,下调Nrf2表达可部分逆转MEG3过表达对H/R心肌细胞和Nrf2/ARE的影响,推测MEG3过表达激活Nrf2/ARE通路保护H/R心肌细胞。
综上所述,MEG3过表达通过抑制氧化应激和细胞凋亡保护H/R心肌损伤,可能与激活Nrf2/ARE抗氧化信号有关。但本研究未在动物模型和其他细胞系中验证MEG3功能,且并未深入探究MEG3如何调控Nrf2/ARE通路。后续将针对以上不足进一步完善研究。
参考文献:
[1]DANG X Y,ZHANG R,PENG Z,et al.HIPK2 overexpression relieves hypoxia/reoxygenation-induced apoptosis and oxidative damage of cardiomyocytes through enhancement of the Nrf2/ARE signaling pathway[J].Chemico-Biological Interactions,2020,316:108922.
[2]JUNG H Y,OH S H,AHN J S,et al.NOX1 inhibition attenuates kidney ischemia-reperfusion injury via inhibition of ROS-mediated ERK signaling[J].International Journal of Molecular Sciences,2020,21(18):6911.
[3]李林林,吴聪.长链非编码RNA 在自身免疫性疾病中的研究进展[J].基础医学与临床,2019,39(4):573-576.
[4]MISHRA S,VERMA S S,RAI V,et al.Long non-coding RNAs are emerging targets of phytochemicals for cancer and other chronic diseases[J].Cellular and Molecular Life Sciences,2019,76(10):1947-1966.
[5]ZOU L Y,MA X K,LIN S,et al.Long noncoding RNA-MEG3 contributes to myocardial ischemia-reperfusion injury through suppression of miR-7-5p expression[J].Bioscience Reports,2019,39(8):BSR20190210.
[6]CHU S F,ZHANG Z,ZHOU X,et al.Ginsenoside Rg1 protects against ischemic/reperfusion-induced neuronal injury through miR-144/Nrf2/ARE pathway[J].Acta Pharmacologica Sinica,2019,40(1):13-25.
[7]ZHANG Y.CTRP13 Protects H9c2 cells against hypoxia/reoxygenation(H/R)-induced injury via regulating the AMPK/Nrf2/ARE signaling pathway[J].Cell Transplant,2021,30:9636897211033275.
[8]ZHUANG Y,WU H R,WANG X X,et al.Resveratrol attenuates oxidative stress-induced intestinal barrier injury through PI3K/Akt-mediated Nrf2 signaling pathway[J].Oxidative Medicine and Cellular Longevity,2019,2019:7591840.
[9]孙立峰.地黄多糖对乳鼠心肌细胞缺氧/复氧损伤保护作用的研究[J].医学研究杂志,2016,45(4):146-150.
[10]HUANG X L,GAO Y,QIN J,et al.The mechanism of long non-coding RNA MEG3 for hepatic ischemia-reperfusion:mediated by miR-34a/Nrf2 signaling pathway[J].J Cell Biochem,2018,129(1):1163-1172.
[11]LI Y,SHI J,SUN X T,et al.Theaflavic acid from black tea protects PC12 cells against ROS-mediated mitochondrial apoptosis induced by OGD/R via activating Nrf2/ARE signaling pathway[J].Journal of Natural Medicines,2020,74(1):238-246.
[12]ABD EL-TWAB S M,HUSSEIN O E,HOZAYEN W G,et al.Chicoric acid prevents methotrexate-induced kidney injury by suppressing NF-κB/NLRP3 inflammasome activation and up-regulating Nrf2/ARE/HO-1 signaling[J].Inflammation Research,2019,68(6):511-523.
[13]LIU X J,LV Y F,CUI W Z,et al.Icariin inhibits hypoxia/reoxygenation-induced ferroptosis of cardiomyocytes via regulation of the Nrf2/HO-1 signaling pathway[J].FEBS Open Bio,2021,11(11):2966-2976.
(收稿日期:2022-06-22)
(本文编辑邹丽)
