基于Nrf2-GPX4铁死亡途径探讨芒果苷对大鼠心肌缺血再灌注损伤的作用机制
2024-04-29潘敏丽,黄国定,蔡冠虎,卢宏全
潘敏丽,黄国定,蔡冠虎,卢宏全
摘要 目的:探讨芒果苷对大鼠心肌缺血再灌注损伤(MIRI)的保护机制。方法:60只无特定病原体(SPF)级健康雄性SD大鼠随机分为假手术组、MIRI组、芒果苷低剂量组、芒果苷高剂量组、芒果苷+核因子E2相关因子2(Nrf2)抑制剂(ML385)组,每组12只。除假手术组外,其余组大鼠通过结扎左冠状动脉前降支建立MIRI模型。再灌注4 h后,采用酶联免疫吸附测定法(ELISA)测定血清肌钙蛋白I(cTnI)、乳酸脱氢酶(LDH)、肌酸激酶(CK)水平;苏木精-伊红(HE)染色观察心肌组织病理学变化;末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(TUNEL)分析心肌细胞凋亡情况;二氢乙锭(DHE)荧光法检测心肌组织活性氧(ROS)水平;比色法检测心肌组织超氧化物歧化酶(SOD)活性、丙二醛(MDA)、谷胱甘肽(GSH)和亚铁离子(Fe2+)含量;实时荧光定量逆转录聚合酶链式反应(qRT-PCR)和蛋白免疫印迹法(Western Blot)检测心肌组织Nrf2、谷胱甘肽过氧化物酶4(GPX4)、铁蛋白重链1(FTH1)、长链脂酰辅酶A合成酶4(ACSL4)的基因和蛋白表达。结果:与假手术组比较,MIRI组大鼠血清cTnI、CK和LDH水平,心肌细胞凋亡率,ROS、MDA、Fe2+含量,ACSL4 mRNA和蛋白水平升高;SOD活性和GSH含量,Nrf2、GPX4、FTH1 mRNA和蛋白水平降低(P<0.05);心肌细胞肿胀,心肌纤维排列紊乱,大量炎性细胞浸润。与MIRI组比较,芒果苷低剂量组、芒果苷高剂量组血清cTnI、CK和LDH水平,心肌细胞凋亡率,ROS、MDA和Fe2+含量,ACSL4 mRNA和蛋白水平降低;SOD活性和GSH含量,Nrf2、GPX4、FTH1 mRNA和蛋白水平升高(P<0.05);心肌细胞水肿减轻,少量心肌纤维断裂和炎性细胞浸润。使用Nrf2抑制剂ML385抑制Nrf2的核易位可明显阻断芒果苷对心肌铁死亡的抑制作用(P<0.05)。结论:芒果苷可通过激活Nrf2-GPX4轴抑制铁死亡对MIRI发挥保护作用。
关键词心肌缺血再灌注损伤;铁死亡;芒果苷;核因子E2相关因子2;谷胱甘肽过氧化物酶4;实验研究
doi:10.12102/j.issn.1672-1349.2024.04.011
Effect of Mangiferin on Myocardial Ischemia-reperfusion Injury in Rats Based on Nrf2-GPX4 Ferroptosis Pathway
PAN Minli, HUANG Guoding, CAI Guanhu, LU Hongquan
Hainan Western Central Hospital, Danzhou 571700, Hainan, China, E-mail: pml1984p@163.com
AbstractObjective:To investigate the protective effect of mangiferin on myocardial ischemia-reperfusion injury(MIRI) in rats.Methods:Sixty healthy male SD rats without specific pathogen(SPF) grade were randomly divided into sham operation group,MIRI group,low-dose mangiferin group,high-dose mangiferin group,and mangiferin +Nrf2 inhibitor(ML385) group,with 12 rats in each group.Except the sham group,the MIRI model was established by ligation of the anterior descending branch of the left coronary artery.After 4 h of reperfusion,serum troponin I(cTnI),lactate dehydrogenase(LDH) and creatine kinase(CK) levels were determined by enzyme-linked immunosorbent assay(ELISA).The cardiac histopathological changes were observed by hematoxylin-eosin(HE) staining.Myocardial cell apoptosis was analyzed by terminal deoxyribonucleotidyl transferase(TdT)-mediated dUTP nick end labeling(TUNEL) method.Dihydroethidium(DHE) fluorescence assay was used to detect the level of reactive oxygen species(ROS) in myocardial tissue.Superoxide dismutase(SOD) activity,malondialdehyde(MDA),glutathione(GSH),and ferrous ion(Fe2+) contents were detected by colorimetry.Quantitative reverse transcription polymerase chain reaction(qRT-PCR) and Western Blot were used to detect the gene and protein expression of nuclear factor E2-related factor 2(Nrf2),glutathione peroxidase 4(GPX4),ferritin heavy chain 1(FTH1),and long chain fatty acyl-CoA synthetase 4(ACSL4) in myocardial tissue.Results:Compared with sham group,serum levels of cTnI,CK and LDH,cardiomyocyte apoptosis rate,ROS,MDA,Fe2+ content,ACSL4 mRNA and protein levels of rats in MIRI group increased,SOD activity and GSH content,Nrf2,GPX4,FTH1 mRNA and protein levels decreased(P<0.05),cardiomyocytes were swollen,myocardial fibers were disordered,and a large number of inflammatory cells were infiltrated.Compared with MIRI group,serum cTnI,CK and LDH levels,cardiomyocyte apoptosis rate,ROS,MDA and Fe2+ contents,ACSL4 mRNA and protein levels in low-dose mangiferin group,high-dose mangiferin group decreased,SOD activity and GSH content,Nrf2,GPX4,FTH1 mRNA and protein levels increased(P<0.05),cardiomyocyte edema reduced,with a small amount of myocardial fiber rupture and inflammatory cell infiltration.Inhibition of nuclear translocation of Nrf2 by Nrf2 inhibitor ML385 could significantly block the inhibitory effect of mangiferin on cardiac ferroptosis(P<0.05).Conclusion:Mangiferin can protect MIRI by inhibiting ferroptosis through activation of Nrf2-GPX4 axis.
Keywordsmyocardial ischemia-reperfusion injury; ferroptosis; mangiferin; nuclear factor-E2-related factor 2; glutathione peroxidase 4; experimental study
心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)是缺血性心脏病病人冠状动脉血流恢复后导致心肌功能障碍、结构损伤和心肌梗死死亡率增加的一种病理过程[1]。MIRI已成为威胁人类健康的主要危险因素之一。铁死亡是一种依赖铁的新型细胞死亡形式,以活性氧(reactive oxygen species,ROS)产生增加和脂质过氧化为特征,与氧化应激密切相关[2]。研究显示,铁死亡是心肌细胞死亡的一种重要形式,由谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)的失活和脂质过氧化物的积累引起,是MIRI的主要驱动因素[3-4]。心肌梗死期间GPX4的下调有助于心肌细胞的铁死亡[5],而铁死亡抑制剂可通过恢复GPX4水平,减轻MIRI[6]。因此,铁死亡是MIRI的治疗新靶点。
近年来,中医药防治MIRI的探索和研究备受关注。芒果苷(mangiferin,MF)是一种在芒果和木瓜中发现的天然葡糖基黄酮,具有抗炎、抗凋亡和抗氧化作用[7];芒果苷已被证实可保护心肌细胞免受心肌梗死和MIRI的影响[8-9],然而,潜在的机制仍不完全明确。研究显示,芒果苷的保护作用与激活核因子E2相关因子2(nuclear factor-E2-related factor 2,Nrf2)增强抗氧化剂防御系统有关[10]。Nrf2是维持铁稳态的关键蛋白,主要通过直接影响GPX4的合成和功能来调节铁死亡[11]。然而,探讨芒果苷减轻MIRI的作用是否与铁死亡有关的研究较少。因此,本研究基于Nrf2-GPX4介导的铁死亡通路评估芒果苷减轻MIRI的机制。
1材料与方法
1.1动物
60只无特定病原体(SPF)级8~10周健康雄性SD大鼠,体质量260~300 g,由济南朋悦实验动物繁育有限公司[许可证号为SCXK(鲁)2019 0003]提供。将所有SD大鼠置于12 h黑暗/12 h光照循环、温度23~25 ℃和湿度55%~70%的环境下,给予标准食物饲养,可以自由饮水。实验前所有动物禁食12 h。
1.2主要试剂与仪器
芒果苷(纯度>98%,M-018,成都瑞芬思生物科技有限公司,中国);Nrf2特异性抑制剂ML385(HY-100523,MedChemExpress,美国);肌酸激酶(creatine kinase,CK)、肌钙蛋白I(cardiac troponin I,cTnI)(ml059111)、乳酸脱氢酶(lactate dehydrogenase,LDH)(ml059178)酶联免疫吸附测定法(ELISA)试剂盒(上海酶联生物科技有限公司,中国);超氧化物歧化酶(superoxide dismutase,SOD)(A001-3-2)、谷胱甘肽(glutathione,GSH)(A006-2-1)、丙二醛(malondialdehyde,MDA)(A003-1-2)检测试剂盒(南京建成生物工程研究所,中国);二氢乙锭(dihydroethidium,DHE)荧光探针(D11347,invitrogen,美国);亚铁离子(Fe2+)检测试剂盒(E-BC-K304-S,武汉伊莱瑞特生物科技股份有限公司,中国);兔源一抗Nrf2(ab137550)、Lamin B1(ab133741)、GPX4(ab125066)、铁蛋白重链1(Ferritin Heavy Chain 1,FTH1)(ab183781)、长链脂酰辅酶A合成酶4(long-chain acyl-CoA synthetase 4,ACSL4)(ab155282)、GAPDH(ab181602)(Abcam,英国)。iMark680多功能酶标仪(Bio-Rad,美国);ABI Prism 7500型荧光定量聚合酶链式反应(PCR)仪(Applied Biosystems,美国);NanoDrop 2000分光光度计(Thermo Fisher Scientific,美国);LSM 510激光共聚焦显微镜(Zeiss,德国)。
1.3分组与建模
将大鼠随机分为假手术组、MIRI组、芒果苷低剂量组、芒果苷高剂量组、芒果苷+Nrf2抑制剂(ML385)组,每组12只。除假手术组外,其余各组大鼠腹腔注射1%戊巴比妥钠(60 mg/kg)麻醉,气管插管后用动物呼吸机进行机械通气。三导联心电图用于监测心肌缺血开始时的心跳以及典型的心电图变化。通过活结结扎左冠状动脉前降支30 min诱导心肌缺血,然后心肌再灌注4 h建立MIRI模型[12]。假手术组接受相同的手术方法,但不结扎左冠状动脉前降支。心电图ST段持续升高、左心室心尖和前壁白色表示缺血模型诱导成功,心电图ST段下降50%以上、左心室心尖和前壁恢复和变红表明再灌注成功。手术完成后,仔细逐层缝合大鼠肌肉和皮肤,并在切口处注射少量青霉素或用碘伏擦拭,对创面进行消毒,防止创面感染。假手术组和MIRI组大鼠在术前给予生理盐水灌胃1周,芒果苷低剂量组和芒果苷高剂量组大鼠在术前分别灌胃芒果苷20、40 mg/kg,芒果苷+ML385组大鼠灌胃芒果苷40 mg/kg的同时腹腔注射30 mg/kg ML385,每日1次,连续干预1周[6,8]。
1.4ELISA法测定血清cTnI、LDH、CK水平
再灌注4 h后,戊巴比妥钠麻醉大鼠,腹主动脉取血,静置后离心(1 000×g,10 min),取血清,并将血清储存在-20 ℃冰箱。采用ELISA试剂盒检测血清LDH、cTnI、CK水平。
1.5苏木精-伊红(HE)染色观察心肌组织病理学变化
取血完成后,小心取出大鼠心脏并将其置于预冷的磷酸缓冲盐溶液(PBS)中,去除结缔组织和脂肪组织。然后每组随机选取6只大鼠心肌并分为两部分,一部分心肌组织在异戊烷中快速冷冻,并防止冰晶形成,然后用冷冻切片机小心地将组织切成薄片,用于检测ROS水平;另一部分在4%多聚甲醛中固定24 h,包埋在石蜡中,切成4 μm厚的切片,经脱蜡、水化后用苏木精染色5 min,用流水洗涤,然后用1%盐酸乙醇分化1~3 s,弱氨水浸泡5~10 s,0.5%伊红溶液染色30~60 s,之后用不同浓度的乙醇浸泡,中性树胶密封。每张切片随机选取5个视野在光学显微镜下观察组织病理学变化。
1.6末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(TUNEL)测定心肌细胞凋亡
取石蜡包埋的心肌组织切片,充分脱蜡和水化,然后在蛋白酶K中透化10 min。PBS洗涤后将切片在黑暗条件下与TUNEL反应混合液反应1 h,然后用4′,6-二脒基-2-苯基吲哚(DAPI)染色。在荧光显微镜下对组织切片进行成像,并计算TUNEL阳性细胞的数量。TUNEL阳性染色细胞显示绿色荧光,所有用DAPI染色的细胞核均产生蓝色荧光。凋亡率=TUNEL阳性染色的凋亡心肌细胞数/心肌细胞总数×100%。
1.7DHE荧光染色法检测心肌组织ROS水平
使用DHE荧光探针检测心肌冰冻切片中的ROS。将左心室心肌样品(10 μm切片)与10 μmol/L的DHE在暗室中于37 ℃孵育20 min;然后用PBS清洗3次。在荧光显微镜下观察DHE染色的荧光强度,并使用Image-Pro Plus 6.0软件分析所有图像。为了量化,每张切片随机选择3个视野,分析阳性染色细胞的平均荧光强度。
1.8比色法检测心肌组织SOD、MDA、GSH和Fe2+含量
将每组剩余6只大鼠的心肌组织分为两部分,一部分液氮速冻后于-80 ℃保存,用于实时荧光定量逆转录聚合酶链式反应法(qRT-PCR)和蛋白免疫印迹法(Western Blot)检测;另一部分加入9倍的预冷生理盐水研磨,以12 000×g离心10 min,收集上清液为组织匀浆液,参照试剂盒说明使用比色法检测匀浆液中MDA、GSH含量和SOD活性以及Fe2+含量。
1.9qRT-PCR检测心肌组织铁死亡相关基因表达
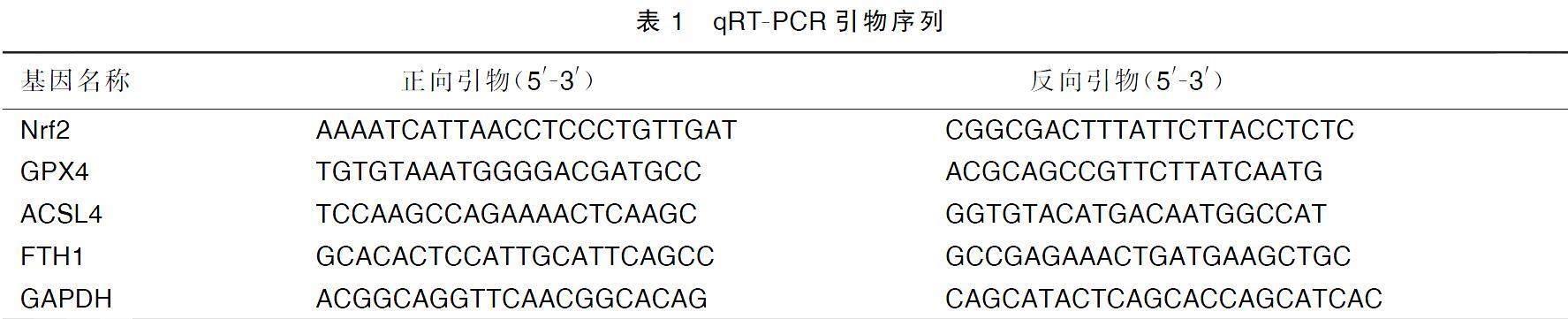
使用Trizol试剂分离心肌组织中的总RNA,并使用逆转录试剂盒进行cDNA合成。用SYBR Green PCR Master Mix在荧光定量PCR仪上进行扩增,测量所有基因的表达。PCR扩增条件如下(总体积25 μL):55个循环,95 ℃变性5 min,50 ℃退火60 min,72 ℃延伸15 min。采用2-△△Ct法分析目的基因表达,并将目的基因的相对表达量标准化为GAPDH的相对表达量。引物序列详见表1。
1.10Western Blot检测心肌组织Nrf2、GPX4、FTH1、ACSL4蛋白表达
使用含有蛋白酶抑制剂的RIPA裂解缓冲液从心肌组织中提取总蛋白,并使用核蛋白提取试剂盒提取核蛋白。使用二喹啉甲酸(BCA)蛋白质试剂盒测定蛋白质浓度,将蛋白质样品通过10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转移到聚偏二氟乙烯(PVDF)膜。PVDF在室温下用5%脱脂牛奶封闭1 h,然后在4 ℃下用适当稀释度的特异性一抗孵育过夜。用于实验的一抗有GPX4(1∶1000)、Nrf2(1∶1 000)、FTH1(1∶1 000)、ACSL4(1∶1 000)、Lamin B1(1∶1 000)和GAPDH(1∶5 000)。然后,将膜用HRP偶联的二抗(1∶5 000)在室温下孵育1 h,并用增强的化学发光试剂(ECL)显色。通过Image-Pro Plus 6.0软件分析蛋白条带的灰度值,并以Lamin B1、GAPDH为内参蛋白,分析膜上目的蛋白相对表达量。
1.11统计学处理
采用GraphPad Prism软件进行数据分析。符合正态分布的定量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析(ANOVA),多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2结果
2.1芒果苷对MIRI大鼠血清cTnI、LDH、CK水平的影响
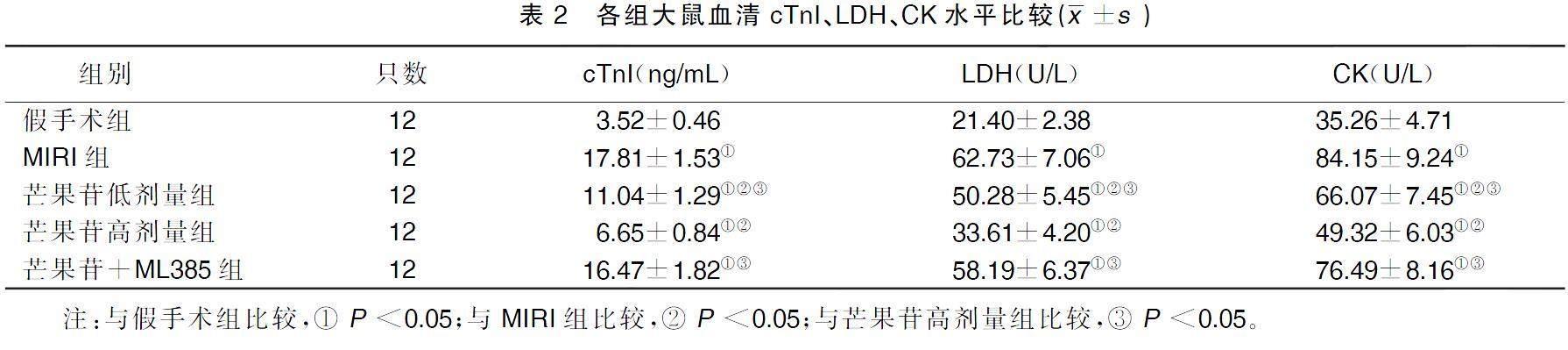
与假手术组比较,MIRI组大鼠血清cTnI、CK和LDH水平升高(P<0.05);与MIRI组比较,芒果苷低剂量组、芒果苷高剂量组大鼠血清cTnI、CK和LDH水平降低(P<0.05);与芒果苷高剂量组比较,芒果苷低剂量组和芒果苷+ML385组大鼠血清cTnI、CK和LDH水平升高(P<0.05)。详见表2。
2.2芒果苷对MIRI大鼠心肌组织病理损伤的影响
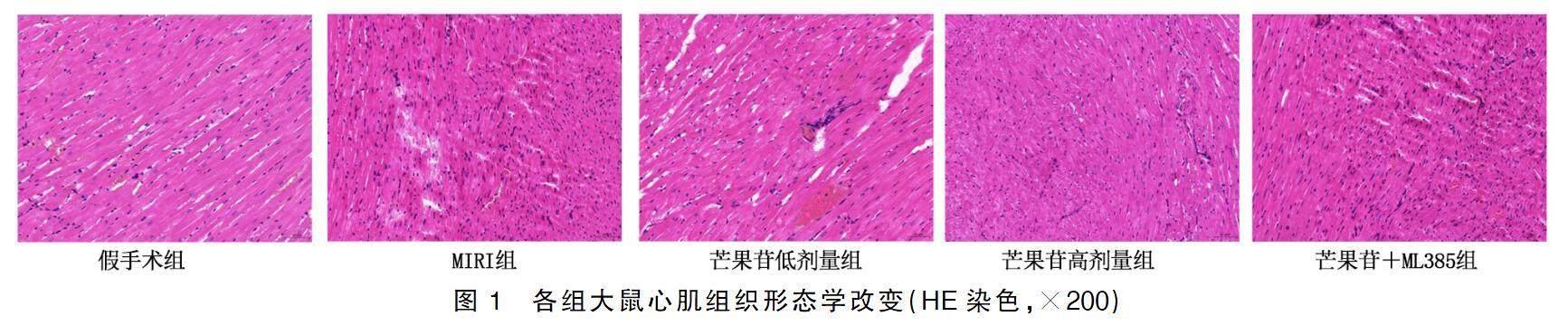
HE染色结果显示,假手术组心肌细胞形态均匀,心肌纤维结构正常,未出现断裂;MIRI组心肌结构受损,心肌细胞肿胀、核固缩,心肌细胞减少,纤维排列紊乱,大量炎性细胞浸润;与MIRI组比较,芒果苷低剂量组、芒果苷高剂量组上述病理变化明显减轻,可见轻度细胞水肿,心肌细胞数量增加,少量心肌纤维断裂和炎性细胞浸润;与芒果苷高剂量组比较,芒果苷低剂量组和芒果苷+ML385组心肌细胞排列较紊乱,炎性细胞浸润增加。详见图1。
2.3芒果苷对MIRI大鼠心肌细胞凋亡的影响
与假手术组比较,MIRI组TUNEL阳性细胞数量明显增多,凋亡率升高(P<0.05);与MIRI组比较,芒果苷低剂量组、芒果苷高剂量组TUNEL阳性细胞数量明显减少,凋亡率降低(P<0.05);与芒果苷高剂量组比较,芒果苷低剂量组和芒果苷+ML385组TUNEL阳性细胞数量增多,凋亡率升高(P<0.05)。详见图2、表3。
2.4芒果苷对MIRI大鼠心肌组织ROS水平的影响
与假手术组比较,MIRI组ROS水平升高(P<0.05);与MIRI组比较,芒果苷低剂量组、芒果苷高剂量组ROS水平降低(P<0.05);与芒果苷高剂量组比较,芒果苷低剂量组和芒果苷+ML385组ROS水平升高(P<0.05)。详见图3、表3。
2.5芒果苷对MIRI大鼠心肌组织SOD活性、MDA、GSH和Fe2+含量的影响
与假手术组比较,MIRI组心肌组织MDA和Fe2+含量升高,SOD活性和GSH含量降低(P<0.05);与MIRI组比较,芒果苷低剂量组、芒果苷高剂量组MDA和Fe2+含量降低,SOD活性和GSH含量升高(P<0.05);与芒果苷高剂量组比较,芒果苷低剂量组和芒果苷+ML385组MDA和Fe2+含量升高,SOD活性和GSH含量降低(P<0.05)。详见表4。
2.6芒果苷对MIRI大鼠心肌组织Nrf2、GPX4、FTH1、ACSL4 mRNA表达的影响
与假手术组比较,MIRI组心肌组织Nrf2、GPX4、FTH1 mRNA水平降低,ACSL4 mRNA水平升高(P<0.05);与MIRI组比较,芒果苷低剂量组、芒果苷高剂量组Nrf2、GPX4、FTH1 mRNA水平升高,ACSL4 mRNA水平降低(P<0.05);与芒果苷高剂量组比较,芒果苷低剂量组和芒果苷+ML385组Nrf2、GPX4、FTH1 mRNA水平降低,ACSL4 mRNA水平升高(P<0.05)。详见表5。
2.7芒果苷对MIRI大鼠心肌组织Nrf2、GPX4、FTH1、ACSL4蛋白表达的影响
与假手术组比较,MIRI组心肌组织Nrf2、GPX4、FTH1蛋白水平降低,ACSL4蛋白水平升高(P<0.05);与MIRI组比较,芒果苷低剂量组、芒果苷高剂量组Nrf2、GPX4、FTH1蛋白水平升高,ACSL4蛋白水平降低(P<0.05);与芒果苷高剂量组比较,芒果苷低剂量组和芒果苷+ML385组Nrf2、GPX4、FTH1蛋白水平降低,ACSL4蛋白水平升高(P<0.05)。详见图4、表6。
3讨论
本研究结果显示,芒果苷干预降低了MIRI大鼠血清cTnI、CK和LDH水平,改善了心肌病理学变化,减少了心肌细胞凋亡,增强了抗氧化防御能力。此外,本研究发现,芒果苷可通过降低ROS、铁和脂质过氧化物的表达以及增加抗铁死亡酶的表达抑制MIRI引起的心肌铁死亡。铁死亡是新发现的细胞死亡调节模式之一,其特征是铁依赖性脂质过氧化[2]。铁死亡与多种心血管疾病有关,是心血管疾病的潜在治疗靶点[13-14]。研究显示,MIRI后产生大量ROS,Fe2+可以通过芬顿反应增强ROS的产生,然后ROS会与生物膜中的多不饱和脂肪酸发生脂质过氧化反应,导致心肌细胞铁死亡[12]。铁蛋白(FTH1、FTL)是一种铁死亡抑制剂,可将Fe2+氧化成三价铁以避免芬顿反应的发生[14]。ACSL4不仅是铁死亡的敏感监测器,而且是铁死亡的关键执行者,其过表达诱导铁死亡[15]。随着对铁死亡分子机制的日益了解,铁死亡已成为心肌病潜在的诊断和治疗靶点。本实验结果显示,MIRI后心肌组织中ROS、MDA水平和Fe2+含量显著增加,GSH含量和SOD活性明显降低;qRT-PCR和Western Blot结果显示,促进铁死亡的相关基因和蛋白(ACSL4)表达也显著增加,抗铁死亡基因和蛋白(GPX4、FTH1)表达显著降低,表明MIRI诱导后大鼠心肌组织中铁死亡增加。
GPX4是调节铁死亡的关键抗氧化酶,可特异性有效地去除磷脂过氧化氢,从而抑制铁死亡[16]。研究显示,在心肌梗死的早期和中期,GPX4的下调有助于心肌细胞的铁死亡[5]。转录因子Nrf2是细胞抗氧化应激的主要调节因子,在铁死亡中起着至关重要的作用,GPX4、FTH1、FTL和FPN等基因均是参与铁死亡的Nrf2靶基因[17-18]。Nrf2依赖的细胞防御机制在刺激后被激活,导致Nrf2与Keap1分离,促进Nrf2进入细胞核以激活其下游基因[19-20]。在本研究中,MIRI大鼠心肌组织发生铁死亡的同时伴随着Nrf2(胞核)的下调,表明Nrf2核易位被抑制,导致抗铁死亡基因和蛋白表达降低。多项研究证实,芒果苷主要通过激活Nrf2表现出药理作用。芒果苷在体外和体内可通过激活Nrf-2/血红素加氧酶(HO-1)通路,抑制氧化应激和炎症反应,减轻MIRI[8];还可通过激活Nrf2以减轻心脏纤维化[21]。因此,推测芒果苷对MIRI的保护作用可能与Nrf2-GPX4信号通路介导的铁死亡有关。在本研究中,芒果苷应用于MIRI大鼠后,Nrf2、GPX4和FTH1的mRNA和蛋白表达水平均增加,表明Nrf2-GPX4轴被激活。为了验证此结果,本研究在给予芒果苷干预的基础上,使用Nrf2抑制剂ML385抑制Nrf2的核易位,结果显示,ML385可明显阻断芒果苷对心肌铁死亡的抑制作用,提示芒果苷可通过激活Nrf2-GPX4轴抑制铁死亡,对MIRI发挥保护作用。
综上所述,芒果苷可以通过调节Nrf2-GPX4轴抑制铁死亡,从而减轻大鼠MIRI。本研究表明,芒果苷可作为一种潜在的铁死亡抑制剂预防MIRI期间的铁死亡,为芒果苷治疗MIRI提供了坚实的基础。在未来的研究中,将结合体外细胞实验进一步验证芒果苷的抗铁死亡作用及分子机制。
参考文献:
[1]VELTMAN D,WU M,POKREISZ P,et al.Clec4e-receptor signaling in myocardial repair after ischemia-reperfusion injury[J].JACC Basic to Translational Science,2021,6(8):631-646.
[2]CHEN X,LI J B,KANG R,et al.Ferroptosis:machinery and regulation[J].Autophagy,2021,17(9):2054-2081.
[3]LIN J H,YANG K T,LEE W S,et al.Xanthohumol protects the rat myocardium against ischemia/reperfusion injury-induced ferroptosis[J].Oxidative Medicine and Cellular Longevity,2022,2022:1-14.
[4]ZHAO W K,ZHOU Y,XU T T,et al.Ferroptosis:opportunities and challenges in myocardial ischemia-reperfusion injury[J].Oxidative Medicine and Cellular Longevity,2021,2021:9929687.
[5]PARK T J,PARK J H,LEE G S,et al.Quantitative proteomic analyses reveal that GPX4 downregulation during myocardial infarction contributes to ferroptosis in cardiomyocytes[J].Cell Death & Disease,2019,10(11):835.
[6]LV Z Q,WANG F E,ZHANG X F,et al.Etomidate attenuates the ferroptosis in myocardial ischemia/reperfusion rat model via Nrf2/HO-1 pathway[J].Shock,2021,56(3):440-449.
[7]ISMAIL M B,RAJENDRAN P,ABUZAHRA H M,et al.Mangiferin inhibits apoptosis in doxorubicin-induced vascular endothelial cells via the Nrf2 signaling pathway[J].International Journal of Molecular Sciences,2021,22(8):4259.
[8]LIU K,WANG F,WANG S,et al.Mangiferin attenuates myocardial ischemia-reperfusion injury via MAPK/nrf-2/HO-1/NF-κB in vitro and in vivo[J].Oxidative Medicine and Cellular Longevity,2019,2019:1-12.
[9]GUAN W,LIU Y,LIU Y A,et al.Proteomics research on the protective effect of mangiferin on H9c2 cell injury induced by H2O2[J].Molecules,2019,24(10):1911.
[10]PIAO C H,FAN Y J,VAN NGUYEN T,et al.Mangiferin alleviates ovalbumin-induced allergic rhinitis via Nrf2/HO-1/NF-κB signaling pathways[J].International Journal of Molecular Sciences,2020,21(10):3415.
[11]LANE D J R,METSELAAR B,GREENOUGH M,et al.Ferroptosis and NRF2:an emerging battlefield in the neurodegeneration of Alzheimer′s disease[J].Essays in Biochemistry,2021,65(7):925-940.
[12]XU S J,WU B X,ZHONG B Y,et al.Naringenin alleviates myocardial ischemia/reperfusion injury by regulating the nuclear factor-erythroid factor 2-related factor 2(Nrf2)/System xc-/glutathione peroxidase 4(GPX4) axis to inhibit ferroptosis[J].Bioengineered,2021,12(2):10924-10934.
[13]ZHOU Y Q,ZHOU H X,HUA L,et al.Verification of ferroptosis and pyroptosis and identification of PTGS2 as the hub gene in human coronary artery atherosclerosis[J].Free Radical Biology & Medicine,2021,171(5):55-68.
[14]LENG Y L,LUO X,YU J Y,et al.Ferroptosis:a potential target in cardiovascular disease[J].Frontiers in Cell and Developmental Biology,2022,9:813668.
[15]YUAN H,LI X M,ZHANG X Y,et al.Identification of ACSL4 as a biomarker and contributor of ferroptosis[J].Biochemical and Biophysical Research Communications,2016,478(3):1338-1343.
[16]YAO Y,CHEN Z A,ZHANG H,et al.Selenium-GPX4 axis protects follicular helper T cells from ferroptosis[J].Nature Immunology,2021,22(9):1127-1139.
[17]SONG X H,LONG D X.Nrf2 and ferroptosis:a new research direction for neurodegenerative diseases[J].Frontiers in Neuroscience,2020,14:267.
[18]DONG H,QIANG Z Z,CHAI D D,et al.Nrf2 inhibits ferroptosis and protects against acute lung injury due to intestinal ischemia reperfusion via regulating SLC7A11 and HO-1[J].Aging,2020,12(13):12943-12959.
[19]SUN Y R,HE L B,WANG T Y,et al.Activation of p62-Keap1-Nrf2 pathway protects 6-hydroxydopamine-induced ferroptosis in dopaminergic cells[J].Molecular Neurobiology,2020,57(11):4628-4641.
[20]GAO G,XIE Z S,LI E W,et al.Dehydroabietic acid improves nonalcoholic fatty liver disease through activating the Keap1/Nrf2-ARE signaling pathway to reduce ferroptosis[J].Journal of Natural Medicines,2021,75(3):540-552.
[21]SONG J N,MENG Y X,WANG M,et al.Mangiferin activates Nrf2 to attenuate cardiac fibrosis via redistributing glutaminolysis-derived glutamate[J].Pharmacological Research,2020,157:104845.
(收稿日期:2022-05-31)
(本文编辑邹丽)
