基于网络药理学和分子对接探讨丹参治疗冠心病和脑卒中的“异病同治”作用机制研究
2024-04-29曹唯仪,付荩毅,李睿,程苗苗
曹唯仪,付荩毅,李睿,程苗苗

摘要 目的:基于网络药理学及分子对接方法探讨丹参有效成分治疗冠心病和脑卒中“异病同治”的作用机制及关键靶点。方法:通过中药系统药理学数据库和分析平台(TCMSP)、在线人类孟德尔遗传数据库(OMIM)、DrugBank等数据库筛选丹参治疗冠心病及脑卒中的潜在靶点,并通过Metascape在线平台进行靶点蛋白-蛋白相互作用(PPI)、基因本体(GO)和京都基因与基因组百科全书(KEGG)通路分析,使用Cytoscape 3.9.1构建活性成分-关键靶点-核心通路网络,筛选出核心成分。采用分子对接模拟核心成分与关键靶点的结合程度。结果:筛选丹参治疗冠心病与脑卒中“异病同治”的潜在靶点52个,主要富集于糖基化终末产物/糖基化终末产物受体(AGE/RAGE)、血小板激活、脂质与动脉粥样硬化、流体剪应力与动脉粥样硬化等通路。核心药效成分与磷脂酰肌醇-3-激酶(PI3K)、蛋白激酶B(AKT)、一氧化氮合酶(NOS3,eNOS)、B淋巴细胞瘤相关蛋白-2(Bcl-2)、环氧合酶2(PTGS2)、整合素亚基α2b(ITGA2B)、基质金属蛋白酶9(MMP9)等靶点结合稳定。结论:丹参“异病同治”冠心病与脑卒中主要通过抗血小板活化与聚集、保护心脑血管细胞、稳定斑块、减轻炎症等机制改善动脉粥样硬化,并存在靶点竞争及协同疗效的潜在可能。
关键词冠心病;脑卒中;丹参;网络药理学
doi:10.12102/j.issn.1672-1349.2024.04.002
Mechanism of the "Same Treatment of Different Diseases" of Salvia Miltiorrhiza for Treating Coronary Heart Disease and Stroke Based on Network Pharmacology and Molecular Docking
CAO Weiyi, FU Jinyi, LI Rui, CHENG Miaomiao
Xiyuan Hospital, China Academy of Chinese Medical Sciences, NMPA Key Laboratory for Clinical Research and Evaluation of Traditional Chinese Medicine, National Clinical Research Center for Chinese Medicine Cardiology, Beijing 100091, China
Corresponding AuthorLI Rui, E-mail: crystal005@163.com; CHENG Miaomiao, E-mail: caoweiyi521@163.com
AbstractObjective:To explore the heteropathy mechanism and key therapeutic targets of the "same treatment for different diseases" of salvia miltiorrhiza for the treatment of coronary heart disease(CHD) and stroke by network pharmacology and molecular docking.Methods:Potential targets for the treatment of coronary heart disease and stroke were screened through traditional Chinese medicine(TCM) System Pharmacology Database and Analysis Platform(TCMSP),online human Mendelian Genetic database(OMIM),DrugBank,and other databases.Target protein-protein interaction(PPI),Gene ontology(GO) and Kyoto Genome Encyclopedia(KEGG) pathway analysis via the Metascape online platform.The active ingredient-key target-core pathway network was constructed using Cytoscape 3.9.1 to screen out the core components.Molecular docking was used to simulate the degree of binding between core components and key targets.Results:Fifty-two potential targets of salvia miltiorrhea for the treatment of coronary heart disease and stroke were selected,mainly concentrated in the pathways of advanced glycation end products(AGE)/receptor for advanced glycation end products(RAGE),platelet activation,lipid and atherosclerosis,fluid shear stress and atherosclerosis.The core pharmacodynamic components stably bound to phosphatidylinositol-3-kinase(PI3K),protein kinase B(AKT),nitric oxide synthase(NOS3,eNOS),B lymphocytoma-associated protein-2(Bcl-2),cyclooxygenase 2(PTGS2),integrin subunit α2b(ITGA2B),matrix metalloproteinase 9(MMP9),and other targets.Conclusion:The "same treatment for different diseases" of salvia miltiorrhoea can improve atherosclerosis in coronary heart disease and stroke mainly through anti-platelet activation and aggregation,protection of cardiovascular and cerebrovascular cells,stabilization of plaque,and reduction of inflammation,with potential target competition and synergistic effects.
Keywordscoronary heart disease; stroke; salvia miltiorrhiza; network pharmacology
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)简称冠心病,是临床常见的大血管病变,西医多采用药物改善心肌缺血、缓解症状,改善预后[1],病情严重者可考虑经皮冠状动脉介入或冠状动脉旁路移植等重塑血管。中医认为冠心病属于“胸痹”的范畴。研究显示,冠心病心绞痛中血瘀证的出现频率较高,常见治疗组方中以活血化瘀药丹参最为常见[2]。脑卒中是一种常见的脑血管病变,西医主要采用抗血栓、抗血小板聚集、抗凝血、降血脂、保护神经、扩血管等药物治疗,严重者考虑静脉溶栓或血管内介入治疗[3-4]。中医证候中风、痰、瘀较为多见,且常兼夹出现[5]。丹参类注射液对出血及缺血性脑卒中急性期有一定疗效[6]。丹参始载于《神农本草经》,药性平和,祛瘀不伤正,为活血祛瘀要药。丹参制剂在心脑血管疾病中的临床应用较为广泛,研究表明,冠状动脉疾病和脑卒中病人更易接受中医药治疗,且丹参在中医药治疗中所占的比例较高[7]。本研究基于网络药理学的方法,探讨丹参治疗冠心病和脑卒中的异病同治机制。
1资料与方法
1.1丹参活性成分及潜在靶点预测
在中药系统药理学数据库与分析平台(TCMSP)(https://old.tcmsp-e.com/tcmsp.php)查找“丹参”的有效成分,筛选符合口服生物利用度(oral bioavailability,OB)≥30%且类药性(drug-likeness,DL)≥0.18的有效成分,并通过《中华人民共和国药典》[8]和相关文献[9-10 ]进行补充。
将TCMSP中获得的有效成分,优先在TCMSP中的Targets Information版块通过Mol ID查询相关蛋白。通过《中华人民共和国药典》和文献补充的有效成分和TCMSP未收录相关蛋白的成分,在PubChem(https://pubchem.ncbi.nlm.nih.gov/)上查询分子的结构式,然后在Swiss Target Prediction(http://swisstargetprediction.ch/)平台用有效分子的2D结构式查询相关蛋白。Swiss Target Prediction数据库中的Probability越高,说明蛋白与分子的相关性越高,删除搜索结果中Probability=0的靶点。最后用UniProt(https://www.uniprot.org/)查询蛋白对应的基因名。
1.2疾病靶点的收集与筛选
以“coronary heart disease”“stroke”为检索词,使用在线人类孟德尔遗传数据库(https://www.omim.org/,OMIM)、DrugBank数据库(https://go.drugbank.com/)、基因名片数据库(https://www.genecards.org/,GeneCards)和Therapeutic Target Database数据库(http://db.idrblab.net/ttd/)检索冠心病和脑卒中的疾病靶点。GeneCards的检索结果中分数越高表明基因与疾病的关联性越高,由于冠心病和脑卒中的靶点过多,冠心病只保留分数>20的靶点,脑卒中只保留分数>5的靶点。
1.3丹参“异病同治”靶点筛选
使用Draw Venn Diagram在线网站(https://bioinformatics.psb.ugent.be/)绘制丹参治疗冠心病和脑卒中的潜在靶点Venn图。
1.4网络构建
使用Metascape在线网站(https://metascape.org/)对交集靶点的蛋白-蛋白相互作用(PPI)网络进行分析,以物理相互作用分数>0.132生成PPI子集。采用Cytoscape 3.9.1对PPI子集进行可视化分析,并使用Molecular complex detection(MCODE)插件对PPI网络进行模块聚类分析。将MCODE评分较高的类族靶点作为关键靶点。
1.5富集分析
利用Metascape在线网站(https://metascape.org/)对关键靶点进行基因本体(GO)和京都基因和基因组百科全书(KEGG)分析,GO包括生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)分析。利用微生信平台(http://www.bioinformatics.com.cn/)对包含基因较多的通路进行可视化分析。通路分析使用KEGG与Reactome(https://reactome.org/PathwayBrowser/)集成数据库,并将检索到的相似度>0.3的通路聚类,使用Cytoscape 3.9.1对P值排序前8位的主通路及与疾病相关度较高的子类通路进行可视化处理。筛选与文献报道中疾病最为相关的6条主通路建立活性成分-关键靶点-核心通路网络图。
1.6分子对接
从成分-靶点-通路网络中选取核心成分及关键靶点。核心成分结构来自有机小分子活性数据库(https://pubchem.ncbi.nlm.nih.gov/,PubChem),通过Chem3D软件对所下载的化合物进行能量最小化格式。蛋白晶体结构来自蛋白质数据库(https://www.rcsb.org/),采用Pymol 2.1软件删除蛋白分子中的无关小分子后,利用AutoDock Tools-1.5.6软件将成分与靶点进行分子对接。使用Lamarckian遗传算法,以150的群体值,最大值2 500万次能量评估,最高次数为2 000次,交叉率0.8,突变率0.02,独立对接运行10次,并根据结合自由能评估最终对接结构。结合自由能越低表示结合效果越好。采用Pymol 2.1软件对结果进行可视化。
2结果
2.1丹参活性成分及“异病同治”关键靶点
共获得丹参有效成分81个,其中,59个分子的对应蛋白从TCMSP数据库直接获得,13个分子潜在靶点通过化合物靶标预测工具(http://www.swiss target prediction.ch/,Swiss Target Prediction)预测获得,9个分子因未找到相应蛋白剔除。最终保留67个有效成分(见表1)及潜在作用靶点423个。获得冠心病相关靶点1 369个,脑卒中相关靶点408个,其中,冠心病与脑卒中疾病共有靶点242个,丹参治疗冠心病与脑卒中“异病同治”的潜在靶点共52个(见图1)。
2.2PPI分析与核心靶点筛选
利用Metascape网站对52个“异病同治”靶点进行蛋白互作分析,共获得50个节点和202条边。将结果导入Cytoscape 3.9.1中,通过MCODE插件对结果进行聚类分析,获得4组类簇(见图2),其中,节点越大表明基因度值(Degree)越大,其重要性越大。以聚类结果基因(见表2)及其他节点中Degree值排名前10位共29个基因作为核心靶点。
2.3核心靶点的GO与KEGG通路富集分析
通过Metascape在线网站进行GO分析,获得BP、CC及MF条目以P值进行排序,取每种类别前6条以气泡图展现(见图3),结果显示,核心靶点主要与平滑肌细胞增殖调控(regulation of smooth muscle cell proliferation)、肽反应(response to peptide)、蛋白质磷酸化正向调控(positive regulation of protein phosphorylation)、细胞迁移正向调控(positive regulation of cell migration)及细胞激活(cell activation)等生物过程相关;主要位于血小板α颗粒(platelet alpha granule)、膜筏(membrane raft)、内质网腔(endoplasmic reticulum lumen)、细胞间隙(cell-cell junction)、复合物受体(receptor complex)等位置;主要与纤连蛋白结合(fibronectin binding)、核心启动子序列特异性结合(core promoter sequence-specific DNA binding)、肿瘤坏死因子受体超家族结合(tumor necrosis factor receptor superfamily binding)、蛋白酶结合(protease binding)、细胞因子受体结合(cytokine receptor binding)、蛋白激酶活性(protein kinase activity)等分子功能相关。
KEGG通路富集结果以P值排序,聚类主通路前20条以柱状图展现(见图4)。结果显示,核心靶点主要富集于白细胞介素4/白细胞介素13(IL4/IL13)信号通路、糖尿病并发症的糖基化终末产物/糖基化终末产物受体(AGE/RAGE)信号通路、癌症、流体剪应力与动脉粥样硬化、TNF信号通路、止血、血管内皮生长因子(VEGF)信号通路等。通过Cytoscape软件将主通路及聚类子通路进行可视化处理(见图5),节点越大代表P值越小,有显著差异。其中糖尿病并发症的AGE/RAGE信号通路与脂质/动脉粥样硬化通路密切相关,止血与黏附斑、血小板激活信号通路密切相关,TNF信号通路与胰岛素抵抗及白细胞介素17(IL17)信号通路密切相关。VEGF与脂肪细胞脂解、Apelin信号通路密切相关。
2.4构建活性成分-核心靶点-核心通路网络
选择与疾病病理最为相关6条主要通路,将通路、通路所包含的核心靶点及靶点对应化合物导入Cytoscape软件,构建活性成分-核心靶点-核心通路网络分析图(见图6)。以通路与靶点连接的Degree评分将核心靶点从左到右按降序排列。根据靶点Degree值、与疾病相关的功能及其在通路中的上下游关系,共筛选出12个基因。包括多信号通路核心靶点AKT1、PIK3CA、MAPK1;血小板活化相关靶点PTGS2、整合素αⅡb(ITGA2B)、ITGB3;细胞凋亡相关靶点Bcl-2、CASP3;血管舒张相关靶点一氧化氮合酶(NOS3,eNOS)、内皮素-1(EDN1);脂质代谢及斑块破裂相关靶点PPARG、MMP9。以化合物与靶点连接的Degree评分将化合物从左至右分为4类,颜色越深、节点越大代表在网络中越重要。共筛选出6个主要活性成分,包括木犀草素(luteolin)、隐丹参酮(cryptotanshinone)、紫草酸(lithospermic acid)、迷迭香酸(rosmarinic acid)、丹参酮ⅡA(tanshinone ⅡA)、丹参新醌D(danshenxinkun D)。该网络反映了丹参主要活性成分对通路的潜在疗效关系。
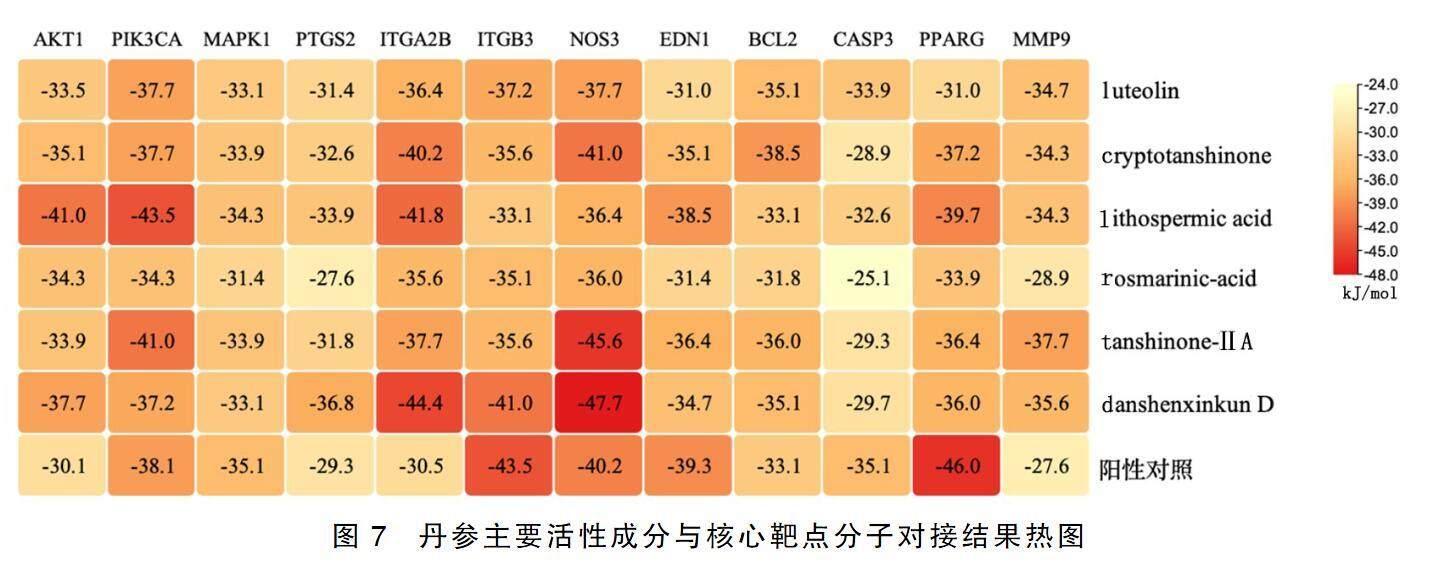
2.5活性成分与核心靶点分子对接
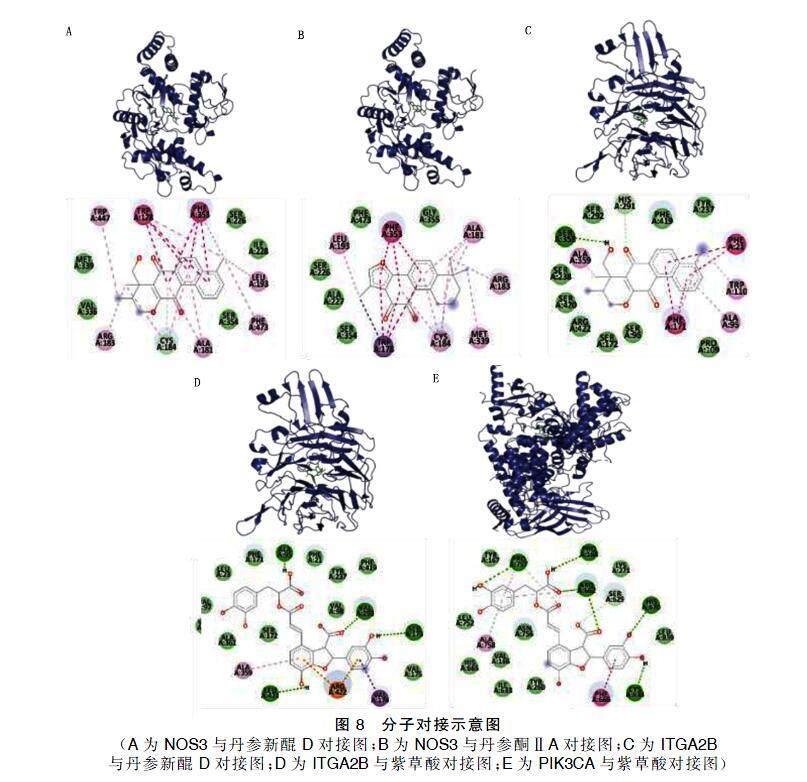
将6种主要活性成分与12个核心靶点进行分子对接,结合能以kJ/mol计算。通过DrugBank数据库检索各靶点相关治疗药物作为分子对接的阳性对照。结合能低于阳性对照表示活性成分与靶点对接稳定,结果如图7所示。6种成分与AKT1、ITGAB2、MMP9结合能均低于阳性对照,结合稳定。隐丹参酮、紫草酸、丹参酮ⅡA、丹参新醌D与PIK3CA、PTGS2、ITGA2B、NOS3、Bcl-2等靶点结合良好,丹参新醌D与整合素β3(ITGB3)结合良好,表明丹参多成分在治疗冠心病与脑卒中“异病同治”的分子机制上具有潜在的多靶点协同作用。取结合能最低的5对组合进行可视化展示。详见图8。
3讨论
“异病同治”是以相同的组方治疗具有相同证型的不同疾病,是体现中医辨证论治的重要治法之一,也是中西医对疾病认知差异的具象表现。阐明异病同治的物质基础及作用机制有助于解释中医证型的科学内涵,对沟通中西医治病理念及推广中医药国际化应用具有重要的意义。冠心病与脑卒中是我国患病率较高的两类心脑血管疾病。统计显示,2021年,我国有脑卒中病人1 300万人,冠心病病人1 139万人[11]。冠心病与脑卒中在中医的病因病机均以气虚血瘀证最为常见[12-13]。丹参作为常用活血化瘀中药在治疗冠心病及脑卒中方面具有明确优势。《本草纲目》提及丹参入心,能破宿血、补新血,破癥除瘕,益气养血。本研究通过网络药理学方法,获得冠心病与脑卒中共同靶点242个,丹参、冠心病与脑卒中共同靶点52个。通路分析结果显示,核心靶标与AGE/RAGE、血小板激活、脂质与动脉粥样硬化、流体剪应力与动脉粥样硬化、VEGF信号通路及炎症通路相有关,其中,AGE与RAGE相互作用会改变细胞基因表达,并增加炎症化合物的流出,导致动脉壁损伤和动脉粥样硬化斑块形成[14]。本结果表明,丹参治疗冠心病与脑卒中“异病同治”潜在方向主要在于治疗动脉粥样硬化,作用机制包括调节血液状态、减少血小板激活、减轻血细胞黏附、减少斑块形成及保护血管内壁,改善急慢性炎症状态等。本研究通过与核心靶点连接Degree值,最终筛选获得丹参6种主要活性成分,包括木犀草素、隐丹参酮、紫草酸、迷迭香酸、丹参酮ⅡA、丹参新醌D,其中,隐丹参酮、丹参酮ⅡA、丹参新醌D属于亲脂活性成分。
分子对接结果还显示,6种成分均与ITGA2B结合稳定,木犀草素、隐丹参酮、紫草酸、丹参酮ⅡA和丹参新醌D均能与PTGS2结合稳定,表明丹参可通过干扰血小板表面受体ITGA2B与ITGB3结合形成整合素αⅡbβ3,以及阻断COX-2生成血栓素A2(TXA2)产生抗血小板活化的潜在作用。研究显示,迷迭香酸可通过抑制还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶/活性氧(ROS)/蛋白激酶C(PKC)-δ通路,抑制整合素αⅡbβ3形成,进而改善β淀粉样蛋白诱导的血小板活化[15]。丹参酮ⅡA可下调血小板糖蛋白4(CD36)与整合素αⅡbβ3表达[16]。研究显示,丹参酮ⅡA与隐丹参酮可体外结合COX-2、5-脂氧合酶、血小板激活因子受体(PAFR)等[17]。隐丹参酮还可调节血栓模型斑马鱼中血小板活化水平及凝血联级[18]。丹参酚酸B是血小板P2Y嘌呤受体12(P2Y12)拮抗剂,可通过抑制磷酸二酯酶(PDE)提高血小板静息状态下环磷酸腺苷(cAMP)浓度,从而降低血小板激活率[19]。因此,丹参多种成分能多靶点协同对抗血小板聚集及血小板黏附。
分子对接结果显示,6种成分均能与AKT1结合稳定,紫草酸与丹参酮ⅡA与PIK3CA结合稳定,隐丹参酮、丹参酮ⅡA、丹参新醌D与NOS3结合稳定。表明丹参可能通过PI3K/AKT通路蛋白作用于eNOS,或直接作用于eNOS,促进一氧化氮(NO)合成,进而发挥抗炎、舒张血管、保护血管内皮细胞,减轻缺血再灌注心肌细胞损伤等作用[20-21]。丹参酮ⅡA、丹参隐酮、木犀草素通过PI3K/AKT/eNOS信号通路保护血管内皮细胞、抗高血压、对抗脑卒中损伤等作用均见报道[22-24]。PI3K/AKT通路、eNOS等均可调节Bcl-2的表达,从而在心肌缺血再灌注损伤或脑卒中恢复期时发挥保护心脑血管细胞的作用[25]。分子对接结果还显示,木犀草素、隐丹参酮、丹参酮ⅡA、丹参新醌D均与Bcl-2结合稳定。研究显示,丹参酮ⅡA可通过激活大麻素受体1(CNR1)/PI3K/AKT通路,下调凋亡调节因子BAX/Bcl-2比例保护大鼠海马神经元[26]。但在癌症组织及癌细胞中,丹参酮ⅡA及隐丹参酮又具有抑制PI3K/AKT/mTOR通路,抑制Bcl-2表达从而诱导癌细胞凋亡的药理作用[27-28]。丹参新醌D可通过逆转阿尔兹海默症特征靶点APP、早老素蛋白(PSEN1)、多巴胺受体D2(DRD2)的转录水平,保护神经细胞功能[29];而PSEN1可通过肽基辅酰胺异构酶8(FKBP38)与Bcl-2结合,以表达水平依赖方式促进Bcl-2从线粒体转移到高尔基体,进而调节线粒体介导的细胞凋亡过程[30]。木犀草素主要通过核红细胞2相关因子(Nrf2)依赖性途径抑制NOD样受体热蛋白结构域相关蛋白3(NLPR3)形成炎症小体,从而抑制神经细胞凋亡与细胞焦亡,该作用可能依赖于PI3K/AKT途径的激活[31-32]。
MMP9是动脉粥样硬化的诊断标志物。巨噬细胞衍生的MMP9能促进单核细胞/巨噬细胞浸润到病变部位中,加剧斑块形成[33],并参与细胞外基质降解,导致纤维帽变薄斑块破裂[34]。核因子κB(NF-κB)的激活介导MMP9及IL-6、TNF-α等炎性因子的转录,丹参酮ⅡA能通过激活PI3K/AKT通路,进而抑制Toll样受体4(TLR4)/NF-κB通路,降低MMP9、IL-6、TNF-α水平,稳定斑块。隐丹参酮也能通过抑制氧化低密度脂蛋白(ox-LDL)诱导内皮细胞中ROS产生和氧化低密度脂蛋白受体1(LOX-1)表达,进而抑制ROS激活NF-κB通路及MMP9、IL-6等标志物的表达[35]。MMP9除了参与斑块破裂还能介导肿瘤细胞迁移及逃逸。迷迭香酸可通过PI3K/AKT/NF-κB通路下调MMP9表达,抑制胶质瘤细胞增殖和迁移,并降低Bcl-2表达,促进凋亡蛋白BAX及CASP3表达增加,从而诱导肿瘤细胞凋亡[36]。
综上所述,丹参治疗冠心病与脑卒中“异病同治”疗效主要在于多成分、多靶点抑制血小板活化和聚集,并通过调控PI3K/AKT/eNOS/Bcl-2通路、PI3K/AKT/NF-κB/MMP9通路发挥抗细胞损伤、保护血管内皮的疗效、稳定斑块、减少炎性因子释放等多种疗效机制作用。本研究通过网络药理学方法进行靶点预测并通过分子对接方法进行验证,从一定程度上阐明了丹参主要成分治疗冠心病与脑卒中“异病同治”的疗效物质基础与作用机制。但网络药理学方法预测结果具有一定局限性,主要是数据库收录的完整性与精准度情况,如TCMSP数据库作为中药网络药理学研究最常用的数据库,存在化学成分命名与结构与信息不符情况或数据库更新不及时导致靶点遗漏;OB值与DL值筛选化合物时常把主要疗效成分排除在外,如丹参主要活性成分丹参酚酸B、丹参酚酸A、紫草酸、迷迭香酸等均属于此列;Swiss Target Prediction预测平台只能预测分子量较小的化学成分,如丹参酚酸B无法进行靶点预测,同时TCMSP中也没有丹参酚酸B的靶点信息,也说明TCMSP数据库中成分的靶点信息主要来源于基于分子结构的靶点预测,并未补充文献报道成分靶点信息。此外,分子对接及文献研究结果发现,丹参多种成分均具有调控多靶点的作用现象,但与靶点直接结合的证据较少,尚需进一步对预测结果进行实验验证。
参考文献:
[1]稳定性冠心病基层合理用药指南[J].中华全科医师杂志,2021,20(4):423-434.
[2]叶颖珊.近十年冠心病心绞痛中医辨证分型与用药规律文献研究分析[D].广州:广州中医药大学,2019.
[3]POWERS W J,RABINSTEIN A A,ACKERSON T,et al.Guidelines for the early management of patients with acute ischemic stroke:2019 update to the 2018 guidelines for the early management of acute ischemic stroke:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2019,50(12):e344-e418.
[4]中华医学会,中华医学会杂志社,中华医学会全科医学分会,等.缺血性卒中基层诊疗指南(2021年)[J].中华全科医师杂志,2021,20(9):927-946.
[5]张莹莹.醒后卒中中医证候及危险因素分布规律的观察研究[D].济南:山东中医药大学,2020.
[6]马丽虹,李冬梅,李可建.系统评价丹参制剂对不同类型卒中的疗效[J].医药导报,2012,31(12):1636-1639.
[7]YU Y A,SPATZ E S,TAN Q,et al.Traditional Chinese medicine use in the treatment of acute heart failure in western medicine hospitals in China:analysis from the China PEACE retrospective heart failure study[J].Journal of the American Heart Association,2019,8(15):e012776.
[8]国家药典委员会.中华人民共和国药典(一部):2020年版[M].北京:中国医药科技出版社,2020:1-5.
[9]MEIM X D,CAO Y F,CHE Y Y,et al.Danshen:a phytochemical and pharmacological overview[J].Chinese Journal of Natural Medicines,2019,17(1):59-80.
[10]LI Z M,XU S W,LIU P Q.Salvia miltiorrhizaburge(Danshen):a golden herbal medicine in cardiovascular therapeutics[J].Acta Pharmacologica Sinica,2018,39(5):802-824.
[11]马文君,马涵萍,王运红,等.《2021年中国心血管病医疗质量报告》概要[J].中国循环杂志,2021,36(11):1041-1064.
[12]张利丹,谢雁鸣,高阳,等.2 558例缺血性脑卒中患者中医证候与体质的相关性[J].中医杂志,2021,62(16):1416-1420.
[13]毕颖斐,王贤良,赵志强,等.冠心病中医证候地域性特征的临床流行病学调查[J].中医杂志,2020,61(5):418-422;461.
[14]SINGH S,SIVA B V,RAVICHANDIRAN V.Advanced glycation end products:key player of the pathogenesis of atherosclerosis[J].Glycoconjugate Journal,2022,39(4):547-563.
[15]LEE B K,JEE H J,JUNG Y S.Aβ1-40-induced platelet adhesion is ameliorated by rosmarinic acid through inhibition of NADPH oxidase/PKC-δ/integrin αⅡbβ3 signaling[J].Antioxidants,2021,10(11):1671.
[16]WANG H,ZHONG L,MI S H,et al.Tanshinone ⅡA prevents platelet activation and down-regulates CD36 and MKK4/JNK2 signaling pathway[J].BMC Cardiovasc Disord,2020,20(1):81.
[17]SAVIANO A,DE VITA S,CHINI M G,et al.In silico,in vitro,and in vivo analysis of tanshinone ⅡA and cryptotanshinone from Salvia miltiorrhiza as modulators of cyclooxygenase-2/mPGES-1/endothelial prostaglandin EP3 pathway[J].Biomolecules,2022,12(1):99.
[18]LI J,LIU H,YANG Z Z,et al.Synergistic effects of cryptotanshinone and senkyunolide I in Guanxinning tablet against endogenous thrombus formation in zebrafish[J].Frontiers in Pharmacology,2021,11:622787.
[19]LIU L,LI J,ZHANG Y,et al.Salvianolic acid B inhibits platelets as a P2Y12 antagonist and PDE inhibitor:evidence from clinic to laboratory[J].Thrombosis Research,2014,134(4):866-876.
[20]LING Y,SHI J J,MA Q X,et al.Vasodilatory effect of Guanxinning tablet on rabbit thoracic aorta is modulated by both endothelium-dependent and-independent mechanism[J].Frontiers in Pharmacology,2021,12:754527.
[21]ZHU J Q,SONG W S,XU S X,et al.Shenfu injection promotes vasodilation by enhancing eNOS activity through the PI3K/Akt signaling pathway in vitro[J].Frontiers in Pharmacology,2020,11:121.
[22]WANG J Y,HE X Y,CHEN W N,et al.Tanshinone ⅡA protects mice against atherosclerotic injury by activating the TGF-β/PI3K/Akt/eNOS pathway[J].Coronary Artery Disease,2020,31(4):385-392.
[23]ZHU W X,QIU W H,LU A L.Cryptotanshinone exhibits therapeutical effects on cerebral stroke through the PI3K/AKT-eNOS signaling pathway[J].Molecular Medicine Reports,2017,16(6):9361-9366.
[24]JI L,SU S S,XIN M Y,et al.Luteolin ameliorates hypoxia-induced pulmonary hypertension via regulating HIF-2α-Arg-NO axis and PI3K-AKT-eNOS-NO signaling pathway[J].Phytomedicine,2022,104:154329.
[25]KORSHUNOVA A Y,BLAGONRAVOV M L,NEBORAK E V,et al.Bcl-2-regulated apoptotic process in myocardial ischemia-reperfusion injury(review)[J].International Journal of Molecular Medicine,2021,47(1):23-36.
[26]LI Z W,CHENG L,WEN C,et al.Activation of CNR1/PI3K/AKT pathway by tanshinone ⅡA protects hippocampal neurons and ameliorates sleep deprivation-induced cognitive dysfunction in rats[J].Frontiers in Pharmacology,2022,13:823732.
[27]LIU H Y,LIU C Y,WANG M Y,et al.Tanshinone ⅡA affects the malignant growth of Cholangiocarcinoma cells by inhibiting the PI3K-Akt-mTOR pathway[J].Scientific Reports,2021,11(1):19268.
[28]LUO Y,SONG L,WANG X Y,et al.Uncovering the mechanisms of cryptotanshinone as a therapeutic agent against hepatocellular carcinoma[J].Frontiers in Pharmacology,2020,11:1264.
[29]LI B,WU Y R,LI L,et al.A novel based-network strategy to identify phytochemicals from Radix salviae miltiorrhizae(Danshen) for treating Alzheimer′s disease[J].Molecules,2022,27(14):4463.
[30]WANG H Q,NAKAYA Y,DU Z Y,et al.Interaction of presenilins with FKBP38 promotes apoptosis by reducing mitochondrial Bcl-2[J].Human Molecular Genetics,2005,14(13):1889-1902.
[31]ZHANG Z H,LIU J Q,HU C D,et al.Luteolin confers cerebroprotection after subarachnoid hemorrhage by suppression of NLPR3 inflammasome activation through Nrf2-dependent pathway[J].Oxidative Medicine and Cellular Longevity,2021,2021:1-18.
[32]BAIYUN R Q,LI S Y,LIU B Y,et al.Luteolin-mediated PI3K/AKT/Nrf2 signaling pathway ameliorates inorganic mercury-induced cardiac injury[J].Ecotoxicology and Environmental Safety,2018,161:655-661.
[33]CHEN Y J,WAQAR A B,NISHIJIMA K,et al.Macrophage-derived MMP-9 enhances the progression of atherosclerotic lesions and vascular calcification in transgenic rabbits[J].Journal of Cellular and Molecular Medicine,2020,24(7):4261-4274.
[34]GU C,WANG F,ZHAO Z W,et al.Lysophosphatidic acid is associated with atherosclerotic plaque instability by regulating NF-κB dependent matrix metalloproteinase-9 expression via LPA2 in macrophages[J].Frontiers in Physiology,2017,8:266.
[35]LIU Z P,XU S W,HUANG X Y,et al.Cryptotanshinone,an orally bioactive herbal compound from Danshen,attenuates atherosclerosis in apolipoprotein E-deficient mice:role of lectin-like oxidized LDL receptor-1(LOX-1)[J].British Journal of Pharmacology,2015,172(23):5661-5675.
[36]LIU Y S,XU X P,TANG H,et al.Rosmarinic acid inhibits cell proliferation,migration,and invasion and induces apoptosis in human glioma cells[J].International Journal of Molecular Medicine,2021,47(5):67.
(收稿日期:2023-01-18)
(本文编辑邹丽)
