Noria-PEI改性PVA载体固定化溶菌酶用于污泥发酵产VFAs研究
2024-04-27王昊龙张恩泽王梓诚赵瑜涵南军孙彦民马爱静周立山刘丽强蔡巷段兴宇
王昊龙,张恩泽,王梓诚,赵瑜涵,南军,孙彦民,马爱静,周立山,刘丽强,蔡巷,段兴宇
(1.中海油天津化工研究设计院有限公司,天津300131;2.天津工业大学化学工程与技术学院,分离膜与膜过程国家重点实验室,天津300387;3.河北工业大学化工学院,天津 300401)
我国污水处理厂普遍采用活性污泥法处理城镇污水,活性污泥法利用微生物的代谢繁殖去除水中污染物,在此过程中必然产生大量剩余污泥。据统计,我国剩余污泥的复合增长率约为5%,预计2025年剩余污泥(含水率80%)总量将突破9 000万t〔1〕。剩余污泥含有蛋白质、多糖、腐殖酸等有机物,同时还含有重金属、病原体等有害物质,具有“污染”和“资源”双重属性,对剩余污泥进行妥善处置可实现污水处理过程“碳达峰、碳中和”的重要任务〔2〕。
厌氧消化是目前主流工艺中实现污泥碳回收的主要方式,包括水解、发酵酸化、产氢产乙酸和甲烷化4个阶段,而微生物细胞破碎与胞外聚合物(EPS)水解是厌氧消化的限制步骤〔3〕。由于剩余污泥组分复杂,可生化性差,导致厌氧消化产甲烷率低且停留时间长(15~30 d),若对污泥进行预处理,控制反应至产挥发性脂肪酸(VFAs)阶段,既可显著缩短反应时间,又可实现有机碳的高价值回收,成为污泥厌氧消化研究的热点〔4〕。污泥预处理包括水热法、超声微波机械法、高级氧化法、化学药剂法等,相比而言,利用微生物或特定酶提高水解效率,因其温和、环保、高效和不产生有毒副作用等特点而备受青睐〔5-8〕。
溶菌酶又称N-乙酰胞壁质聚糖水解酶,是一种具有溶解微生物细胞壁功能酶类的统称,目前工业溶菌酶多为蛋清溶菌酶,由129个氨基酸组成的单肽链蛋白质。溶菌酶可高效降解由肽聚糖和糖脂类物质组成的细胞壁,促进微生物胞内有机质溶出〔9〕。Gaige LIU等〔10〕进行了溶菌酶强化剩余污泥水解性能研究,结果表明,逐步提高溶菌酶的剂量(单位质量SS中溶菌酶质量从0到150 mg/g),总EPS中多糖质量浓度由84.6 mg/L增至143.2 mg/L,蛋白质质量浓度由325.0 mg/L增至987.7 mg/L,水解效能提升显著。Xiuqin CAO等〔11〕报道了水热和溶菌酶共预处理可促进污泥厌氧发酵,结果显示相比于未预处理污泥,最大可溶性生化需氧量(SCOD)和产气量分别提升95.89%和130.58%。溶菌酶虽然具有高催化活性、良好选择性及水溶性,然而,其工业化应用仍受到回收困难和催化稳定性差等限制。为此研究者提出采用固定化技术解决上述问题,通过吸附法、包埋法或交联法将酶固定在支撑材料上,支撑材料包括聚合物基质、多孔材料、碳纳米材料、金属有机框架(MOFs)、磁性材料等〔12-16〕。聚乙烯醇(PVA)价格低廉、机械强度高、可定制化成型,被广泛用做生物载体,已商业化应用于生物菌剂固定〔17〕,但其固定酶的能力较差,在生物酶固定化领域研究较少,通过引入含氧基团、氨基及构建网状结构可有效提高PVA的固载酶能力和酶的稳定性〔18〕。水轮酚(Noria)是一种梯状连接的双环低聚物,具有多个亲水性酚羟基官能团,同时其内部的空腔近似立体圆柱状,聚乙烯亚胺(PEI)具有丰富的伯仲叔胺基团,Noria和PEI的反应产物具良好的生物酶相容性〔19-20〕。
因此,本研究采用Noria-PEI共沉积法对PVA载体进行改性,以提高其固定溶菌酶能力,对比分析了游离酶、固定酶对剩余污泥厌氧发酵产酸的效果;并对发酵系统中剩余污泥的粒径分布和微生物菌落进行分析,以揭示固定化酶促进剩余污泥发酵产酸机理。
1 材料与方法
1.1 实验材料
实验用剩余污泥取自天津市某污水处理厂二沉池,污泥取回后静置48 h,将弃去上清液后的污泥作为实验用剩余污泥,其性质如下:pH为7.18±0.16,TSS为(7 124±458) mg/L,VSS为(4 516±296) mg/L,TCOD为(6 185±355) mg/L,SCOD为(103±12) mg/L。实验所用溶菌酶购自河北某生物技术有限公司,酶活性2 000 U/g,适宜pH 5.5~8.5,适宜温度30~55 ℃。
聚乙烯亚胺(M.W. 70 000,50%水溶液)购自上海阿拉丁生化科技股份有限公司,间苯二酚(AR)和戊二醛50%(AR)购自天津市大茂化学试剂厂,2-(N-吗啉)乙磺酸(MES,99%)购自美国Sigma-Aldrich公司。
1.2 实验方法
1.2.1 Noria的合成
H. KUDO等〔21〕首次用一锅法以高收率合成了Noria,本研究参考该方案制备Noria。在四口圆底烧瓶中加入22 g间苯二酚,接着注入45 mL无水乙醇,搅拌,继而加入30 mL浓盐酸,并缓慢滴入5 g戊二醛。将混合物升温至80 ℃,经过48 h反应后,将体系冷却至室温,注入150 mL甲醇使产物析出沉淀(12 h)。随后进行过滤,在60 ℃真空条件下干燥12 h去除多余溶剂,获得亮黄色Noria产物。具体合成的化学反应如图1所示。

图1 Noria合成反应Fig.1 The synthesis of Noria
1.2.2 Noria-PEI改性PVA载体制备及溶菌酶固载
在10 mL去离子水中加入3 g PEI将其溶解。将1 g Noria碾碎成小颗粒,随后将Noria颗粒加入NaOH(0.28 mol/L)溶液中溶解,并在持续搅拌下加入PEI溶液,制备Noria-PEI浸渍改性溶液。随后直接将PVA载体材料浸入Noria-PEI溶液中改性5 min,使用去离子水多次冲洗后于60 ℃真空干燥备用,记作mPVA。
称取0.1 g mPVA载体,置于15.0 mL pH=6.2的MES缓冲溶液中活化30 min,用去离子水清洗后加入到15 mL质量浓度为1 g/L溶菌酶溶液中,4 ℃下振荡12 h,得到固定化溶菌酶。利用Bandford方法测定溶菌酶的固定化量,计算如式(1)所示。本研究中改性PVA的酶固载量为(74.3±0.1) mg/g,作为对比,未改性PVA的酶固载量为(20.8±0.3) mg/g。
式中:w——溶菌酶固定化量,mg/g;
m1——溶菌酶的初始质量,mg;
m2——聚乙烯醇载体的质量,g;
C——待测上清液中溶菌酶的质量浓度,mg/L;
V——待测上清液总体积,L。
1.2.3 剩余污泥厌氧发酵产酸
将实验用剩余污泥加至3个相同的反应器中,未投加酶的反应器为空白组,另外两个反应器中分别按照污泥VSS的1%(质量分数)投加游离酶和固定酶,充入足量氮气,维持温度(35±1) ℃和搅拌(120±10) r/min的条件下进行厌氧消化,定期取样分析。
1.3 测试方法
1.3.1 Noria和改性PVA载体表征
对合成的Noria单体用红外光谱仪(FT-IR,德国Bruker公司,Vertex7.0)分析其化学组成,并采用X衍射分析仪(XRD,荷兰PANalytical公司,X’Pert PRO)分析其晶体结构,最后取痕量Noria颗粒溶解于二甲基亚砜-d6(DMSO-d6)中对其进行液体核磁共振氢谱(1H NMR,德国Bruker公司,AV500)测试。用X射线光电子能谱仪(XPS,美国Thermo Fisher公司,Escalab 250Xi)分别对改性前后PVA载体表面化学组成变化进行分析。
1.3.2 厌氧消化产物的测定
SCOD采用哈希试剂法进行测定,可溶性蛋白含量采用Lowry-Folin法以牛血清蛋白为标准物质检测,多糖浓度采用苯酚-硫酸分光光度法测定,VFAs采用气相色谱法(Agilent,7890A)进行测定,具体步骤参考文献〔22〕,污泥粒径采用激光粒度仪测定(MASTERSIZER 2000,Malvern,英国),每个样品平行测定3次。
1.3.3 微生物分析
使用快速DNASPIN试剂盒(MPBiomedicals,SantaAna,CA,USA)提取污泥DNA,用真/古细菌兼容通用前端引物341F(5’-CCTACGGGRBGCAGCAG-3’)和后端806R(5’-GGACTACHVGGGTATC TA-3’)对细菌16S rRNA基因的V3~V4区进行PCR扩增,采用Illumina公司的Miseq PE300/NovaSeq PE 250进行测序。
2 结果与讨论
2.1 Noria-PEI改性PVA载体表征
2.1.1 Noira单体的表征
为验证Noria单体的合成,对合成产物进行了FT-IR、XRD和1H NMR表征,见图2。
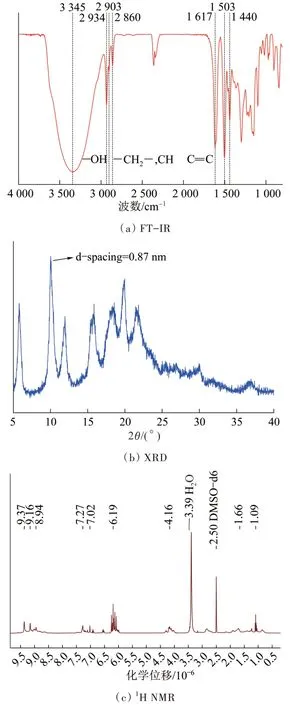
图2 Noria的FT-IR、XRD及1H NMRFig.2 FT-IR,XRD and 1H NMR of Noria
由图2(a)可以看出,图中1 617、1 503、1 440 cm-1处的吸收峰为苯环上C= = C的伸缩振动峰,2 934 cm-1和2 860 cm-1的吸收峰对应于—CH2—,2 903 cm-1处的吸收峰则对应C—H键的伸缩振动峰,3 345 cm-1处较强的峰来自于Noria的24个—OH吸收振动〔23〕。
Noria单体的XRD如图2(b)所示,在2θ=10.1°出现了一较强的衍射峰,正对应Noria分子的内部空腔,与化学结构式相对应。
由图2(c)可知,Noira的1H NMR主要化学位移归属如下:δ=(1.09~1.66)×10-6(—CH2CH2CH2—),δ=4.16×10-6(>CH—),δ=6.19×10-6(Ar—H),δ=(8.94~9.37)×10-6(—OH),以上结果对照文献〔23〕可知Noria被成功合成。
2.1.2 Noria-PEI浸渍PVA载体变化
采用XPS对改性前后的PVA载体进行表面化学组成分析,结果如图3所示。

图3 PVA、mPVA的XPS(a)和mPVA的N 1 s分峰谱(b)Fig.3 XPS of PVA and mPVA (a) and N 1 s core-level of mPVA (b)
由图3可以看出,Noria-PEI成功负载使mPVA载体的XPS能谱曲线在396 eV处出现了N 1s峰。此外,对mPVA载体的N元素进行分峰如图3(b),出现分别来自于PEI内部的C—N单键和Noria-PEI发生席夫碱反应生成的C= = N双键〔24〕的两个峰,印证了Noria-PEI在PVA上的共沉积。
如图4所示,左为原始PVA载体,右为改性后的mPVA载体。可以显著观察到载体表面颜色由白色变为黄棕色。

图4 原始PVA载体和改性后的mPVA载体Fig.4 Original PVA carrier and modified mPVA carrier
2.2 剩余污泥水解效能分析
剩余污泥溶胞水解过程中微生物的有机质被降解成可溶性有机物,图5以SCOD质量浓度随时间的变化来反映剩余污泥厌氧消化降解程度。
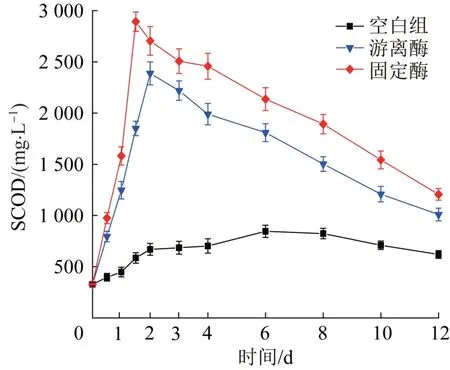
图5 各系统中SCOD随时间变化Fig.5 The variation of SCOD with time in each system
由图5可知,各组SCOD在12 d内均呈现先升高后降低的趋势,但是最高SCOD质量浓度差异较大,游离酶和固定酶的最高SCOD质量浓度分别为2 387.5 mg/L和2 892.4 mg/L,是空白组(845.4 mg/L)的2.8倍和3.4倍,结果表明溶菌酶可显著提高污泥絮凝体的瓦解和微生物细胞的水解,促使有机质溶出并被降解为小分子可溶性有机物,固定酶对剩余污泥中有机质的水解有更好的效果。此外,空白组、游离酶组和固定酶组获得最高SCOD质量浓度的时间也同样有所差距,分别为6 d、48 h和36 h,且在初期发酵的24 h内,游离酶和固定酶的发酵系统表现出了快速水解过程。生物酶作为催化中心,可与有机质通过特定化学键形成过渡态,从而降低反应活化能,促进有机质的水解。固定酶因在Noria-PEI改性PVA载体材料的网状结构保护下,能在厌氧环境中保持比游离酶更高的催化活性,而游离酶自身的蛋白质结构在长期发酵过程中易变性失活。与本研究相似,Juanjuan WAN等〔25〕对比了以Fe3O4@SiO2-NH2为载体的固定酶和游离酶对污泥厌氧发酵溶出有机质的影响,结果表明,固定酶系统中SCOD的最高浓度〔(5.04±0.02) g/L,第8小时〕大于游离酶系统〔(3.45±0.04) g/L,第64小时〕,且发酵时间显著缩短。Qinxue YANG等〔18〕制备了氧化石墨烯聚乙烯醇水凝胶(GO@PVA-H)用于固载过氧化物酶,GO@PVA-H的笼状三维网络结构很好地保护了固载酶,使其表现出优于游离酶的稳定性和高效性。随着发酵的进行,SCOD的浓度逐渐降低,这是由于微生物自身代谢消耗部分溶解性有机物。
胞外聚合物(EPS)及溶解态微生物代谢产物主要由多糖化合物和蛋白质组成,两者之和占剩余污泥VSS总量的90%以上〔26〕。图6为厌氧消化过程中多糖和蛋白质的变化。

图6 各系统中多糖(a)和蛋白质(b)浓度随时间变化情况Fig.6 The variation of polysaccharide (a) and protein (b)with time in each system
由图6可以看出,厌氧消化12 d内,空白组、游离酶组、固定酶组上清液中多糖最高质量浓度分别为42.6、111.2、131.4 mg/L,蛋白质最高质量浓度分别为100.5、259.0、359.3 mg/L,游离酶组、固定酶组中多糖和蛋白质均分别在48 h和36 h达到峰值,与SCOD的变化相似,说明大部分的溶出SCOD是由多糖和蛋白质的溶出所贡献。溶菌酶能打破细胞壁中N-乙酰胞壁酸和N-乙酰氨基葡糖间的β-1,4糖苷键,从而导致微生物细胞壁破裂〔27〕。同样,以固定酶系统为例,在24 h的发酵时间内,多糖化合物和蛋白质快速升高,分别由19.7 mg/L上升至78.6 mg/L和由45.7 mg/L上升至258.3 mg/L。上清液中蛋白质的质量浓度显著高于多糖类物质,说明溶解态蛋白质是剩余污泥厌氧发酵基质的主要贡献者。
2.3 剩余污泥发酵产VFAs变化
在污泥发酵酸化阶段,氨基酸和葡萄糖等水解产物转化为挥发性脂肪酸(VFAs),VFAs的生成速率受底物浓度、功能微生物和传质效率的影响。空白组、游离酶组和固定酶组中VFAs质量浓度在发酵酸化阶段随时间变化情况见图7。
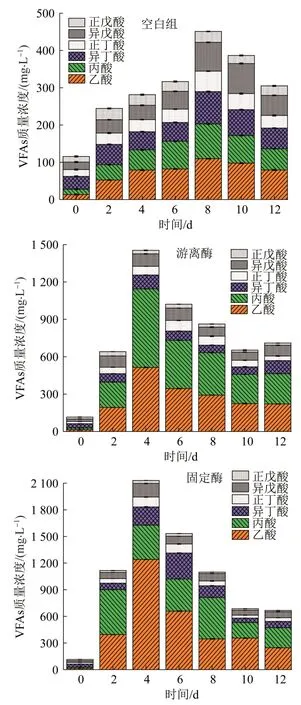
图7 各系统中VFAs质量浓度随时间变化Fig.7 The variation of VFAs with time in each system
由图7可知,游离酶组和固定酶组的VFAs峰值均出现在第4天,而空白组的VFAs峰值出现在第8天,空白组、游离酶组、固定酶组的VFAs最高值分别为451.1、1 453.6、2 130.8 mg/L。溶菌酶的存在促使微生物内物质更易溶出,同时由于固定酶载体错综复杂的内部结构及其亲水性特征,使得有机物的传质阻力大幅降低,进而提高了污泥发酵产酸效率和产酸量。VFAs质量浓度达到峰值后随时间增加逐渐下降,这是由于VFAs为产甲烷菌便于利用的底物,实验过程中也检测到有气体产生。据报道,使用混合酶提高污泥降解能力,发酵15 d后VFAs的累积量(以COD计)达到最大值3 400 mg/L〔28〕,而本研究固定酶系统中VFAs最大质量浓度出现在第4天。
在整个发酵过程中,乙酸、丙酸主要由液相中蛋白质和多糖化合物发酵获得,较长链的脂肪酸(如戊酸)主要来自于蛋白质发酵〔29〕。由图7可知,空白组中乙酸和丙酸为总VFAs的38.3%~49.5%,而经生物酶调控后,乙酸和丙酸为总VFAs的主要组成部分,占据总VFAs的61.8%~80.7%。对于固定酶,在第4天产酸量最高时,乙酸占总VFAs的58.2%,占比高于游离酶组和空白组,丙酸占总VFAs的18.1%。由以上结果可知,固定酶系统发酵过程更为彻底,其他VFAs易于被厌氧微生物降解为乙酸,在促进剩余污泥发酵产SCOD、VFAs和小分子VFAs,固定酶的效果均为最好。
2.4 固定酶促污泥产酸机理分析
2.4.1 污泥粒径分布
污泥粒径分布常被作为指标参数用以表征剩余污泥的水解程度,一般认为污泥平均粒径越小,污泥厌氧消化越容易进行。空白组在第8天的粒径及游离酶组和固定酶组在第4天(对应最高产酸时间)的粒径分布见图8。

图8 污泥粒径分布Fig.8 Particle size distribution of sludge
由图8可知,空白组、游离酶组、固定酶组系统中污泥的平均粒径(D50)分别为81.026、45.016、42.957 µm,比表面积分别为0.279、0.394、0.413 m2/g。从微观层面看,固定酶组将污泥絮体解离更为彻底,污泥粒径减小和比表面积的增加会增大厌氧微生物与有机物的接触反应几率,从而强化污泥发酵产酸。
2.4.2 微生物群落
为表征微生物在不同发酵系统中组成和分布变化,解释生物酶促污泥发酵产VFAs机理,对最高产VFAs时的微生物群落进行了16s rRNA测序,各发酵系统微生物在门水平上的丰度见图9。

图9 前20位微生物群落菌门Fig.9 Top 20 phyla of microbial communities
由图9可以看出,投加游离酶组和固定酶组的污泥中微生物组成与空白组有明显区别。空白组中变形菌门(Proteobacteria)相对丰度最高,为总序列的42.6%,其他菌门的相对丰度均小于10%,物种分布较为均匀。在固定酶组中,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroides)的相对丰度分别为29.5%、16.1%和45.6%,占总序列的91.2%。在游离酶组中,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)占总序列的86.9%,而拟杆菌门(Bacteroides)的相对丰度仅为3.12%。变形菌门(Proteobacteria)在污泥消化过程中消耗以乙酸、丙酸为主的挥发性脂肪酸〔30〕,在空白组中变形菌门(Proteobacteria)丰度的绝对优势表明VFAs的积累能力差,大部分VFAs被消耗,与实验结果相一致。厚壁菌门(Firmicutes)中的大多数微生物与蛋白质、纤维素等复杂有机物的降解和胞外酶活性有关,是降解复杂有机物的主要菌门〔31〕,拟杆菌门(Bacteroides)能够产生纤维素酶、蛋白酶等水解酶,使污泥中的复杂碳水化合物初步分解为可溶性物质〔32〕,游离酶组和固定酶组中微生物在拟杆菌门(Bacteroides)的差异可能是由于固定酶能保持较高的酶活性,自身具有降解复杂有机物的能力。
在属水平上,各发酵系统微生物群落分布也有明显差异,见图10。
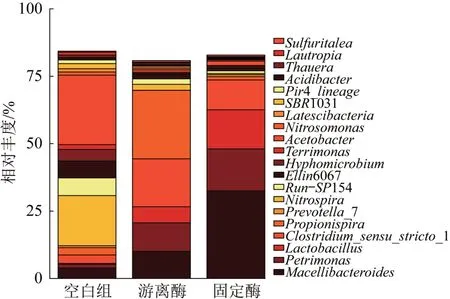
图10 前20位微生物群落菌属Fig.10 Top 20 genera of microbial communities
由图10可知,对照空白组,固定酶组屠场杆状菌属(Macellibacteroides)相对丰度由3.9%提升至32.5%,屠场杆状菌属(Macellibacteroides)是拟杆菌门的一种,具有将葡萄糖等多碳有机物降解为乙酸、正丁酸和异丁酸的能力;Petrimonas菌属的相对丰度为15.6%,在厌氧消化过程中具有协同代谢能力,既可以直接传递电子,又具有代谢有机底物产乙酸的功能〔33〕;乳杆菌属(Lactobacillus)和严格梭菌属(Clostridium_sensu_stricto_1)能代谢多糖化合物和蛋白质转化为脂肪酸〔34〕。游离酶组中,除屠场杆状菌属(Macellibacteroides)和严格梭菌属(Clostridium_sensu_stricto_1)的相对丰度较高外,丙酸螺菌属(Propionispira)的相对丰度为25.4%,丙酸螺菌属(Propionispira)为一种水解产酸菌,可以将多糖类氧化为乙酸、丙酸等VFAs〔35〕。可见生物酶的投加可强化系统中厌氧消化菌属的相对丰度,从而改善厌氧发酵底物环境,促进剩余污泥水解产酸过程。
3 结论
1)采用Noria和PEI共沉积法改性PVA载体,FT-IR、XRD和1H NMR表征证实了Noria的成功合成,XPS印证了Noria-PEI改性PVA使载体具有更丰富的官能团结构。
2)Noria-PEI改性PVA固定化溶菌酶可强化污泥发酵产SCOD,固定酶系统在36 h内SCOD达到最高质量浓度2 892.4 mg/L,相比空白组提升3.4倍(第6天),上清液中多糖和蛋白质的变化与SCOD相似,且蛋白质质量浓度明显高于多糖类物质。
3)固定酶系统中VFAs质量浓度在第4天达到峰值2 130.8 mg/L,高于游离酶系统(1 453.6 mg/L)和空白组(451.1 mg/L),VFAs组分中乙酸和丙酸的占比达到61.8%~80.7%。
4)固定酶系统中污泥的平均粒径为42.957 µm,比表面积为0.413 m2/g,表明固定酶强化了颗粒态污泥水解。在固定酶系统中,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroides)等水解产酸菌门占比较高;在属水平上,以屠场杆状菌属(Macellibacteroides)、Petrimonas菌属、乳杆菌属(Lactobacillus)和严格梭菌属(Clostridium_sensu_stricto_1)为主。
