基于深度学习的直肠癌术后容积旋转调强放疗三维剂量预测研究
2024-04-26刘润红刘可黄强徐孝明许惠
刘润红,刘可,黄强,徐孝明,许惠
1. 内江市第二人民医院 放疗科,四川 内江 641000;2. 自贡市第一人民医院 肿瘤科,四川 自贡 643000;3. 内江市第六人民医院 放射科,四川 内江 641000
引言
直肠癌是我国常见的恶性肿瘤之一[1],近年来其发病率呈上升趋势。容积旋转调强放射治疗(Volumetric Modulated Arc Therapy,VMAT)可使肿瘤靶区和邻近重要组织分别接受不同的剂量照射,目前已越来越广泛地应用于临床[2]。在直肠癌放射治疗过程中,放疗物理师需要花很长的时间来优化计划系统上的放疗剂量,反复尝试,直到满足临床需求为止。这个过程费时费力,且非常依赖物理师的工作经验[3]。因此,放疗剂量的准确预测对放疗质量控制来说至关重要。近年来,深度学习被广泛应用于放疗工作的研究中,如靶区及器官勾画[4]、自动计划[5]、图像配准[6]、放疗剂量预测[7]。国内外关于剂量预测的模型已有诸多报道[8-10],郑平等[8]预测了宫颈癌共面调强放射治疗膀胱、直肠受量,发现其准确度较高;Osman 等[9]提出了一种基于先验知识(Knowledge-Based Planning,KBP)的模型,该模型使用注意门控机制和3D-UNet来预测头颈部肿瘤的3D 剂量分布,模型的总体预测性能优于传统的UNet;Chen 等[10]利用深度学习提出了一种基于DVHnet 的网络预测剂量体积直方图(Dose-Volume Histogram,DVH),并将其与商用的软件进行对比,发现使用DVHnet 预测的所有危及器官(Organs at Risk,OARs)剂量的平均差异为(0.30±0.95)Gy,但该基于KBP 的方法无法预测真实的三维空间体素级的剂量大小。因此,本研究以直肠癌为例,提出了一种基于3DRes-UNet 的深度学习方法,通过提取CT 图像的特征及OARs 和靶区标签,建立三维空间的剂量预测模型,用于指导临床放疗工作。
1 资料和方法
1.1 临床资料
选取既往在内江市第二人民医院放疗中心治疗的168 例直肠癌术后患者为研究对象,年龄为40~78 岁(中位年龄58 岁)。所有患者此前均未接受过放疗,无放疗禁忌证。其中,处方剂量为50 Gy/25 F。使用热塑膜及专用碳纤维板和头枕固定患者,并使其在荷兰Philips 大孔径CT 模拟定位机下行增强扫描,CT 扫描层厚为5 mm,扫描范围为肾脏下缘顶到股骨中段。研究已经本院伦理委员会审批通过(批准文号:2024RP-328-04)。
1.2 计划设计
在Monaco 5.11 放疗计划工作站进行靶区勾画。参照国际辐射单位与测量委员会(ICRU)83 号报告,由临床医生勾画直肠癌术后盆腔的临床靶区(Clinical Target Volume,CTV),由CTV 外放8~10 mm 获得计划靶区(Planning Target Volume,PTV),勾画膀胱、小肠、左右股骨头、骨盆等的OARs。在Monaco 计划系统和瑞典Elekta Synergy 加速器上对每位患者制定VMAT 计划。射线能量大小均为6 MV X 射线,射野等中心位置相同,剂量率统一为600 MU/min。所有计划均为2 个全弧(一个为181°~179°,另一个为179°~181°)。限制条件为:95%靶区体积达到100%处方剂量,靶区剂量最大值高于110%的处方剂量体积不超过1%。
1.3 数据预处理
从计划系统上导出既往已治疗批准的放疗计划文件,包括计划文件、CT 影像文件等医学数字成像和传输协议(Digital Imaging and Communications in Medicine,DICOM)格式的数据。由于不同医生的命名方式不同,首先批量修改结构名,使结构名称保持一致。影像经过窗宽窗位调整,去噪处理得到满意的CT 数据。用本研究团队开发的程序分析提取PTV 和OARs 的标签(mask),预处理流程图如图1 所示。第三方库是Python3.8 的dicom2nifti、SimpleITK、Pydicom 等, 将DICOM 格式的数据转化为“nii”图像格式。为了方便深度学习网络训练,需将图片统一规格。图片尺寸统一重采样为128×128×128 大小,空间体素统一采样为3 mm×3 mm×3 mm。将OARs 膀胱、左股骨头、右股骨头、小肠、骨盆的标签依次赋1、2、3、4、5,赋PTV 的标签为50。将CT 影像、OARs、PTV 输入网络,在模型输出时与真正的剂量图(ground truth)通过损失函数、梯度反馈、清零等操作实现OARs 及PTV 在CT影像上接近真实临床分布的状态。经过若干训练后,最终以128×128×128×1 的大小生成一个“Dose.nii.gz”文件,实现VMAT 剂量的输出。
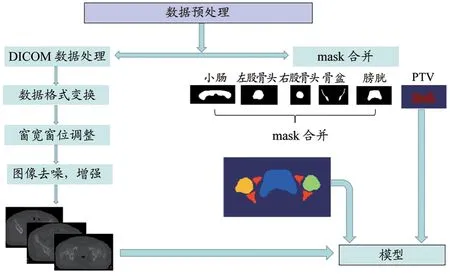
图1 数据预处理流程图
1.4 3DRes-UNet模型的构建
基于传统的3DUNet,在编码器Encoder 部分使用ResNet 网络提取主干特征,采用3×3×3 的卷积核及经过非线性激活函数(ReLU)层和正则化(BN)层增加模型的非线性表达能力,同时保证了感受野的相同,防止训练过程中出现过拟合或梯度爆炸现象。下采样过程提取CT 影像、OARs 和PTV 及VMAT 全弧的360°射束信息。
编码区由Encoder 模块组成,每个Encoder 模块均有一个残差块,残差块包括2 个卷积层,卷积核大小均为3×3×3,每一层的下采样大小均为3×3×3、步长均为2×2×2、Padding 为1 的Maxpool 卷积操作。解码器部分与经典UNet 网络的解码器一致(图2)。解码区负责实现三维特征到剂量分布的回归拟合。上采样过程是4 层转置卷积过程,其中每个模块包含一个3×3×3 的卷积层,卷积核大小分别为3×3×3、步长为2×2×2,所有转置卷积层均进行激活函数操作。将168 例患者随机划分为训练集120 例、验证集16 例和测试集32 例。将训练集的CT 影像和OARs 及靶区的掩码2×3×128×128×128(2 为Batch_size 数量,3 为numpy 的concatenate 函数合成的PTV、OAR、CT 三通道数,128×128×128 为每个结构的尺度)输入网络进行训练,输出维度为1×128×128×128。每隔一个Epoch 验证一次,保存模型最好的权值文件。损失函数为平均绝对误差(Mean Absolute Error,MAE),采用Adam 优化算法;学习率下降策略采用余弦退火方式;数据增强的方式有随机翻转、旋转和平移,每个卷积层的卷积核数量依次为16、32、64、128、256,其他参数如表1 所示。在测试集上将预测的剂量与临床批准的放疗剂量进行对比,评价放疗剂量的预测精度。选用的深度学习框架为PyTorch 1.9 和Python 3.9。

表1 网络相关参数
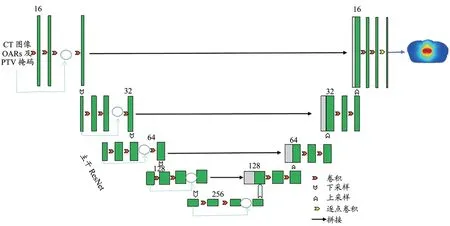
图2 3DRes-UNet剂量预测网络
1.5 评价指标
靶区的评价参数为D2、D98、Dmean、均匀性指数(Homogeneity Index,HI)。其中,HI 值越接近0,表明靶区的均匀性越好;适形性指数(Conformity Index,CI)越接近1,说明靶区的适形性越好。OARs 的评价指标为膀胱V40、V50、Dmean,左右股骨头V30、V40、V50、Dmean,骨盆V15、V25、V35、V45、Dmean,小肠V30、V40、Dmean、D0.1cc。采用相对误差评价预测值与临床剂量的差异,剂量差异为临床剂量与预测剂量的差值。
1.6 统计学分析
采用IBM SPSS 22.0 对实际值和预测值进行统计学分析,若符合正态分布用配对t检验,结果以±s表示;若不符合正态分布用Wilcoxon 秩和检验,计量资料用M[P25,P75]表示。以P<0.05 为差异有统计学意义。
2 结果
2.1 剂量学指标比较
深度学习模型3DRes-UNet 预测的剂量学参数与临床放疗计划批准的剂量学参数对比结果如表2 所示。靶区PTV 除了CI 外,其他剂量学参数差异均无统计学意义(P>0.05);膀胱V50、Dmean预测剂量小于临床剂量,差异有统计学意义(P<0.05),V40差异无统计学意义(P>0.05);左股骨头V40预测剂量小于临床剂量,差异有统计学意义(P<0.05),V30、V50、Dmean差异无统计学意义(P>0.05);右股骨头Dmean预测剂量小于临床剂量,差异有统计学意义(P<0.05),V30、V40、V50差异无统计学意义(P>0.05);骨盆V45和Dmean的预测剂量均小于临床剂量,差异有统计学意义(P<0.05),其他指标差异均无统计学意义(P>0.05);小肠V30、V40、Dmean、D0.1cc差异无统计学意义(P>0.05)。

表2 临床剂量和3DRes-UNet模型预测剂量学对比
2.2 剂量图及DVH比较
某例患者的临床剂量与预测剂量比较图如图3 所示。由图3 可知临床剂量与预测剂量分布很接近,说明3DRes-UNet 模型可准确预测直肠癌三维空间的剂量。从临床剂量与预测剂量的差值来看,靶区区域的误差很小,在OARs 区域的误差较大。在膀胱的误差达到了10 Gy,主要是PTV 的位置相对固定,OARs 的位置相对不固定导致的,如膀胱的充盈程度变化很大。其他区域的误差范围为-10~10 Gy。DVH 对比图如图4 所示,深度学习模型预测的结果基本满足临床需求,且预测值与临床值曲线接近重合。
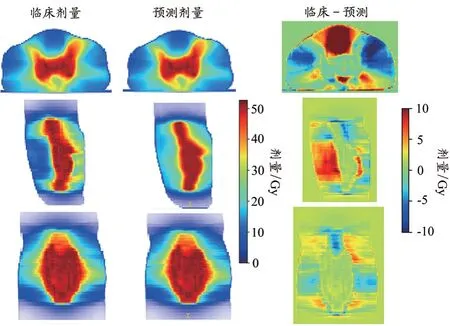
图3 测试集临床剂量与实际剂量及其差异比较
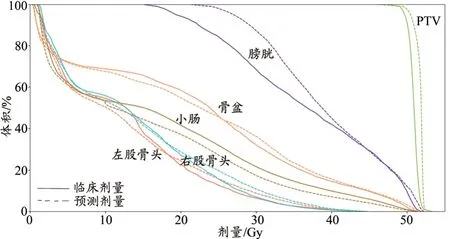
图4 测试集临床与预测DVH图比较
3 讨论
放射治疗作为治疗直肠癌的一种重要方式,被广泛应用于临床。准确预测三维空间体素的剂量在临床上有重要意义,放疗计划质量直接决定了靶区的受量和正常器官的副反应,因此,计划质量决定了临床疗效,物理师的经验和人为因素影响了计划质量。若能准确预测放疗剂量的受量,提取先验信息提前指导放疗新计划设计,排除因计划设计经验导致的靶区剂量不够或OARs 剂量过高,有助于减少肿瘤的复发及正常组织的放疗毒副反应发生率。本文提出3DRes-UNet 深度学习方法,将直肠癌CT 影像及标注的靶区和OARs 的掩码输入模型,输出放疗剂量,最终通过测试集测试模型的准确性。
深度学习作为人工智能领域中机器学习的一个子领域,在医学图像处理中已得到了广泛应用。卷积神经网络是计算机视觉任务中最受欢迎的深度学习框架[11]。卷积神经网络通过卷积核提取输入数据的重要信息,并通过激活函数如sigmoid 和tanh 函数进行非线性处理。通常深度学习框架由大量的人工神经元多层网络组成,这些多层网络可自动捕捉原始图像中与分割任务或分类任务有关的图像特征。相比于传统的3DUnet 网络,本研究提出的3DRes-Unet 模型引入了ResNet 特征提取模块,不仅提升了模型在下采样过程的全尺度特征提取能力,还通过设计两阶段的训练策略,加快了模型收敛,也进一步提升了模型的预测能力。
近年来,人工智能被广泛应用于放疗剂量预测,并取得了重要的成果。早期,Ma 等[12]开发了一种通量图预测方法,该方法可直接生成给定所需剂量分布的通量图,无需对VMAT 计划进行优化。Zhu 等[13]以前列腺为例,基于机器学习的方法,根据解剖信息和膀胱、直肠的特征关系,利用主成分分析法提取显著特征以预测OARs 剂量。何强等[14]提出一种新型的基于多模态特征及多分类器融合的预测模型,并以前列腺癌放疗为例,构建了直肠并发症的预测模型。本研究将深度学习应用于剂量预测,对模型的特征提取编码部分采用的是先进的残差网络[15]。王文成等[16]利用3DRes-UNet 预测了食管癌的调强放射治疗(Intensity-Modulated Radiation Therapy,IMRT)计划,通过依次增加每个编码层的残差块个数,大大增加了模型的参数量,加大了模型的复杂程度,而本研究中的每一层编码层只有一个残差块,网络计算量减少,且本研究为VMAT,射束配置为0°~360°间隔一个角度出束,细化了束流配置信息。此外,本研究还加入了ReLU层及BN 层,加快了网络训练速度和收敛稳定性,防止权重在训练过程中被破坏的同时,大大提高了模型的综合特征提取能力。周解平等[17]利用3DRes-UNet预测了直肠癌的IMRT 计划,每个编码模块由不同数量的残差模块组成,残差块加大了模型的计算量,而本研究简化了模型,同样取得了准确的预测结果。早期,Zhong 等[18]利用基础的3DUNet 预测了直肠癌,每层卷积核的数量依次是32、64、128、256、512,而本研究每个卷积层的卷积核数量是16、32、64、128、256,而且与临床剂量相比,预测的HI、D2、D98、Dmean差异均无统计学意义(P>0.05),靶区CI 差异有统计学意义(P<0.001),这与Song 等[19]的研究基本一致。此外,本研究发现膀胱、左右股骨头、骨盆、小肠等多数剂量学指标差异无统计学意义,有个别的指标差异有统计学意义,这与Wu 等[20]的研究基本一致。既往的研究多是基于KBP 并根据以往的患者预测新患者的DVH[21-22],但因为无法得到三维的空间信息,故存在一定的局限性。本研究提出的深度学习模型可准确预测三维体素级的空间剂量,该方法可拓展到其他肿瘤的预测研究中。
综上所述,本研究以直肠癌术后VMAT 为例,提出了基于3DRes-Unet 的深度学习模型,可准确预测直肠癌的放疗剂量,为临床提供参考。
