USP9X 对Akt 磷酸化水平及血小板活化的影响
2024-04-26贾雪梅邵树军周璐洁杜丹心卢煌莹陈诚夏荣
贾雪梅 邵树军 周璐洁 杜丹心 卢煌莹 陈诚 夏荣
(1.复旦大学附属华山医院 输血科,上海 200040;2.郑州大学附属肿瘤医院 河南省肿瘤医院 输血科)
血栓性疾病(包括动脉血栓栓塞性疾病和静脉血栓栓塞性疾病)是严重威胁人类健康的疾病,其病死率高,对此类疾病的管理治疗也已成为医疗系统的严重负担。 血栓疾病的发生风险随着年龄的增加逐渐上升,其中年龄超过70 岁被认为是静脉血栓的高危发病因素[1],男性年龄超过45 岁,女性年龄超过55 岁被认为是动脉粥样硬化性心血管病发生的高危因素[2]。 血小板在血栓形成中发挥着重要作用,已有多项研究表明,随着年龄的增加,血小板的活性出现增加,血栓形成能力增强,因此,寻找机体衰老过程中血小板功能的调控机制对于血栓性疾病的临床治疗与疾病管理将发挥至关重要的作用。
去泛素化酶广泛存在于机体中,可水解被泛素化标记的蛋白质,维持蛋白稳定性或传递细胞内信号,从而对细胞的生长增殖及功能调控发挥作用[3]。 已有研究表明,血小板中有完整的泛素-蛋白酶体系统,表达多种泛素化酶及去泛素化酶,并参与调控血小板活化[3-4]。 去泛素化酶 9X(USP9X)是1 种高丰度表达的去泛素化酶,目前研究发现USP9X 参与细胞内吞、免疫应答及神经发育等生命过程,并在多种肿瘤中呈现高表达状态[5-8]。 2014 年,Siman 等[9]对154 名健康成年人的血小板进行测序分析发现,USP9X 的mRNA 的表达与年龄呈现明显正相关。 在本研究中,我们首先从蛋白质和RNA 水平上验证了血小板中USP9X的表达,之后采用USP9X 特异性抑制剂检测了其对血小板功能的影响,包括聚集、释放及铺展功能,最后通过免疫印迹的方法检测了USP9X 对血小板下游信号通路的改变,现将研究结果报告如下。
1 对象与方法
1.1 血小板来源
1.1.1小鼠
C57/BL6 小鼠若干只,老年小鼠年龄均>18 个月;年轻小鼠为2 ~3 个月。 所有小鼠均购自维通利华公司,实验动物的饲养及操作均符合实验动物伦理学标准。
1.1.2健康志愿者
健康志愿者5 名,年龄18 ~25 岁,在2 周内未服用阿司匹林、氯吡格雷等影响血小板功能的药物。
1.2 试剂与仪器
血细胞激动剂:ADP(货号:#P/N 384,批号:3526),胶原(货号:P/N 385,批号:3523),凝血酶(货号:P/N 386,批号:3524),荧光素酶(货号:P/N 387,批号:3525),以上试剂均为Chrono-Log 公司产品; USP9X 抗体(货号:55054-1-AP),GAPDH 抗体(货号:60004-1-Ig),Akt 抗体(货号:60203-2-Ig),磷酸化Akt 抗体(货号:66444-1-Ig),以上试剂均为Proteintech 公司产品;USP9X 抑制剂FT709(MCE公司,货号:HY-145967;批号:256350);Trizol 提取试剂(碧云天公司,货号:R0016);逆转录试剂(Takara 公司,货号:RR037B);400VS 型双通道血小板聚集仪(Chrono-Log 公司);DM5500 Q 荧光显微镜(Leica 公司);BC-2800Vet 动物血细胞计数仪(深圳迈瑞生物医疗电子股份有限公司)。
1.3 方法
1.3.1全血标本采集
人:从志愿者的肘正中静脉中采集枸橼酸钠抗凝全血,15 mL/管;小鼠:麻醉后开腹充分暴露腹部结构,抽取腹主动脉枸橼酸钠抗凝全血,每只抽1管,1 mL/管。 具体采集管数依相应试验需要确定。除免疫印迹试验用标本部分采自老年小鼠(用于与年轻小鼠对比)外,其余试验标本均采自年轻小鼠。
1.3.2血小板制备
1.3.2.1人血小板
参照文献[10]的方法,将人抗凝全血通过密度梯度离心(300×g,10 min)获得富血小板血浆(离心后的上层液体),之后再次离心(600×g,5 min)获得血小板沉淀,并用台氏液重悬获得洗涤血小板。 洗涤血小板静置30 min 后方可用于后续检测。
1.3.2.2小鼠血小板
将小鼠抗凝全血通过密度梯度离心(300×g,2 min)获得富血小板血浆(离心后的上层液体),之后再次离心(500×g,5 min)获得血小板沉淀,并用台氏液重悬获得洗涤血小板。 洗涤血小板静置30 min 后方可用于后续检测。
1.3.3外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)制备
将2 管人抗凝全血或2 管小鼠抗凝全血分别加入等体积的生理盐水,稀释血液;取无菌离心管1 个,向其中加入Ficoll 分离液,并将上述稀释好的血液按照1 ∶2的比例轻柔加入分离液中,随后800×g,离心20 min,轻柔吸取中间的PBMCs 层,并分别将其转移到1 个新的离心管中,向离心管中加入洗涤缓冲液15 mL,再次离心600×g,5 min,后使用PBS 重悬细胞,重复离心步骤1 次,最后获得PBMCs。
1.3.4血小板RNA 提取及逆转录
按照试剂说明书方法,用Trizol RNA 提取试剂提取人血小板与小鼠血小板中的RNA,并用Takara逆转录试剂将提取的RNA 逆转录为cDNA,之后通过聚合酶链式反应(PCR),完成mRNA 表达的检测。 引物序列见表1。

表1 RT-PCR 中所用引物序列Table 1 Primer sequence used in RT-PCR
1.3.5血小板蛋白免疫印迹试验
参照文献[11]的方法,将前述制备好的人与小鼠洗涤血小板分别与FT709(USP9X 抑制剂)孵育30 min 后,加入胶原(1.5 μg/mL)诱导血小板聚集,在特定的聚集时间点下(0 s、30 s、90 s、180 s),加入血小板裂解液(含有蛋白酶和磷酸酶抑制剂),冰上裂解10 min 后,加入上样缓冲液,并于100℃金属浴中煮样10 min,完成免疫印记的蛋白标本制备。 采用SDS-PAGE 电泳分离蛋白标本,再将分离开的SDS-PAGE 胶转到PVDF 膜上,采用脱脂牛奶封闭1 h 后,孵育相应的一抗12 h,过夜之后,洗涤一抗并孵育二抗1 h,最后通过显像仪器可视化PVDF 条带。 免疫印记的图像处理最终通过Image J 软件完成。
1.3.6血小板聚集与释放检测
将人与小鼠的洗涤血小板分别与0.1% DMSO(对照组)和100 μmol/L FT709(实验组)在37℃下孵育30 min,之后采用不同浓度(0.8 μg/mL 和1.5 μg/mL)的胶原诱导血小板聚集,并在聚集仪下观察血小板的聚集反应,记录血小板的最大聚集率。参照文献[12]的方法,在血小板聚集检测的同时通过添加荧光素酶来检测血小板中ATP 的释放,并记录血小板释放水平,本试验重复做3 次。
1.3.7血小板铺展检测
参照文献[13]中的方法,将配置好的100 μL纤维蛋白原溶液(100 μg/mL)提前12 h 包被于玻片上,将人和小鼠的洗涤血小板悬液调整到(30 ~50)×109/L 的浓度后,轻柔滴定100 μL 于包被有纤维蛋白原的玻片上,45 min 后对粘附在玻片上的血小板进行固定破膜并采用鬼笔环肽标记血小板,1 h 后PBS 清洗3 次并于荧光显微镜下观察血小板的铺展形态,通过Image J 软件统计血小板的铺展面积。 本试验重复做3 次。
1.4 统计学分析
用GraphPad Prism 10.0.2 软件完成数据统计分析。 聚集释放及铺展实验结果以±s的形式表示,2 组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05 差异有统计学意义。
2 结果
2.1 人血小板与小鼠血小板表达USP9X 的情况
经过RT-PCR 扩增,与阳性对照(PBMCs)相比,人血小板与小鼠血小板均表达USP9X 的mRNA(图1、图2)与蛋白(图3、图4)。

图1 人血小板表达USP9X 的mRNA 扩增结果Figure 1 PCR detection of USP9X in human platelets
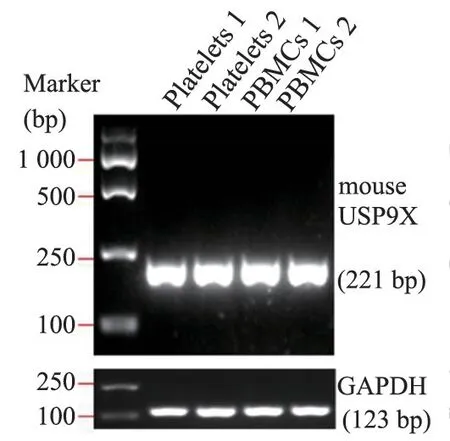
图2 小鼠血小板表达USP9X 的mRNA 扩增结果Figure 2 PCR detection of USP9X in mouse platelets
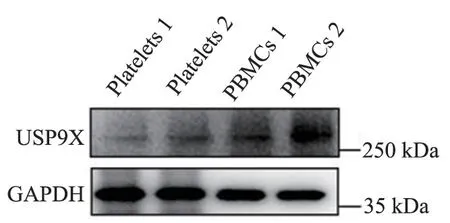
图3 人血小板中USP9X 的免疫印记结果Figure 3 Western blot results of USP9X in human platelets
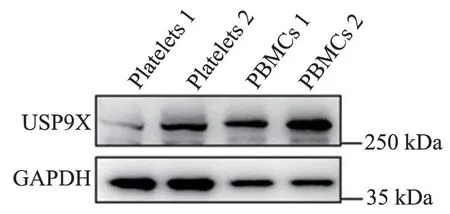
图4 小鼠血小板中USP9X 的免疫印记结果Figure 4 Western blot results of USP9X in mouse platelets
2.2 不同年龄小鼠血小板中USP9X 的表达比较
免疫印迹检测结果显示老年小鼠的血小板中USP9X 的表达水平(0.87±0.099vs1.05±0.980)明显高于年轻小鼠(t=2.81,P<0.05),见图5、图6。
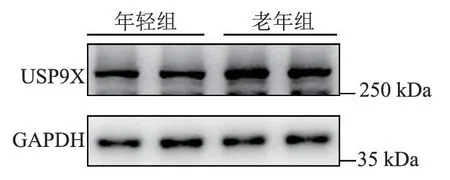
图5 年轻小鼠血小板和老年小鼠血小板中USP9X 的免疫印记结果Figure 5 Western blot results of USP9X in platelets from both young and old mice
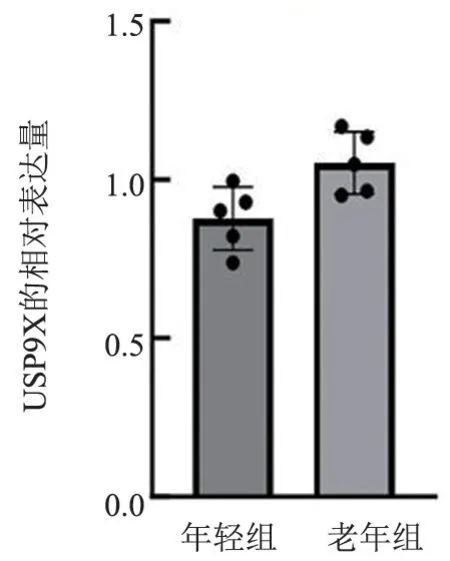
图6 年轻小鼠血小板和老年小鼠血小板中USP9X 的免疫印记统计结果Figure 6 Statistical results of USP9X in platelets from both young and old mice
2.3 血小板聚集与释放检测结果
FT709 可浓度梯度依赖性地减弱低浓度(0.8 μg/mL)胶原诱导的人血小板的聚集(图7 和图8),可增强高浓度(1.5 μg/mL)胶原诱导的人血小板的聚集(图9、图10),并在人血小板活化过程中减弱人血小板ATP 的释放(图11、图12); FT709可浓度梯度依赖性地减弱低浓度(0.8 μg/mL)胶原诱导的小鼠血小板的聚集(图13、图14),可减弱高浓度(1.5 μg/mL)胶原诱导的鼠血小板的聚集(图15、图16),并在小鼠血小板活化过程中减弱鼠血小板ATP 的释放(图17、图18)。
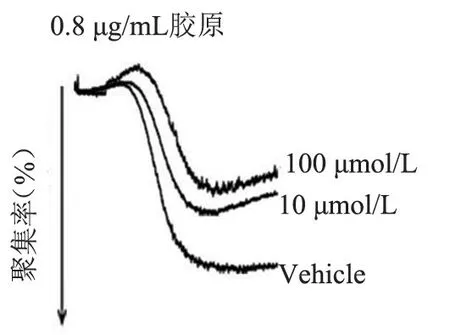
图7 不同浓度FT709 处理人血小板后的聚集结果Figure 7 Aggregation results of human platelets treated with different concentration of FT709
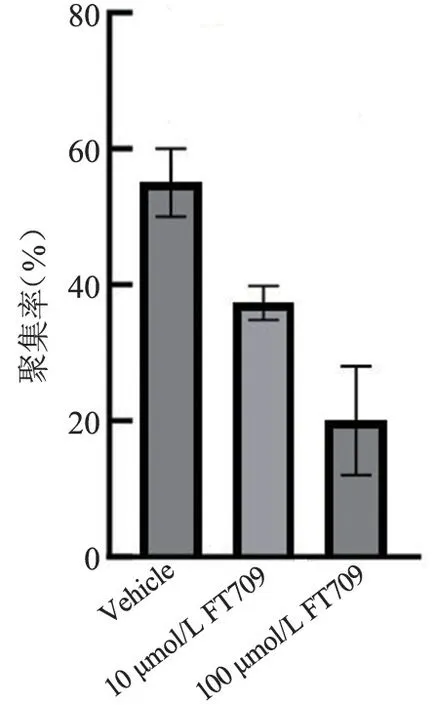
图8 不同浓度FT709 处理人血小板后的统计结果Figure 8 Aggregation statistics of human platelets treated with different concentration of FT709

图9 FT709 处理人血小板后的聚集结果(1.5 μg/mL 胶原激动)Figure 9 Aggregation results of human platelets treated with FT709 (stimulation with 1.5 μg/mL collagen)

图10 FT709 处理人血小板后的聚集统计结果(1.5 μg/mL胶原激动)Figure 10 Aggregation statistics of human platelets treated with FT709(stimulation with 1.5 μg/mL collagen)
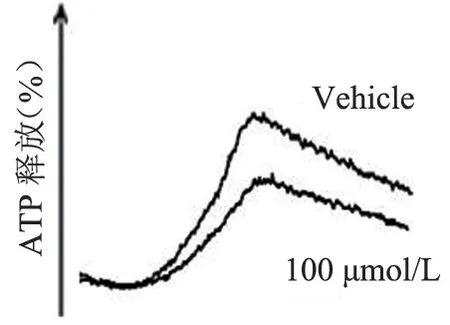
图11 FT709 处理人血小板后的释放结果(1.5 μg/mL 胶原激动)Figure 11 ATP releasing curve of human platelets treated with FT709 (stimulation with 1.5 μg/mL collagen)
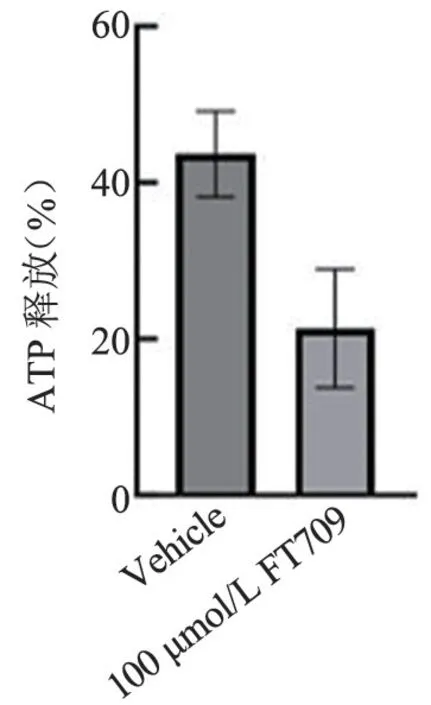
图12 FT709 处理人血小板后的释放统计结果(1.5 μg/mL胶原激动)Figure 12 Statistical results of ATP releasing of human platelets treated with FT709 (stimulation with 1.5 μg/mL collagen)
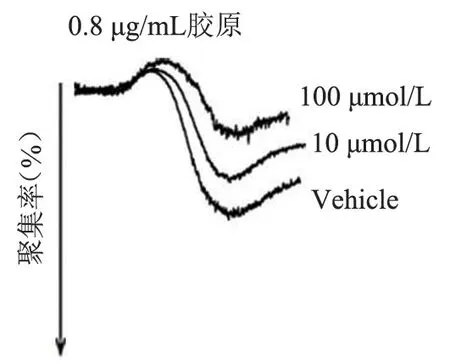
图13 不同浓度FT709 处理小鼠血小板后的聚集结果Figure 13 Aggregation results of mouse platelets treated with different concentration of FT709

图14 不同浓度FT709 处理小鼠血小板后的聚集统计结果Figure 14 Aggregation statistics of mouse platelets after treatment with different concentrations of FT709
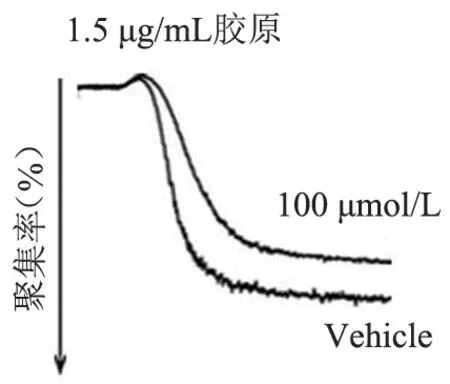
图15 FT709 处理小鼠血小板后的聚集结果(1.5 μg/mL胶原激动)Figure 15 Aggregation results of mouse platelets treated with FT709 (stimulation with 1.5 μg/mL collagen)
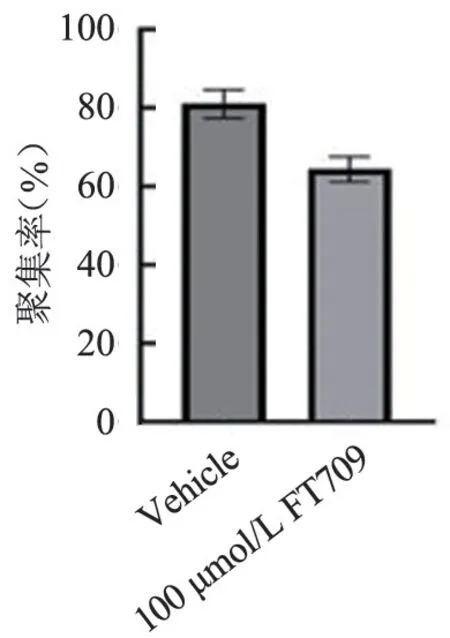
图16 FT709 处理小鼠血小板后的聚集统计结果(1.5 μg/mL 胶原激动)Figure 16 Aggregation statistics of mouse platelets after treatment with FT709 (stimulation with 1.5 μg/mL collagen)

图17 FT709 处理小鼠血小板后的释放结果(1.5 μg/mL胶原激动)Figure 17 ATP releasing curve of mouse platelets treated with FT709(stimulation with 1.5 μg/mL collagen)
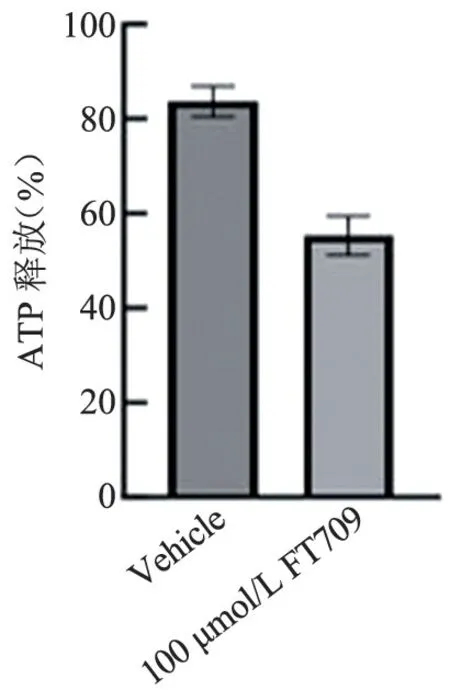
图18 FT709 处理小鼠血小板后的释放统计结果(1.5 μg/mL 胶原激动)Figure 18 ATP releasing statistics of mouse platelets after treatment with FT709(stimulation with 1.5 μg/mL collagen)
2.4 血小板铺展检测结果
FT709 可显著减少人血小板与小鼠血小板在纤维蛋白原表面的黏附面积(图19、图20),表明USP9X 参与介导血小板的“外向内”信号通路。

图19 100 μmol/L FT709 处理人血小板后的铺展结果Figure 19 Spreading results of human platelets treated with 100 μmol/L FT709

图20 100 μmol/L FT709 处理小鼠血小板后的铺展结果Figure 20 Spreading results of mouse platelets treated with 100 μmol/L FT709
2.5 USP9X 对血小板Akt 磷酸化水平的影响
使用胶原激动血小板,并在血小板活化的指定时间点收样(图21)。 免疫印记结果显示,相比于对照组,FT709 可导致血小板中Akt 的磷酸化水平明显下降(图22),表明FT709 可以减弱血小板Akt的磷酸化。

图21 收样模式图Figure 21 Schematic figure of platelets sample collection
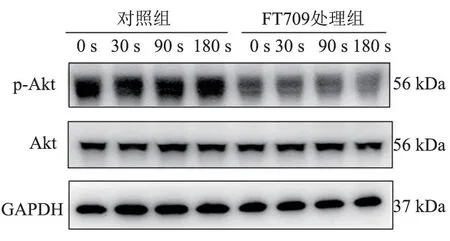
图22 FT709 处理后血小板后不同时间点Akt 磷酸化的免疫印记结果Figure 22 Western blot results of Akt phosphorylation at different time points after platelets activation
3 讨论
血小板中USP9X 的表达与功能的相关研究目前尚未见报道,本研究可为USP9X 在临床血栓疾病干预中的潜在应用提供数据支持。
在血小板的活化中,蛋白质的磷酸化是目前研究最广泛的蛋白质修饰方式,磷酸化与去磷酸化的相互协调对于维持血小板功能的稳定发挥了重要作用。 除了蛋白质的磷酸化外,血小板中还存在其他的翻译后修饰过程,如蛋白质的泛素化修饰[13-14]。 泛素是由76 个氨基酸组成的多肽片段,可连接到蛋白质的赖氨酸残基,参与维持蛋白质稳定性或信号转导的功能。 血小板中包含有泛素蛋白酶体机制,临床工作中发现蛋白酶体抑制剂Bortezomib 可导致凝血酶、胶原及ADP 诱导的血小板功能出现抑制[15-16],并可抑制三氯化铁诱导的动脉血栓的形成。 这些结果均表明蛋白酶体在血小板活化中发挥着重要作用。 此外,还有研究表明去泛素化酶的抑制剂可抑制体外血小板功能及体内动脉血栓的形成[4]。 本研究中,我们首次检测了USP9X 在人血小板与小鼠血小板中的表达,并首次发现抑制USP9X 可抑制体外血小板活化。 我们的前期研究表明血小板中表达多种去泛素化酶,这些去泛素化酶对于血小板信号传导及蛋白稳定性的维持发挥了重要作用,后期研究我们仍需确定USP9X 对血小板中具体蛋白的调控作用,并借助体外的细胞实验完成后续验证工作。
机体的衰老是随着年龄增加出现的机体功能的障碍。 已有文献总结了衰老过程中的多项变化,其中包括蛋白质的稳态性下降[17-18]。 Davizon-Castillo 等[19]的研究结果显示,泛素蛋白酶体通路在巨核细胞衰老中发挥着重要的作用,Simon 等[9]从154 名健康志愿者中分离获得洗涤血小板,并采用测序技术检测了人血小板中高丰度表达的mRNA,多因素回归结果显示USP9X 的mRNA 表达水平与年龄呈现明显正相关。 本研究首次验证了人血小板与小鼠血小板中均表达USP9X,同时发现老年小鼠的血小板中USP9X 的蛋白表达量明显高于年轻小鼠(P<0.05),这一结果与Simon 等的研究结果一致,但对于USP9X 的mRNA 和蛋白水平增高的原因仍需进一步探索,例如,是否是衰老机体中USP9X 的转录因子表达升高,或者影响USP9X 表达的蛋白激酶的水平发生变化,对于上述假设的证明将为USP9X 在机体中的作用发挥提供重要证据。
血小板的活化过程受多个信号通路的调控,其中PI3K-Akt[脂酰肌醇3 激酶(PI3K)/蛋白激酶B(Akt)]信号发挥重要作用。 Akt 是PI3K 下游的关键分子,Akt 的磷酸化和活化对血小板聚集和颗粒物质释放起到重要调控作用。 Akt 可被PI3K 募集到细胞膜上,并发生磷酸化,参与调控下游分子信号。 Akt 家族有3 个成员Akt1、Akt2、Akt3,在人血小板中表达Akt1 和Akt2[20-21]。 既往研究显示,血小板中Akt 参与调节GPCR、GPVI 和GPIb-IX 等受体介导的下游信号通路,最终诱导整合素活化和颗粒物质释放,并因此影响血小板的二相聚集(second wave platelet aggregation)[22-24]。 在本研究中,我们发现FT709 可减弱血小板的聚集率和ATP 释放水平,进一步我们发现,FT709 可减弱Akt 的磷酸化,尽管目前尚未明确USP9X 在血小板中的具体作用靶点,但根据现有结果我们推测USP9X 可通过影响Akt 的磷酸化,最终影响血小板活化。 对于上述推测,进一步研究仍需从分子机制水平详细阐述。
综上所述,本研究首次验证了人血小板与小鼠的血小板均表达USP9X,且USP9X 的特异性抑制剂FT709 可抑制人血小板与小鼠血小板的聚集释放及铺展功能。 但本研究未能明确USP9X 对于血小板中具体蛋白的调控作用,后续仍需要通过实验动物和免疫沉淀的方法确定下游机制。
