短链脂肪酸通过抑制白细胞介素17A和NF-κB信号通路减轻γδT细胞介导的炎症反应
2024-04-25刘槃席德双黄瑞滕益霖刘睿曾高峰宗少晖
刘槃 席德双 黄瑞 滕益霖 刘睿 曾高峰 宗少晖
1新乡医学院第三附属医院骨科(河南新乡 453000);2广西医科大学第一附属医院脊柱骨病外科(南宁 530021);3广西医科大学公共卫生学院(南宁 530021);4新乡医学院(河南新乡 453000)
γδT 细胞仅为T 淋巴细胞的一小部分,但这些细胞在宿主防御做出关键贡献[1-2]。研究[3-4]表明肠道中γδT 细胞对感染或炎症反应迅速,可被募集到损伤部位促进炎症反应,严重影响中枢神经系统疾病的预后。肠道微生物群是一个复杂的生态系统,在细胞代谢、消化和营养吸收以及免疫系统的发育和维持方面有着至关重要的作用[5-8]。有研究[9]表明肠道细菌产生的代谢物对免疫细胞如树突状细胞和T 淋巴细胞有着深刻的影响。短链脂肪酸作为肠道菌群的主要代谢产物之一,在调节免疫反应和维持抗/促炎平衡方面发挥着重要作用,它是肠道微生物群和免疫系统之间的桥梁[10-12],可以调节免疫细胞的分化和细胞因子的产生[9]。然而,短链脂肪酸对γδT 细胞的影响有待于进一步的研究。为此,在本研究中,采用了肠道微生物代谢产物短链脂肪酸对γδT 细胞进行干预,旨在明确短链脂肪酸对γδT 细胞的影响,并分析其内在分子机制,以期为微生物代谢产物治疗相关疾病提供新思路。
1 材料与方法
1.1材料SD雌性大鼠购于广西医科大学动物实验中心,体质量(200 ± 10)g;脱氧核糖核酸酶Ⅰ、中性蛋白酶、胰酶、Percoll 细胞分离液、RPMI-1640培养基、佛波酯、布雷非德菌素A 及动物组织/细胞总蛋白提取试剂盒购于北京Solarbio 科技有限公司;胶原酶Ⅳ购于美国Gibco 公司;TCRγ/δ+T 细胞分离试剂盒、Atuo MACS Running Buffer、MS 分选柱购于德国Miltenyi 公司;乙酸钠、丙酸钠、丁酸钠、离子霉素购于美国Sigma 公司;CCK-8 购于安徽白鲨生物科技有限公司;ELISA 试剂盒购于上海酶联生物科技有限公司;引物由上海生工公司合成,RNA 提取试剂盒购于TaKaRa 生物技术有限公司,逆转录试剂盒购于启衡星生物科技有限公司;Fixable Viability Dye eFlour ™ 780、CD3 Monoclonal Antibody(FITC)、IL-17A Monoclonal Antibody(APC)、Biolegend anti-rat TCR γ/δ(PE)及Intracellular Fixation & Permeabilization Buffer Set 购于美国eBioscience 公司;IL-17A,P-P65,P65,IKK,β-actin(一抗)购于美国Cell Signaling Technology 公司。
1.2 γδ 细胞的提取取大鼠肠道组织,去除肠系膜和脂肪组织,纵向切开肠管并用PBS 清洗,将组织剪成1 mm2的小块后加入5 mL 肠道消化液,在恒温摇床上消化30 min,使用70 μm 滤网过滤,此步骤重复3 次。将消化的滤液加入PBS 进行离心洗涤,使用Percoll 梯度法分离,收集中间层的单核淋巴细胞离心洗涤后备用。将收集的单核淋巴细胞用80 μL MACS 重悬,并调整细胞浓度至1 ×107个/mL。加入偶联磁珠的γδ+TCR 抗体,4℃避光孵育25 min,MACS洗涤后使用500 μL MACS重悬。采用Miltenyi 分离柱吸附γδ+TCR 细胞,去除磁场后洗涤出阳性选择的细胞,即为γδ T 细胞。分选后的细胞转入RPMI-1640 培养基培养。
1.3 细胞增殖-毒性检测(CCK-8)分别用含有不同浓度(0、0.125、0.25、5、1、2、4、8、16、32 μmol/L)的乙酸钠(A)、丙酸钠(P)、丁酸钠(B)及混合短链脂肪酸(Mix)(乙酸钠、丙酸钠和丁酸钠混合物,混合比例为12∶5∶3)的完全1640 培养基将γδT 细胞接种到96 孔板中,每孔培养基体积为100 μL,细胞密度为1 × 104个/孔。干预24 h 后,每孔中加入CCK-8 溶液10 μL,避光孵育1.5 h 后,酶标仪测定在450 nm 处每孔的OD值。
1.4 酶联免疫吸附测定(ELISA)检测IL-17A 因子含量以2 × 106个/孔的浓度将γδT 细胞接种在6 孔板中,设为对照组(Control)、乙酸钠组(sodium acetate, A)、丙酸钠组(sodium propionate, P)、丁酸钠组(sodium butyrate,B)及混合短链脂肪酸组(Mix)。使用适当浓度的乙酸钠、丙酸钠、丁酸钠和混合短链脂肪酸干预γδT 细胞24 h。培养结束后,2 000 r/min 离心5 min,收集上清液。按照试剂盒的步骤检测γδT 细胞上清液中的IL-17A 因子含量。
1.5 实时荧光定量(RT-qPCR)检测IL-17A 因子的表达水平按照上述的方法进行分组和干预γδT 细胞。培养结束后,根据RNA 提取试剂盒的步骤提取各组细胞的RNA,根据吸光度比值检测RNA 260 nm 和280 nm (A260/A280)评估RNA 的完整性。随后逆转录为cDNA,进行RT-qPCR 检测各组IL-17A 因子的表达水平。各靶基因的相对表达量由2-ΔΔCT方法。引物序列列见表1。
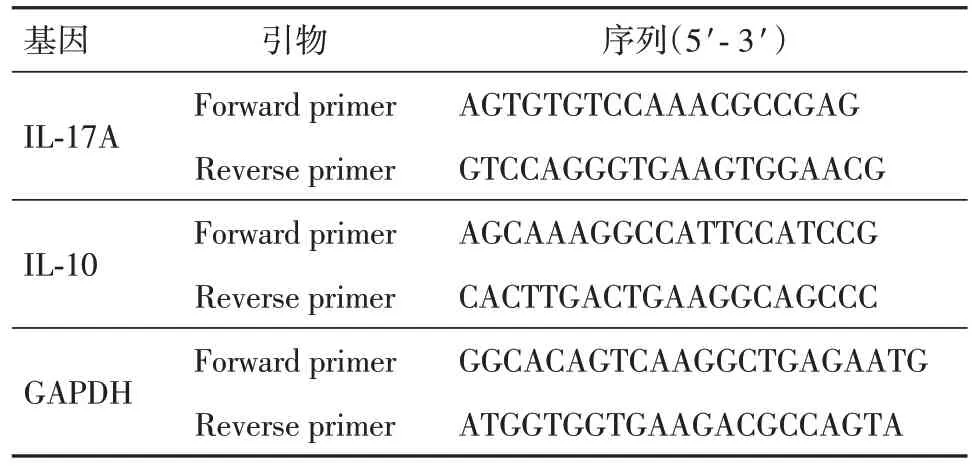
表1 大鼠各基因引物序列Tab.1 Primers sequence of rat genes
1.6 流式细胞仪分析IL-17+γδT 细胞的比例调整细胞悬液密度,首先使用细胞死活染料FVD-780进行染色鉴定细胞死活,CD45-PerCP-eFluor 710,CD3-FITC,TCR γ/δ-PE 流式抗体避光染色20 min用于表面标记分析。用固定和渗透缓冲液固定和渗透后,加入IL-17A 抗体孵育30 min。洗涤后进行流式细胞术检测,采用美国Beckman Coulter 公司的CytExpert 2.0 软件进行统计分析。
1.7 Western blot收集6 孔板中各组的γδT 细胞,根据细胞数量加入相应体积的裂解液,涡旋震荡冰上裂解后高速离心,收集管里的上清液即是提取的总蛋白。使用BCA 法测定各组蛋白浓度并调整到一致,上样缓冲液充分混匀后金属浴中变性。各组蛋白等量上样后进行SDS-PAGE 电泳,200 mA 恒流转膜120 min,脱脂牛奶室温封闭90 min,4 ℃下摇床孵育一抗过夜,室温避光孵育二抗1 h,TBST漂洗条带后使用Odyssey扫描仪系统采集Western blot 条带图像,Image J 软件对Western blot 条带进行分析,以β-actin 为内参,计算目标条带蛋白与各自内参的数值。
1.8统计学方法使用SPSS 24.0 软件对数据进行统计分析,计量资料采用(±s)表示,单因素方差分析用于比较不同组别之间的差异,P< 0.05 表示差异具有统计学意义。
2 结果
2.1 CCK-8 检测SCFAs 对γδT 增殖活性的影响短链脂肪酸干预24 h 后通过CCK-8 法检测γδT的增殖活性。乙酸钠的浓度在0.5 mmol/L 及以下时,对γδT 细胞的增殖无抑制作用(P> 0.05),浓度> 0.5 mmol/L 时对γδT 细胞的增殖有抑制作用(P< 0.001)。丙酸钠、丁酸钠和混合短链脂肪酸的浓度在0.25 mmol/L及以下时,对γδT细胞的增殖无抑制作用(P> 0.05),浓度大0.25 mmol/L 时对γδT细胞的增殖有抑制作用(P< 0.001)。因此在后续的实验中,浓度设置为乙酸钠0.5 mmol/L、丙酸钠0.25 mmol/L、丁酸钠0.25 mmol/L、混合短链脂肪酸0.25 mmol/L 来对γδT 细胞进行干预。见图1。
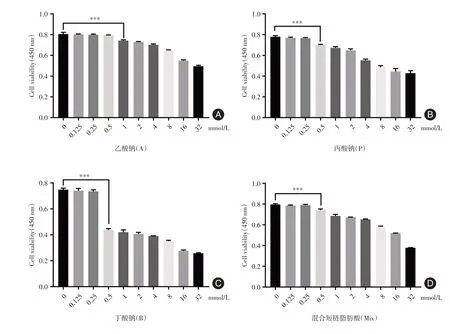
图1 SCFAs 以剂量依赖方式抑制γδT 细胞的增殖Fig.1 SCFAs inhibit the proliferation of γδT cells in a dose-dependent manner
2.2 ELISA 检测γδT 细胞中IL-17A 因子含量ELISA 结果显示,丙酸钠组、丁酸钠组及混合短链脂肪酸组处理的γδT 细胞上清液中IL-17A 的含量较Control 组均显著降低,其中丁酸钠组抑制的最明显(P< 0.001),丙酸钠和混合短链脂肪酸次之(P< 0.001),乙酸钠组无明显抑制(P> 0.05)。见图2。
2.3 RT-qPCR 检测γδT 中IL-17A 因子表达水平丙酸钠组、丁酸钠组及混合短链脂肪酸组处理的γδT 细胞中IL-17A 的表达水平较Control 组均显著降低,其中丁酸钠组降低的最明显(P<0.001),丙酸钠组和混合短链脂肪酸组次之(P<0.001)。RT-qPCR 实验也在mRNA 水平印证了丙酸钠、丁酸钠及混合短链脂肪酸可以显著抑制γδT 细胞分泌IL-17A(P< 0.001)。见图3。
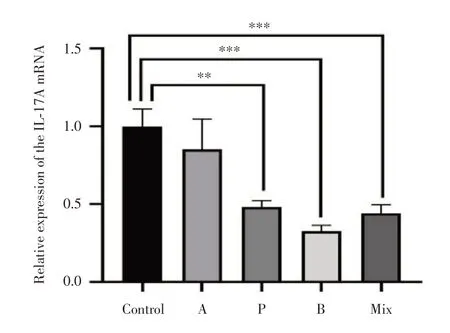
图3 RT-qPCR 检测γδT 细胞中IL-17A 因子的表达水平Fig.3 Expression of IL-17A in γδT cells was determined by RT-qPCR
2.4 流式细胞术检测IL-17+γδT 细胞的数量与Control 组相比,IL-17+γδT 细胞的比例在经过乙酸钠、丙酸钠、丁酸钠以及混合的短链脂肪酸干预后都有明显的下降。和乙酸钠组相比,丙酸钠组、丁酸钠组和混合短链脂肪酸组抑制IL-17+γδT 的能力更明显,但是丙酸钠、丁酸钠和混合短链脂肪酸三者之间抑制IL-17+γδT 的能力无明显差别。见图4。

图4 流式细胞术检测IL-17+γδT 细胞的数量Fig.4 Frequency of IL-17+γδT cells was detected by flow cytometry
2.5 SCFAs 可能通过抑制组蛋白去乙酰化酶(HDAC)的表达来减少γδT细胞IL-17A的分泌将混合的短链脂肪酸(Mix)、HDAC 的抑制剂TSA、Mix + TSA 和γδT 共培养24 h,然后检测IL-17+γδT细胞的比例。与Control 组相比,三组经过处理后的IL-17+γδT 细胞的比例均明显下降(P< 0.001),Mix、TSA 和Mix+TSA 三者之间差异无统计学意义(P> 0.05)。见图5。
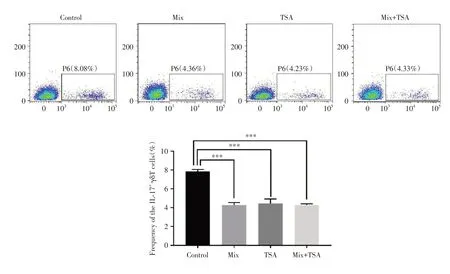
图5 SCFAs 可能通过抑制HDAC 的表达来影响γδT 细胞IL-17A 的分泌Fig.5 SCFAs may affect IL-17A secretion in γδT cells by inhibiting HDAC expression
2.6 SCFAs 可通过抑制IL-17A 和NF-κB 信号通路来减轻炎症反应通过Western blot 实验检测γδT 细胞内IL-17A 的表达水平及NF-κB 信号通路关键蛋白。与Control 组比较,丙酸钠、丁酸钠和混合短链脂肪酸可抑制IL-17A、IκB 激酶(IKK)以及NF-κB 磷酸化水平的表达(P< 0.05),而乙酸钠对IL-17A、IKK 以及NF-κB 的磷酸化水平无明显抑制(P> 0.05)。见图6。
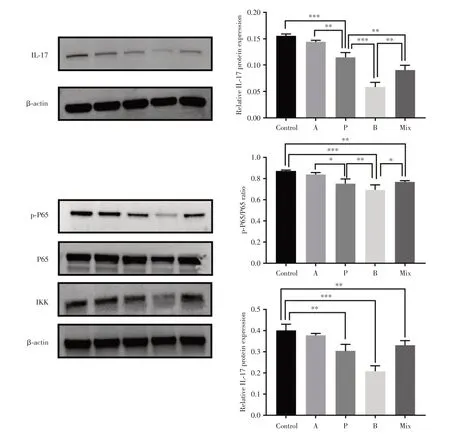
图6 短链脂肪酸对IL-17A 和NF-κB 信号通路的影响Fig.6 Effect of short-chain fatty acids on IL-17A and NF-κB signaling pathway
3 讨论
γδ T细胞是一种独特的T细胞亚群,在如皮肤、肠道黏膜和脂肪组织等外周组织中富集,尤其在肠道中非常丰富[13]。它们不受主要组织相容性复合体限制,具有先天免疫细胞的多种特性,在先天和免疫反应中起着至关重要的作用[14]。γδT 细胞不仅对感染或炎症反应迅速,还能促进干扰素-γ、IL-17A 和IL-23 的分泌,这可能会严重影响中枢神经疾病的预后[15]。短链脂肪酸具有较为丰富的生物学作用,可参与机体的免疫调节,促进免疫细胞分化成熟[16-17]。因此,深入研究短链脂肪酸作用于γδT 细胞的分子机制,可为这些小分子代谢物用于中枢神经系统疾病的治疗提供新的依据。本研究采用短链脂肪酸对γδT 细胞进行干预,以探索短链脂肪酸对γδT 细胞的影响。本研究发现一定浓度的短链脂肪酸对γδT 细胞没有毒性作用,并且可以影响到γδT 细胞IL-17A 和NF-κB 信号通路的表达。这些研究结果均提示短链脂肪酸能通过抑制γδT 细胞来抑制炎症反应。
炎症的发生、发展和终止需要基因激活、表观遗传修饰、转录翻译和翻译后调控,所有这些都受到不同酶的严格调控[18]。组蛋白去乙酰化酶(histone deacetylase, HDACs)可调节炎症相关基因的表达,直接影响炎症的过程[19]。短链脂肪酸是HDACs 的天然抑制剂[20]。本研究发现使用一定浓度的短链脂肪酸处理γδT 细胞后,丙酸、丁酸及混合的短链脂肪酸显著抑制γδT 细胞中IL-17A的表达。在使用泛HDAC 抑制剂曲古抑菌素A(trichostatin A,TSA)干预γδT 细胞后,其分泌的IL-17A 同样得到明显的抑制。然而,当把短链脂肪酸和TSA 混合起来干预γδT 细胞,其抑制γδT 细胞分泌的IL-17A与两者分别干预后的无明显差异。因而,推断短链脂肪酸可能是通过抑制HDAC 来起到抑制γδT 来分泌IL-17A 的。
转录因子NF-кB 在调节免疫炎症反应中的作用是基础性的。它上调特定基因,包括细胞因子、趋化因子、主要组织相容性复合体以及免疫细胞黏附和迁移所需的受体,以及细胞增殖和凋亡[21-22]。IL-17 是机体重要的炎症因子,它通过诱导促炎细胞因子和趋化因子,招募中性粒细胞,激活T 细胞和B 细胞,在各种炎症反应和自身免疫性疾病的发病机制中起着关键作用[23-24]。IL-17R可识别IL-17 并介导NF-κB 信号通路的激活,诱导p65 表达,进而增强IL-17 自分泌[25]。IL-17 可以与其他细胞因子(如TNF-α)相互作用以激活NF-κB并促进和延长炎症反应[26]。而阻断IL-17 可有效地抑制LPS 诱导的肺组织中NF-κB 的表达和激活,并抑制NF-κB 的核转位[27]。本研究发现,短链脂肪酸可抑制IL-17A、IKK 的表达以及NF-κB 磷酸化水平,这提示短链脂肪酸可能通过阻碍γδT 细胞的IL-17A 和NF-κB 信号通路,进而减轻机体的炎症反应。
综上所述,短链脂肪酸可抑制γδT 细胞IL-17A和NF-κB 的激活,从而减轻机体的炎症反应,其机制可能是短链脂肪酸通过调控HDAC 来实现的。本研究通过初步证实了短链脂肪酸可抑制γδT 细胞减轻机体的炎症反应,并探究了其可能的分子机制,为这些小分子代谢物用于中枢神经系统疾病的治疗提供一定的理论依据。但该研究尚有不足之处,目前只在从流式实验中推断短链脂肪酸可能是通过HDAC 影响到γδT 来分泌IL-17A 的。然而,短链脂肪酸怎样通过HDAC 影响到γδT 细胞,以及到底抑制了HDAC 的哪个亚型来发挥作用,后续本课题组还将继续对其作用机制进行深入探讨并加以验证。
【Author contributions】LIU Pan performed the experimental research and wrote the article. XI Deshuang analyzed the experimental data. HUANG Rui, TENG Yilin and LIU Rui collectedand organized the literature. ZONG Shaohui and ZENG Gaofeng formulated the article ideas and reviewed the article. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
