加巴喷丁减轻骨折模型大鼠焦虑情绪及海马神经炎症的作用机制研究
2024-04-24徐礼玲付恒曾思
徐礼玲,付恒,曾思
作者单位:1自贡市精神卫生中心,四川 自贡 643020;
2四川省医学科学院,四川 成都610000
骨折属于临床常见骨科疾病,各年龄阶段均有较高发生率,尤其是儿童及老年人[1]。骨折后易合并感染、神经血管损伤等并发症,还可能诱发焦虑抑郁疾病等心理疾病,对病人生活质量产生极大影响[2-3]。外科手术属于疾病治疗首选方案。围手术期病人普遍存在骨折疼痛、手术应激反应,诱发焦虑情绪风险较高,因此临床认为有必要加强骨折疾病病人管理[4-5]。加巴喷丁成分为加巴喷丁和普瑞巴林,最早主要用于抗癫痫辅助治疗[6]。近年来逐渐应用于各类疼痛相关治疗,诸多研究证实加巴喷丁对骨折疼痛[7-9]、疼痛诱发的焦虑有着重要价值。Huo 等[10]研究中报道,骨折将增加小鼠中风损伤及中风后记忆功能障碍,其影响机制与 α-7 烟碱型乙酰胆碱受体 (α-7 nAchR) 诱发神经炎症,导致神经元受损有着密切关联性。海马区作为大脑中具有丰富神经连接环路区域,具有记忆、信息储存等功能,同时还参与了情感、认知活动调控机制,其神经炎症与手术应激反应、焦虑情绪发病有着密切关联性[11-13]。目前临床对加巴喷丁治疗骨折所致的焦虑情绪及海马神经炎症的影响机制未见相关报道,仍有待进一步研究及论证。基于此,本研究自2022年1—6 月将加巴喷丁对骨折模型大鼠焦虑情绪及海马神经炎症的影响进行分析,旨在通过动物实验研究作用机制,为后续临床试验研究提供科学依据。
1 材料与方法
1.1 实验动物选择健康雄性无特定病原体(specific pathogen free,SPF)级SD 大鼠48 只,雌雄各半,体质量范围为200~300 g,3 月龄,由上海斯莱克实验动物有限责任公司提供[SCXK(沪)2019-0033]。大鼠培养环境:温度22~25 ℃,湿度49%~51%,12 h 光亮/12 h 黑暗交替培养,自由饮水摄食。所有动物均分笼适应性喂养5 d(每4 只为1 笼),方可用于实验。本研究中对于大鼠的处理符合动物伦理学相关标准。
1.2 主要试剂及仪器加巴喷丁来自于海南赛立克药业有限公司,戊巴比妥钠来自于上海市欣诚化工有限公司,大鼠白细胞介素-4(interleukin-4,IL-4)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)测定试剂盒来自于上海臻科生物科技有限公司,谷胱甘肽过氧化物酶(GSH-Px)比色法试剂盒来自武汉伊莱瑞特生物科技股份有限公司,超氧化物歧化酶(SOD)ELISA试剂盒来自上海信裕生物工程有限公司,丙二醛(malondialdehyde,MDA)ELISA 试剂盒来自上海沪震生物科技有限公司。苏木素伊红(hematoxylin eosin,HE)染色液来自于铼博(上海)生化科技有限公司,BCA 试剂盒来自于上海炎熙生物科技有限公司,Tris-HCl 缓冲盐溶液来自于北京汇智和源生物技术有限公司,兔抗鼠二抗稀释液来自于上海优宁维生物科技股份有限公司。大鼠高架十字迷宫(型号PM-200)来自于成都泰盟软件有限公司,酶标仪(MK3 型)来自于美国Thermo 公司,光学显微镜(Primo Vert 型)来自于德国Leica 公司,凝胶成像分析仪(ChemiDoc XRS+型)来自于美国 Bio-Rad公司。
1.3 分组采用随机数字表法将48 只大鼠分为假手术组、模型组、治疗组,各16只。假手术组正常饲养,未做任何处理,其余两组大鼠均进行骨折造模。治疗组给予加巴喷丁干预,将1 mg/kg 加巴喷丁与0.9%氯化钠注射液配置为水溶液100 mg/kg,并给予腹腔注射。模型组给予生理盐水干预,腹部注射等量0.9%氯化钠注射液代替。两组均连续给药12 d。
1.4 骨折动物模型准备操作方法[14]:采用40 mg/kg 的1%戊巴比妥钠实施腹腔麻醉,确定右下肢髌骨内缘做一1 cm 的纵行切口,并对其股四头肌腱性组织部分进行纵行分离;缓慢屈曲膝关节,并对髌骨进行外侧脱位牵拉,充分暴露股骨髁间凹;确定股骨髁间凹处采用手钻逆行髓腔钻入直径1.0 mm克氏针,当遇到股骨大转子阻力时可往回抽,并进行切断操作,将断段埋于膝关节软骨表面下,并对其切口进行逐层闭合。将大鼠调整为仰卧体位,保持右下肢外展内旋,并将其固定于造模支架的铁砧间距15 mm的调节砧上。将造模支架中柱下端的骨刀放置并压在大腿中部,由实验助手提起500 g的砝码调整到20 cm 处,并让其沿导杆保持自由落体撞击到钢板,导致大鼠发生股骨中段骨折。并基于X线辅助下完成对骨折动物模型的检查。
1.5 观察指标
1.5.1焦虑情绪 高架十字迷宫实验:高架十字迷宫区域包括2 个开放臂(50 cm×10 cm)、2 个闭合臂(50 cm×10 cm×40 cm)、中央区(10 cm×10 cm),迷宫距离地面50 cm。测试前将大鼠放入实验环境中适应30 s再进行正式实验。正式实验中将大鼠放置于开放臂、闭合臂交界处,且大鼠头部面向开放臂;实验人员远离迷宫并进行同步摄像,设置观察时间为5 min。采用软件分析大鼠总穿臂次数(TE)、进入比例(OE)、停留时间比例(OT)。采用软件分析大鼠中央区运动距离、进入次数、停留时间及总运动距离。每只动物完成实验后均需要采用10%乙醇对方箱内壁及底面进行清洗,以消除上只动物残留的气味、大小便等信息。进入开放臂次数越少,停留时间越短表明动物焦虑情绪越严重。
1.5.2海马神经炎症、氧化应激因子 实验结束后,对每组大鼠进行断头取海马组织操作,并在冰上进行海马组织(选择自枕骨大孔沿矢状缝撬开颅骨,采用玻璃分针拨开大脑皮层,充分暴露海马区域)剥离与称重,并将其分为3 份,分别用于炎症因子检测、苏木素染色、蛋白质印迹法。
(1)炎症因子IL-4、IL-6、IL-1β 及SOD、MDA、GSH-Px的检测:加入生理盐水制备10%大鼠海马组织匀浆液,进行10 min 离心操作(12 000 r/min)后获取上层清液,采用对应ELISA 试剂盒检测海马匀浆液中的炎症因子(IL-4、IL-6、IL-1β)、SOD、MDA 水平,采用比色法检测GSH-Px,具体操作按照对应试剂盒说明书进行操作,包括稀释、加样、温育、洗涤、加酶、显色、终止反应。并将酶标仪调零后,确定450 nm 波长参数,并检测海马组织中IL-4、IL-6、IL-1β、GSH-Px、SOD 的OD 值,并通过标准曲线计算样品中对应因子的浓度。
(2)海马区HE 染色:将大鼠脑组织进行常规脱水、包埋、冰冻切片操作。加入HE 染色,20 min 二甲苯透明,并采用中性树脂封片。选择海马区域5个视野(400 倍),于光学显微镜下观察其形态学变化。
(3)蛋白质印迹法:取出海马组织进行碾磨、裂解、提取蛋白操作。用含有蛋白质酶抑制剂的裂解液制备海马组织蛋白质提取物,应用BCA 法检测蛋白浓度。加入10% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)完分离蛋白质,并转移到硝酸纤维素膜上,并将膜在5%脱脂乳中封闭 1 h。采用去离子水稀释Tris-HCl 缓冲盐溶液一抗(1∶1 000),保持 4 ℃孵育过夜;TBS 漂洗3 次,每次3 min,再加入兔抗鼠二抗稀释液(1∶8 000),保持37 ℃恒温箱内避光孵育2 h,进行3 次同样的漂洗,应用电化学发光(electrochemiluminescence,ECL)显影液显色,并采用凝胶成像系统完成胶片曝光和成像操作,采用软件测量相应蛋白条带灰度值[肿瘤坏死因子α(tumor necrosis factor,TNF-α)、人核因子κB(nuclear factor kappa B,NF-κB)]。
1.6 统计学方法使用SPSS 23.0 软件进行数据分析,计量资料以±s表示,计量资料采用单因素方差分析,多组之间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组大鼠焦虑情绪比较假手术组大鼠TE、
OE、OT均高于治疗组、模型组大鼠,治疗组大鼠TE、OE、OT均高于模型组(P<0.05)。见表1。
表1 三组大鼠焦虑情绪比较/± s
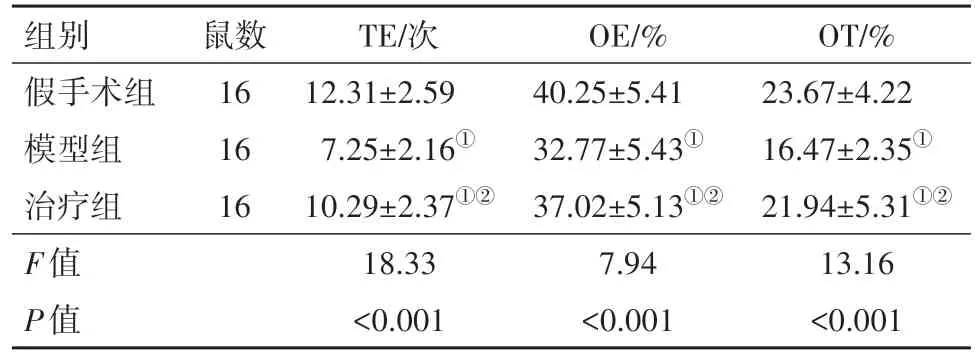
表1 三组大鼠焦虑情绪比较/± s
注:TE为总穿臂次数,OE为进入比例,OT为停留时间比例。①与假手术组比较,P<0.05。②与模型组比较,P<0.05。
?
2.2 三组大鼠海马神经炎症因子的比较假手术组大鼠IL-4、IL-6、IL-1β 均低于治疗组、模型组大鼠,治疗组大鼠IL-4、IL-6、IL-1β 均低于模型组(P<0.05)。见表2。
表2 三组大鼠海马神经炎症因子比较/(ng/L,± s)
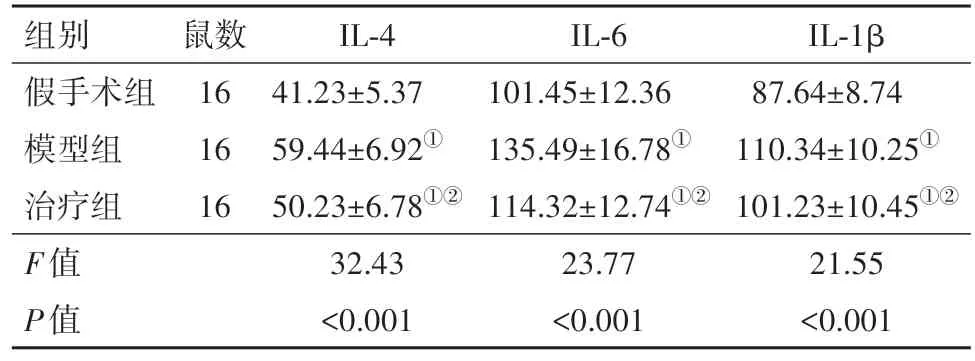
表2 三组大鼠海马神经炎症因子比较/(ng/L,± s)
注:IL为白细胞介素。①与假手术组比较,P<0.05。②与模型组比较,P<0.05。
?
2.3 三组大鼠海马神经氧化应激因子比较假手术组大鼠GSH-Px、SOD 均高于治疗组、模型组大鼠,MDA 低于两组;且治疗组大鼠GSH-Px、SOD 均低高于模型组,MDA低于该组(P<0.05)。见表3。
表3 三组大鼠海马神经氧化应激因子比较/± s

表3 三组大鼠海马神经氧化应激因子比较/± s
注:GSH-Px 为谷胱甘肽过氧化物酶,SOD 为超氧化物歧化酶,MDA为丙二醛。①与假手术组比较,P<0.05。②与模型组比较,P<0.05。
?
2.4 大鼠海马组织病理形态分析假手术组大鼠(图1A)海马神经元呈现排列规则、分布均匀特征,且胞体无空泡症状。模型组大鼠(图1B)表现出部分海马区域神经元散乱特征,可见点状软化灶,且胞体表现出空泡现象,神经细胞存在崩解、碎裂、深染等明显凋亡特征。治疗组大鼠(图1C)神经元损伤现象出现好转,其海马区域神经元呈现排列相对规则、分布相对均匀特征,且变形坏死的细胞数量较模型组明显较少,但仍存在部分细胞空泡化。

图1 大鼠海马组织神经元排列特征( HE染色×200):A为假手术组;B为模型组;C为治疗组
2.5 三组大鼠海马组织蛋白表达量比较假手术组大鼠NF-κB、TNF-α 蛋白表达均低于治疗组、模型组大鼠,差异有统计学意义(P<0.05);而治疗组大鼠NF-κB、TNF-α 蛋白表达均低于模型组,差异有统计学意义(P<0.05)。见图2;表4。
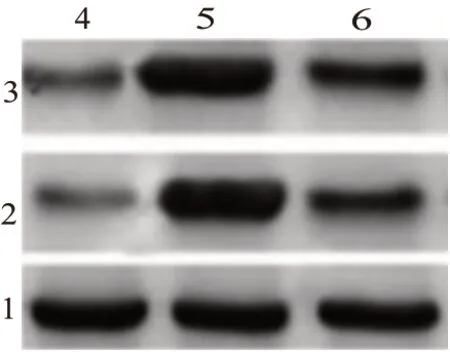
图2 各组大鼠海马NF-κB、TNF-α蛋白表达电泳
表4 三组大鼠海马组织蛋白表达量的比较/± s

表4 三组大鼠海马组织蛋白表达量的比较/± s
注:TNF-α为肿瘤坏死因子α,NF-κB为核因子κB。①与假手术组比较,P<0.05。②与模型组比较,P<0.05。
?
3 讨论
很多研究显示,骨折后疼痛、外科手术治疗应激反应不仅会增加躯体痛苦感觉,还易诱发抑郁不良情绪[15-20]。因此有必要加强骨折导致的焦虑情绪病人临床管理,干预致病病理机制,降低疾病风险。加巴喷丁属于GABA结构类似物,既往研究证实,该药物具有良好镇痛效应,其药理机制通过结合突触前膜钙通道GABA亚型,发挥抑制钙离子内流功效,继而阻断神经细胞的病理传导通路,减少兴奋性递质浓度,阻断神经凋亡途径及相关蛋白[21-22]。
近年来相关研究发现加巴喷丁有着确切海马功能及神经保护作用。Swartzwelder 等[23]研究显示,加巴喷丁可以通过拮抗血小板反应蛋白 (TSPs) 与α2δ-1 受体的相互作用,逆转或改善青少年间歇性乙醇 (AIE)对海马功能的影响。臧颖卓等[24]研究显示,加巴喷丁可以通过抑制海马神经元组织学改变,影响凋亡相关基因P75NTR 表达,发挥神经保护作用。本研究结果显示,治疗组大鼠TE、OE、OT 均高于模型组。说明骨折状态下,大鼠出现焦虑情绪较高;而加巴喷丁应用可以改善焦虑症状。治疗组大鼠神经元损伤现象出现好转,其海马区域神经元呈现排列相对规则、分布相对均匀特征,且变形坏死的细胞数量较模型组明显较少,但仍存在部分细胞空泡化。说明加巴喷丁可以减轻海马区神经元损伤及凋亡。其原因可能是病理状态下,炎症因子升高将影响血脑屏障通透性,增加氧自由基水平,继而导致海马神经元凋亡,促使其细胞加速死亡[25]。而加巴喷丁可以通过干预炎症机制,保护神经元,修复海马神经元形态,维持神经突触可塑性。
治疗组大鼠IL-4、IL-6、IL-1β、MDA 均低于模型组,GSH-Px、SOD 均高于模型组。治疗组大鼠NFκB、TNF-α 蛋白表达均低于模型组。说明加巴喷丁可以改善海马区神经炎症状态。NF-κB、TNF-α 炎症因子可以激活神经病理状态,对5-HT释放及合成产生影响,继而增加焦虑病情。该药物可以改善骨折引起的焦虑状态,其作用机制可能与下调海马神经炎症因子表达,减少NF-κB/TNF-α 信号通路含量,继而改善海马神经元认知功能障碍有关。
综上所述,骨折导致大鼠焦虑情绪增加,而加巴喷丁可以有效削弱骨折大鼠的焦虑情绪,可能与加巴喷丁减弱海马炎症反应有关,从而增强NF-κB/TNF-α信号通路对海马神经的保护作用。
