NOD样受体蛋白3炎症小体在多柔比星诱导心脏毒性中的意义
2024-04-24黄亚晓何新雨曾小娟胡世娇乔文伟张锦
黄亚晓,何新雨,曾小娟,胡世娇,乔文伟,张锦
作者单位:1兰州大学第一临床医学院,甘肃 兰州 730000;
2兰州大学第一医院心内科,甘肃 兰州730000
手术、放化疗、靶向治疗、免疫治疗等治疗方式使恶性肿瘤治疗取得了长足的进步,肿瘤病人的生存期也得到大幅延长。多柔比星(doxorubicin,DOX)是一种广谱的蒽环类抗生素。在抗肿瘤的同时也可导致剂量依赖性的心脏毒性,最终可能发展为充血性心力衰竭和死亡[1]。此外,DOX 使用周期长和年龄(如儿童)、糖尿病或心血管疾病(如高血压、高血脂或动脉粥样硬化)等更易导致这些并发症,吸烟、肥胖或不运动也会增加心脏毒性风险[2]。因此,仍然迫切需要确定新的药理靶点,以减轻多柔比星诱导心脏毒性(doxorubicin-induced cardiotoxicity, DIC)作用。作为感染和外部刺激的传感器,含有NOD 样受体蛋白3(NOD-like receptor protein 3, NLRP3)炎症小体的核苷酸结合寡聚化结构域(NOD)样受体家族pyrin 结构域在各种疾病的病理过程中起着关键作用。有趣的是,降低NLRP3 炎症小体的活性可减轻DIC。因此,针对这一发现,我们回顾并梳理了目前关于NLRP3 炎症小体在DIC 中潜在意义的研究。
1 NLRP3炎症小体结构与功能
NLRP3 是一种模式识别受体(pattern recognition receptor, PRR),识别细菌和病毒性病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),但也识别与组织和细胞损伤有关的多种危险相关分子模式(damage-associated molecular patterns, DAMPs)。PAMP 或DAMP,或细胞因子如肿瘤坏死因子(tumournecrosis factor,TNF)和白细胞介素-1β(interleukin-1β, IL-1β)可识别PRR 如Toll 样受体(toll-like receptor,TLR)、白细胞介素-1受体(interleukin-1 receptor, IL-1R)激活炎症小体[3]。NLPR3 炎症小体的激活需要两个阶段,首先,DAMPs 或PAMPs 识别TLR,激活核因子κB (nuclear factor kappa-B, NF-κB) 通路,导致NLRP3 和白细胞介素-1β 前体 (pro-Interleukin-1β, pro-IL-1β)和pro-IL-18 的产生。其次,由NLRP3 蛋白、凋亡相关斑点样蛋白(apoptosis- associated speck- like protein containing a CARD,ASC),和胱天蛋白酶-1 的前体(pro-caspase-1)组成 NLRP3 炎症小体,使pro-caspase-1 切割成活性形式的caspase-1, 进而pro-IL-1β 和pro-IL-18 形成生物活性IL-1β 和IL-18,诱导炎症反应[4]。激活的Caspase-1 识别和切割引起GSDMD 激活并在细胞膜中形成GSDMD 通道,引起细胞凋亡[5]。线粒体功能障碍及活性氧(reactive oxygen species,ROS)的产生,胞质钙超载、钾外流、氧化应激(oxidative stress,OS)和溶酶体损伤等均可诱导NLRP3炎症小体的激活和组装[6]。
2 NLRP3炎症小体在DIC中的作用
DOX 是一类抗癌药物,用于白血病、淋巴瘤、膀胱癌、乳腺癌、小细胞肺癌和其他实体瘤等多种癌症的治疗。DOX 可插入DNA 双螺旋的碱基抑制DNA 和RNA 的合成,也可与DNA 反应并引发细胞凋亡。目前,研究人员认为DIC 的原因主要与线粒体功能障碍、ROS 产生、OS、炎症反应、细胞焦亡等相关[7-8]。因心肌细胞富含线粒体,缺乏抗氧化酶,可产生大量ROS,ROS 可激活NLRP3 及后续因子的释放,更易使心脏产生毒副作用。另一些研究证明,15 mg/kg 的DOX 足以建立心脏毒性小鼠模型[9]。NLRP3 炎症小体的活性被抑制改善了DOX 诱导小鼠或大鼠的左心室收缩功能障碍和心肌细胞死亡[10-11]。强调了NLRP3 炎症小体在DIC 中的重要作用。
NLRP3 炎症小体激活的两个阶段:(1)DAMPs或PAMPs 结合细胞膜上TLR,激活NF-κB 通路,导致NLRP3、pro-IL-1 和pro-IL-18 的产生或激活。(2)组装(NLRP3、ASC、pro-caspase-1)成NLRP3 炎症小体,进而pro-caspase-1 转化成生物活性形式的caspase-1,促进pro-IL-1β 和pro-IL-18,形成成熟体IL-1β和IL-18,诱导炎症反应。激活:线粒体功能障碍及ROS的产生、胞质钙超载、钾外流、OS和溶酶体损伤、DAMPs或PAMPs、IL-1β等。
NLRP3 炎症小体是一个复杂的调节蛋白网络,可启动炎症反应,越来越多的证据表明,在DIC的发展中,NLRP3 炎症小体的激活及后续炎症细胞因子的分泌起着核心作用。例如,Zhu 等[12]对小鼠腹腔注射DOX 后发现,空泡化心肌细胞显著增多及肌原纤维紊乱,这两者都是心脏损伤的标志。同时,检测血清和心脏组织中IL-1β 水平显著增加,并呈剂量依赖性,推测IL-1信号可能部分参与DOX 诱导的急性心脏损伤[12]。同样,Sauter等[13]在ASC、caspase-1 或NLRP3 缺陷的小鼠骨髓源性巨噬细胞中,DOX未能诱导IL-1β 的释放,这表明DOX 诱导的炎症是由NLRP3炎症小体介导的。另外研究表明,DOX 还可通过诱导TINCR(terminal differentiation-induced lnc RNA,TINCR)基因启动子区的H3K27 乙酰化并激活心肌细胞中的转录,增加了TINCR 的表达。通过胰岛素样生长因子ⅡmRNA 结合蛋白1(IGF2BP 1)增加mRNA 的稳定性,增强TINCR 上调NLRP3 的表达的作用,激活caspase-1 和GSDMD 途径[14]。MCC950(NLRP3 抑制剂)可使DOX 诱导小鼠和H9c2 细胞中NLRP3、ASC、caspase-1、IL-1β、IL-18 和GSDMD的表达水平降低,进而抑制细胞凋亡[15]。因此,DOX 诱导的心脏损伤与NLRP3炎症小体活化存在相关性。
机制上,ROS 可激活NLRP3 炎症小体。线粒体功能障碍可使ROS 产生增加,Catanzaro 等[16]发现,线粒体内DOX 的浓度达到50~100 μmol/L 时,可使ROS 产生增加。同样,在DOX 诱导的扩张性心肌病模型小鼠中,经DOX 治疗可激活调控动力相关蛋白1 进而上调NOX1[烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶1]和NOX4 的表达,诱导线粒体分裂,ROS 积聚,导致NLRP3 炎症小体通过caspase-1依赖性方式介导心肌细胞焦亡[17]。另一项研究也表明,DOX 诱导小鼠心肌和心肌细胞凋亡,同时ROS 过度产生,NLRP3、ASC 和caspase-1 p20 表达上调,以及心肌细胞中IL-1β分泌增加[18]。 此外,核因子红细胞2 相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)是参与细胞对ROS 反应的重要信号分子。DOX 可以通过激活Nrf2 信号通路以上调P-gp 表达来增加ROS[19]。并在DOX 诱导急性心脏毒性的心肌细胞观察到Nrf2 mRNA 和Nrf2 蛋白表达水平降低[20]。因此,NOX1、NOX4、Nrf2 可通过ROS-NLRP3在DIC中发挥一定的作用。
DOX还被证明通过抑制sirtuin家族的成员来干扰线粒体功能,sirtuiin 家族催化组蛋白和非组蛋白赖氨酸残基的脱乙酰化。DOX 治疗可以抑制小鼠心脏以及H9c2 和原代心肌细胞中SIRT3 的表达[21]。SIRT3 的过度表达减少了ROS 水平,保护了线粒体功能,并保护线粒体DNA 免受DOX 治疗的损伤[[22]。SIRT1 是另一个sirtuin 家族成员,一种烟酰胺腺嘌呤二核苷酸依赖性的Ⅲ类组蛋白去乙酰化酶,通过增强自噬和减少因缺氧诱导的细胞凋亡,对心肌细胞发挥保护作用[23]。DOX 抑制SIRT1 的表达。SIRT1 缺失会加重DOX 诱导的细胞毒性,并破坏线粒体功能[24]。而SIRT1 的过度表达抑制DOX 诱发的细胞凋亡和ROS 产生[25]。DOX 下调H9c2 细胞和小鼠心脏组织中的SIRT1 表达并激活NLRP3 炎症小体和增加硫氧还蛋白相互作用蛋白(thioredoxin interacting protein, TXNIP)水平,促进心肌细胞凋亡[26]。此外,DOX 诱导的H9c2 心肌细胞衰老依赖于硫氧还蛋白相互作用蛋白(TXNIP)/NLRP3 炎症小体途径[27]。总之,sirtuins 可以调节线粒体功能,从而促进心肌细胞存活。这些实验确定了sirtuin作为DOX诱导的心脏毒性的潜在治疗靶点。
丝氨酸/苏氨酸蛋白激酶(mitogen-activated protein kinase, MAPK)具有调节细胞增殖、分化、凋亡等作用,由p38 MAPK 丝裂原活化蛋白激酶(p38 Mitogen-activated protein kinases, p38 MAPK)、c-Jun 氨基末端激酶(c-Jun N-terminal kinase, JNK)和细胞外调节蛋白激酶(extracellular signal regulated kinase, ERK)组成。DOX 治疗显著增加了小鼠TLR4、NLRP3、caspase-1、IL-1β、IL-18、TNF-α 和细胞信号蛋白(MyD88、p-P38 和p-JNK)的心脏表达[28]。在髓样分化蛋白1(MD-1)基因敲除小鼠中,Zhang 等[29]观察到,DOX 可加速心功能障碍和心肌损伤、促进细胞凋亡,可能通过激活TLR4/MAPKs/NF-κB 途径实现的。因此,DOX 还可作用于TLR4/MAPKs 进而导致NLRP3 激活致心脏损伤。尽管有令人信服的证据表明,在DOX 处理的小鼠中,抑制NLRP3 炎症小体的激活具有心脏保护作用,但独立于炎症小体NLRP3 活性也可能是对DOX 的保护作用的原因[30]。
总之,NLRP3 炎症小体通过诱导心肌细胞凋亡、焦亡和心肌炎症反应参与DIC的发生和发展,但具体机制目前尚不清楚。
3 抑制NLRP3对DIC防治的作用研究
近年来,有很多研究者发现使用某些天然化合物、药物、其他等可通过靶向多种途径中的一种或多种途径抑制NLRP3 炎症小体的激活,减轻DIC。见表1。
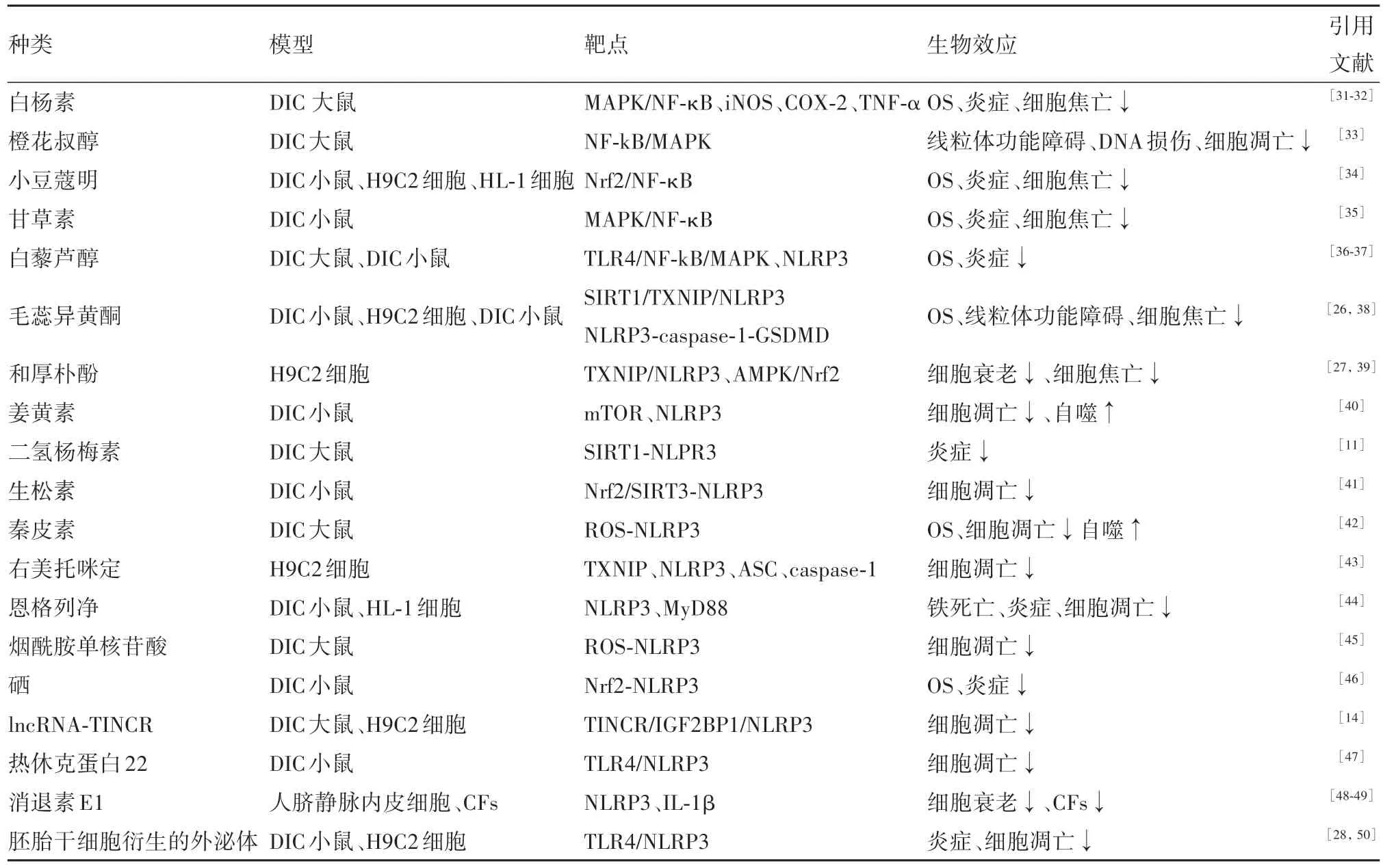
表1 关于天然化合物、药物、其他等通过抑制NLRP3炎症小体激活治疗DIC的总结
综上所述,大量研究证实了NLRP3 炎症小体在DOX 治疗引起细胞死亡和炎症反应中所起的核心作用。DOX 诱导的心脏炎症涉及多种途径,NLRP3的过度表达加重了DOX 诱导的心脏损伤。同时,NLRP3 炎症小体的下调有效地预防了DOX 引发的心脏毒性。因此,抑制NLRP3 炎症小体激活可能是防止DIC 的有效方法。然而,上述研究大多在细胞和动物模型上开展,缺少在人体内的研究,更缺乏临床随机对照试验的研究加以支持。此外,天然化合物、药物、其他等虽可改善DIC,但是我们期待临床试验进一步证实临床效果,寻找可为临床使用的易于获取的能抑制NLRP3 炎症小体的抗炎药物,从而改善DIC病人的预后。
