基于全长转录组测序的掌叶大黄bZIP基因家族鉴定分析
2024-04-24胡晓晨李依民
唐 璟,杜 桥,胡晓晨,李依民,高 静,彭 亮,张 岗
(1.陕西中医药大学药学院 / 陕西省秦岭中草药应用开发工程技术研究中心, 陕西 西安 712046;2.陕西中医药大学省部共建特色秦药资源研究开发国家重点实验室(培育), 陕西 咸阳 712083;3.陕西中医药大学陕西省中医药管理局“秦药”研发重点实验室, 陕西 西安 712046)
bZIP (basic leucine zipper)转录因子是真核生物中数量最大、最保守的基因家族之一,该家族成员均含有由一个碱性区域 (basic region) 和一个亮氨酸拉链结构域 (leucine zipper) 组成的特征保守结构域[1]。碱性区域含有一个核定位信号和一个保守的N-X7-R/K 结构,可特异性结合DNA;而亮氨酸拉链区域为L-X6-L-X6-L 结构,具有二聚化能力,该区域形成二聚体后依赖于碱性区域结合在双链DNA 分子上发挥作用[2]。bZIP 转录因子可特异性结合DNA启动子区的ACGT 核心顺式作用元件,如ABRE(ABA-responsive element)、A-box (TACGTA)、C-box(GACGTC)、G-box (CACGTG),从而调节下游基因的表达[3-4]。
许多bZIP 转录因子在植物体内的生物功能已被阐明,广泛参与调控植物体生长发育、次生代谢物合成及逆境胁迫等生物学过程。在拟南芥(Arabidopsis thaliana) 中,bZIP17与bZIP28一起介导细胞生长的多个基因的非诱导表达,从而调控根的伸 长[5]。ABA 反 应 元 件 结 合 因 子 (ABA-responsive element binding factors)ABF2、ABF3、ABF4通过转录激活叶绿素分解代谢基因和衰老相关基因,促进脱落酸 (abscisic acid, ABA) 介导的叶绿素降解和叶片衰老[6]。TabZIP74正调控小麦 (Triticum aestivum) 条锈病抗性[7]。此外,bZIP 转录因子参与激素信号转导,激活某些次生代谢物的生物合成通路基因表达,影响次生代谢物的合成。葡萄 (Vitis vinifera)VvibZIPC22可激活类黄酮合成途径关键基因的启动子进而指导黄酮醇生物合成[8]。DkbZIP5通过结合DkMYB4启动子区域的ABRE 元件,并以依赖ABA 的方式,调控参与原花青素生物合成的基因DkMYB4的 表 达[9]。 TGACG 结 合 因 子 (TGACG motif-binding factors)TGA6通 过 响 应 水 杨 酸 信 号 调控黄花蒿 (Artemisia annua) 中青蒿素的生物合成[10]。AabZIP1在ABA 诱导下直接结合AaMYC2的启动子而上调其表达,从而正向调控青蒿素的生物合成[11]。同时,药用植物bZIP基因通过介导MeJA 信号转导通路参与次生代谢物合成。雷公藤 (Tripterygium wilfordii)TwTGA1受 茉 莉 酸 甲 酯 (methyl jasmonate,MeJA) 诱导,能调节长春花生物碱合成[12]。在MeJA 诱导下,bZIP17和bZIP60参与调控紫花苜蓿 (Medicago sativa) 三萜皂苷生物合成[13]。
蓼科大黄属多年生高大草本植物掌叶大黄(Rheum palmatum) 是我国传统大宗药材大黄的基源之一,因其喜凉爽湿润气候,故多分布于中国甘肃、四川、青海、陕西等高海拔区域,今多为栽培品[14]。大黄以干燥根及根茎入药,性味苦、寒,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄等功效[15]。大黄含有蒽醌类、黄酮类等化学成分,其中蒽醌类和蒽酮类为大黄的特征性成分,也是大黄发挥药效的主要活性成分[16]。次生代谢产物生物合成途径复杂,通过转录因子调控其中的一系列关键酶基因的表达,进而影响药材品质形成[17-18]。鉴于bZIP 转录因子对植物次生代谢产物合成的调控作用,掌叶大黄bZIP 转录因子的鉴定和功能研究尚未报道。为此,本研究基于三代全长转录组测序挖掘掌叶大黄bZIP 转录因子家族,对该家族成员进行特征分析,同时结合RNA-seq 数据分析RpbZIPs基因在不同器官及MeJA 处理下的表达模式,为进一步研究大黄bZIP 转录因子的生物学功能奠定基础。
1 材料与方法
1.1 主要仪器和试剂
MeJA、无 水 乙 醇;RN38-EASYspin Plus 植 物RNA 提 取 试 剂 盒 (Aidlab 公 司); PrimeScript™RT Master Mix 反 转 录 试 剂 盒、TB Green®Premix ExTaq™ Ⅱ (TliRNaseH Plus) (TaKaRa 公司)。K5800 自动检测超微量分光光度计 (凯奥公司)、StepOnePlus™Real-Time PCR (qPCR) 仪 (美 国Applied Biosystems公司)。
1.2 材料
掌叶大黄一年生植株和成熟种子于2021 年8 月采集于甘肃中医药大学和政药用植物园,经陕西中医药大学胡本祥教授鉴定。
取一年生植株3 株,将叶、根、根茎3 个部位各等量混合后,由广州基迪奥生物科技有限公司测序分析。在每个装有200 g 泥炭土 (klasmann) 的塑料花盆中 (黑色,直径9 cm、高12.5 cm)点播4 颗大小均匀、饱满的掌叶大黄种子,培养条件光周期为光照16 h、黑暗8 h,光照强度9 000 lx,温度(23 ± 2) ℃。首次浇水200 mL,之后每3 d 浇水50 mL。选取完整均匀的一月龄幼苗,激素处理组对整株喷施200 μmol·L-1MeJA,对照组喷施溶剂,所有样品进行生物学重复3 次,分别于处理后12 h 取样,将根和叶等量混合于液氮中速冻,进行RNA-Seq 分析。
选取长势均匀、完整的一月龄幼苗,处理组喷施200 μmol·L-1MeJA,对照组喷施溶剂(将助溶剂95%乙醇与试验组相同倍数进行稀释);两组均设置0 h 为空白对照,Mock 为溶剂对照,所有样品重复3 次,分别于处理后3、6、12 和24 h 进行取样,于液氮速冻后置-80 ℃冰箱保存,供后续qRT-PCR 验证分析。
1.3 全长转录组测序及RpbZIP 鉴定
掌叶大黄全长转录组测序数据为课题组前期所构建[19]。使用BlastX (http://www.ncbi.nlm.nih.gov/BLAST/) 将全长转录组测序所得完整的isoform 在Nr (http://www.ncbi.nlm.nih.gov)、SwissProt (http://www.expasy.ch/sprot) 和KEGG (http://www.genome.jp/kegg)数据库中进行功能注释分析。
将预测的蛋白序列与Plant TFDB (http://planttfdb.gao-lab.org/) 进行 hmmscan 比对,将预测到的TF 进行归类后,从中筛选bZIP 转录因子家族基因。通过BlastX 比对、ORF Finder 分析筛选出具有完整ORF的bZIP全长基因。利用NCBI-CD search 和ExPASy(https://prosite.expasy.org/prosite.html) 验 证 编 码 蛋 白的保守结构域。
1.4 蛋白序列特征分析
利用ProtParam (https://web.expasy.org/protparam/)和SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_autom at.pl?page=npsa_sopma.html) 对 掌 叶 大 黄bZIP 转 录因子蛋白质理化性质进行分析;用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/) 进行亚细胞定位;利用软件Jalview (https://www.jalview.org/download/)的MAFFT 功能进行多序列比对;MEME(https://meme-suite.org/meme/tools/streme) 进行Motif分析,并用TBtools 进行可视化。
1.5 系统进化分析
以已鉴定完成的拟南芥bZIP 氨基酸序列为参照,使用MEGA 7 将掌叶大黄与拟南芥的bZIP 蛋白序列进行系统进化分析 (采用邻接法,Bootstrap 为1 000 次)。
1.6 基因表达模式分析
基于掌叶大黄不同部位的RNA-Seq 转录组测序数据,分析bZIP 转录因子基因表达差异 (以FPKM 值计算);另从MeJA 处理的掌叶大黄转录组数据中筛选显著差异表达的RpbZIP基因 (FDR <0.05 且|log2FC| > 1)。二者均用TBtools 进行均一化和可视化绘图。
1.7 qPCR 验证
基于RNA-Seq 转录组测序数据选择MeJA 处理后表达显著上调或下调的RpbZIP基因进行qPCR验证,以β-actin[20]为内参基因。利用NCBI-Primer(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi )设计引物 (表1),由北京奥科合成引物。用RN38-EASYspin Plus 植物RNA 快速提取试剂盒提取植物总RNA,1.0%琼脂糖凝胶电泳和K5800 超微量分光光度计用于检测RNA 的质量。用反转录试剂盒(PrimeScript™ RT Master Mix) 合 成cDNA 第 一 链。qPCR 反应按照TB Green®Premix ExTaq™ (TaKaRa,RR420A, 中国) 试剂盒说明书配置10 μL 体系。反应程序:预变性95 ℃ 30 s,变性 95 ℃ 5 s,退火 60 ℃30 s,延伸 60 ℃ 34 s, 40 个循环。技术重复和生物重复各3 次,应用2-ΔΔCt法计算基因的相对表达量。

表1 掌叶大黄bZIP 基因qPCR 引物Table 1 The qPCR primers for bZIPs genes in Rheum palmatum
1.8 数据处理
利用SPSS 26 软件对掌叶大黄bZIP基因响应外源激素的表达量进行方差分析和显著性检验,并使用Graphpad 8.0 绘图。P< 0.05 代表有显著性差异。
2 结果与分析
2.1 RpbZIPs 基因鉴定及蛋白理化性质分析
从掌叶大黄全长转录组中鉴定到63 个具有完整结构域的全长RpbZIPs,按照RNA-Seq 中的isoform顺序将其重命名为RpbZIP1~RpbZIP63。RpbZIPs蛋白理化性质分析发现,RpbZIPs基因编码蛋白的氨基酸残基数目为144 (RpbZIP54)~787 (RpbZIP1)aa (表2),分子量16 457.34~85 075.16 Da,等电点为5.04 (RpbZIP55)~10.10 (RpbZIP59),说明主 要为中性和碱性蛋白;RpbZIP10和RpbZIP34所编码的蛋白不稳定系数分别为27.80 和30.23,为稳定蛋白,其余蛋白不稳定系数均大于40,为不稳定蛋白;脂肪系数为50.84 (RpbZIP7)~87.62 (RpbZIP19);总平均亲水性均为负值,均为亲水性蛋白。除了RpbZIP60和RpbZIP63没有β 转角,其余61 个RpbZIPs均由α 螺旋、延伸链、β 转角和无规卷曲结构组成,且以α 螺旋和无规则卷曲为主。
2.2 RpbZIPs 转录因子系统发育分析
利用MEGA 7.0 构建RpbZIPs 与拟南芥AtbZIPs转录因子的进化关系 (图1) 。根据拟南芥的分组规则将所有bZIPs 分为13 个亚族 (A~K 和M、S),除了J 和M 亚族无掌叶大黄bZIP 成员,其他11 个亚族都同时含有拟南芥和掌叶大黄bZIP 成员。其中,A 组成员最多,包含RpbZIP 成员12 个,AtbZIP 成员13个;I 组所含RpbZIP 成员最多,为14 个,而拟南芥有10 个成员,掌叶大黄的I 家族成员可能发生复制事件;M 和J 组均只包含1 个AtbZIP 成员。
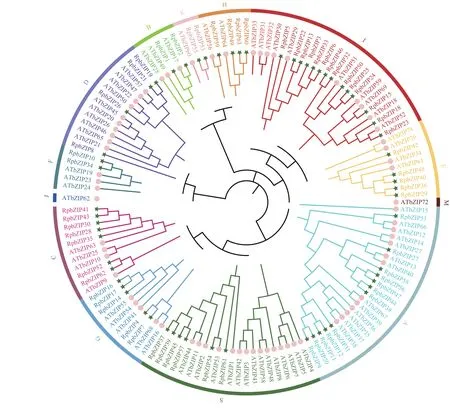
图1 掌叶大黄与拟南芥bZIP 成员系统发育关系Figure 1 Phylogenetic relationships of Rheum palmatum and Arabidopsis bZIP members
2.3 RpbZIPs 蛋白结构分析
RpbZIPs 多序列比对结果表明,63 个RpbZIPs蛋白都包含典型的bZIP 家族结构域 (图2) ,即碱性区域和亮氨酸拉链结构域。该碱性结构域包含一个保守的N-X7-R/K 结构,其次是两个保守的碱性氨基酸精氨酸 (R) 和赖氨酸 (K);亮氨酸拉链结构域的特征为L-X6-L-X6-L,碱性区域和第一个亮氨酸相对保守。此外,发现保守区域部分氨基酸被疏水残基取代,其中RpbZIP8 碱性区域的R / K 被一个异亮氨酸 (I) 取代;亮氨酸拉链的部分亮氨酸被异亮氨酸、缬氨酸 (M)、甲硫氨酸 (F) 等疏水氨基酸取代。
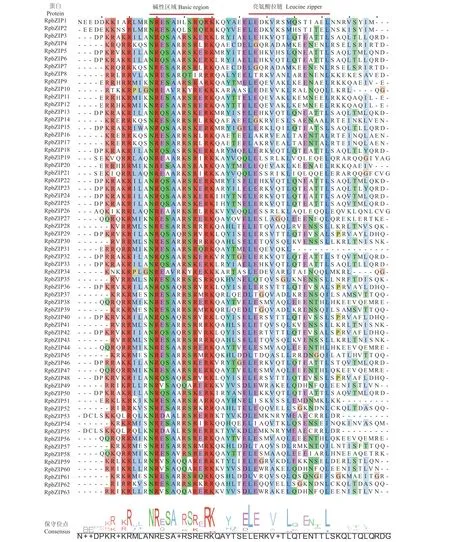
图2 RpbZIPs 多序列比对Figure 2 Sequence alignment of RpbZIPs
使用MEME 对63 个RpbZIPs 蛋白进行保守基序分析 (图3),共鉴定了12 个Motif,所有RpbZIP 蛋白均含有典型碱性亮氨酸拉链基序Motif1,Motif2只存在于I 和E 亚族,Motif3 只存在于S 和C 亚族,Motif4 为I 亚族特有基序,Motif6、Motif8、Motif12仅于A 亚族部分成员中发现。同一亚族内RpbZIPs所含Motif 的种类和总体分布相似,同一亚族内的RpbZIPs 可能有相似的功能。
2.4 RpbZIPs 基因表达模式分析
基于转录组数据,对63 个RpbZIPs在掌叶大黄叶、根及根茎3 个部位的基因表达进行热图聚类分析。RpbZIPs基因表达具有组织特异性,23 个RpbZIP基因主要在叶中表达 (图4A);39 个RpbZIP基因主要在根或根茎中表达;RpbZIP49在3 个部位中均无表达。其中有部分处于同一亚族的RpbZIP基因的表达模式相似,可能在相同的部位共同发挥功能,如E 亚族的RpbZIP29、RpbZIP36、RpbZIP40、RpbZIP42、RpbZIP48和H 亚族的RpbZIP60、RpbZIP63等。

图4 掌叶大黄不同组织及MeJA 处理12 h 后RpbZIP 基因的表达热图Figure 4 Expression heat map of RpbZIP genes in different tissues and RpbZIP genes at 12 h after MeJA treatment
基于MeJA 处理12 h 的大黄幼苗的转录组数据,筛选出13 个显著差异表达的RpbZIPs基因。热图聚类分析结果表明,7 个RpbZIP基因 (RpbZIP14、RpbZIP16、RpbZIP17、RpbZIP30、RpbZIP41、RpbZIP43、RpbZIP61) 在MeJA 处理12 h 后基因表达上调 (图4B),6 个RpbZIP基 因 (RpbZIP19、RpbZIP23、RpbZIP26、RpbZIP36、RpbZIP42、RpbZIP59) 表达下调。同时发现,RpbZIP16、RpbZIP17、RpbZIP61等基因在大黄药用部位根和根茎中的表达量较高且响应MeJA。
2.5 RpbZIPs 候选基因的表达验证
以MeJA 处理0 、3 、6、12、24 h 的掌叶大黄幼苗为材料,以MeJA 差异表达候选的6 个基因为候选基因,进行RpbZIP基因表达qPCR 验证 (图5)。以0 h (CK) 作 为 空 白 对 照,Mock 作 为 溶 剂 对 照,RpbZIP14、RpbZIP16、RpbZIP17、RpbZIP61在 处 理12 h 的表达量高于溶剂对照组,RpbZIP26、RpbZIP42在MeJA 处理12 h 的表达量低于溶剂对照组,与转录组测序基本一致。

图5 MeJA 处理下RpbZIP 基因的相对表达量Figure 5 Relative expression levels of RpbZIP genes under MeJA treatment
RpbZIP14、RpbZIP16、RpbZIP61在MeJA 处理3 h的表达量均达到峰值,RpbZIP14在6 h 开始表达量呈下降再上升趋势;RpbZIP16在3 h 表达量达到峰值为CK 的71.23 倍,之后呈下降趋势;RpbZIP17的表达量在12 h 内持续上调至峰值为CK 的68.75倍;RpbZIP26在MeJA 处理3~24 h 的表达量均低于CK 的0.5 倍;RpbZIP42在24 h 内(除6 h 外)表达量持续下调。
3 讨论
bZIP 转录因子通常以二聚化形式依赖碱性区域特异性结合DNA 启动子区,从而参与基因的表达调控,控制植物体内多种生命过程[21-22]。随着转录组与基因组测序技术的发展,bZIP 在拟南芥[23]、水稻 (Oryza sativa)[24]、玉米 (Zea mays)[25]等植物中已被广泛研究。本研究基于掌叶大黄全长转录组数据,鉴定出63 个RpbZIPs 转录因子基因。其数目少于药用植物丹参 (Salvia miltiorrhiza) (70)[18]、紫花苜蓿 (138)[26]、薏 苡 (Coix lacryma-jobi) (81)[27]、野 菊(Chrysanthemum indicum) (75)[28]等,多于大麻 (Cannabis sativa) (55)bZIP数目[29],说明bZIP基因家族数目在不同物种中变化较大。进一步结合掌叶大黄根、根茎及叶片3 个部位及MeJA 处理的比较转录组数据分析,富集到药用部位中大量表达且同时受MeJA诱导的候选基因,并验证了6 个基因与转录组测序结果基本一致。本研究为后续RpbZIP 功能研究及其调控机制奠定了基础。
RpbZIP 蛋白主要为不稳定亲水蛋白,等电点5.04~10.10,说明RpbZIP 转录因子在多种微环境中发挥作用,二级结构以α-螺旋和无规则卷曲为主。系统进化表明,除J 和M 亚族无RpbZIP 成员外,RpbZIP 家族成员分布在11 个亚族内。多序列比对发现RpbZIP 的碱性结构区域最保守,而亮氨酸区域含有大量的疏水残基,符合bZIP 的结构特征[22]。除了共有保守结构域,RpbZIP 不同亚族之间还存在其他保守位点,其中RpbZIP8 碱性区域的R / K 被一个异亮氨酸 (I) 取代,该特征与黄花蒿中AabZIP78的结构变化相一致[30];E 亚族RpbZIPs 在亮氨酸拉链区域有一个保守的脯氨酸残基,可干扰同源二聚体的形成[31];I 亚族成员在R / K 保守位置均为K,该特征可能与维管束发育功能相关[22]。MEME 分析显示,同亚族RpbZIP 成员拥有相似Motif,结合多序列比对,存在于所有RpbZIP 中的Motif 1 很可能代表bZIP 保守结构域,而其他Motif 可能影响基因家族的功能多样性[32]。
bZIP 各个亚族广泛参与植物生长发育过程,A亚族主要参与ABA 响应和逆境胁迫的转录调控[33];D 亚族 (TGA 因子) 主要参与防御反应及根的生长发育[34-35];F 亚族参与植物锌防御反应和盐胁迫响应[36];H 亚族主要由HYH 和HY5 转录因子组成,参与次生代谢产物生物合成与光信号的转导等[37];而S 亚族的生物功能较为广泛,参与植物生殖发育,还可响应机械刺激、干旱和低温等[22]。H 亚族RpbZIP成员均在叶中表达,根及根茎中几乎无表达,推测这些基因主要参与叶中次生代谢产物生物合成与光信号的转导。S1 组AtbZIP11控制生长素依赖的主根生长[38];AtbZIP1及AtbZIP53在根中控制盐胁迫下的代谢重编程[39],而RpbZIP61在掌叶大黄根及根茎中高表达,且受MeJA 诱导,可能参与根及根茎的发育和代谢。
大量研究表明,bZIP 转录因子可响应各种激素,参与植物生物合成和抗逆相关基因的调控。茉莉酸甲酯作为一种重要的植物激素,在植物防御反应及次生代谢产物生物合成中起着重要的作用[40],常被用于药用植物次生代谢物合成关键转录调控基因挖掘研究。如穿心莲 (Andrographis paniculata)中鉴定发现了7 个ApbZIPs在叶片中表达最高,且MeJA 处理后显著上调,可能参与调控穿心莲内酯的生物合成[41]。本研究利用MeJA 处理12 h 掌叶大黄幼苗转录组数据筛选到13 个显著差异表达的RpbZIPs,结合不同组织部位表达分析,发现RpbZIP16、RpbZIP17、RpbZIP26、RpbZIP61等在掌叶大黄根及根茎中大量表达且响应MeJA 处理。RpbZIP16、RpbZIP17属 于 CPRF1 (Common Plant Regulatory Factor 1) 因 子,受MeJA 诱 导。黄 花 蒿CPRF1 因子AabZIP33和AabZIP38调控蓝光介导青蒿素的生物合成[29];欧芹 (Petroselinum crispum) CPRF1抑制查尔酮合酶 (CHS) 基因的启动子活性,从而下调黄酮类化合物的积累[42]。RpbZIP26属于TGA 因子,MeJA 处理抑制其表达。大多数TGA 因子含有MeJA 反应元件TGACG-基序,在MeJA 处理下主要参与次生代谢产物生物合成及防御相关基因的表达调控[43-44]。因此,响应MeJA 的RpbZIP16、RpbZIP17、RpbZIP26等可能参与大黄次生代谢产物生物合成的转录调控和抗逆反应,其具体功能还有待于后续深入研究。
4 结论
本研究在掌叶大黄全长转录组数据中鉴定到63 个bZIP 转录因子基因家族成员,并分析其编码蛋白理化性质、多序列比对、系统进化等特征。通过比对掌叶大黄不同组织及MeJA 处理的转录组数据,筛选出掌叶大黄药用部位中高表达且可能响应MeJA 的候选基因,并对其基因表达模式进行qPCR验证,进一步明确RpbZIPs对MeJA 的响应特性,为后续RpbZIP 功能研究及大黄次生代谢转录调控机制研究奠定基础。
