乳腺浸润性导管癌肿块大小与多模态超声及免疫指标的相关性分析
2024-04-23李文肖曹春莉马婷石丽楠王子静李军
李文肖,曹春莉,马婷,石丽楠,王子静,李军
根据最新癌症相关统计数据,乳腺癌在全球女性癌症发病率中位居首位,且近几年来发病率及死亡率呈持续增长的趋势,严重威胁着女性的生命健康安全[1,2]。乳腺癌是一种高度异质性的肿瘤,具有侵袭性高且容易复发和转移的特征[3]。乳腺癌的组织学形态及类型众多,不同病理类型的乳腺癌具有不同的影像学表现、组织学分级、生物学指标及进展预后特点[4,5]。既往研究表明不同乳腺癌的超声表现与其分子生物学特点及预后密切相关[6-7]。然而不同研究结果显示浸润性导管癌(invasive ductal carcinoma,IDC)的超声特征及免疫组化指标的改变并不一致,超声检查对于不典型IDC存在一定的漏诊。目前,在临床实践中多联合运用常规超声(conventional ultrasound,CUS)、超声弹性成像及超声造影(contrast-enhanced ultrasonography,CEUS)等多项超声技术对患者进行诊断,一定程度上可减少漏诊及误诊。本研究中回顾性分析了106例IDC患者的临床和影像资料,对比分析多模态超声联合生物学指标对不同大小(>2 cm与≤2 cm)IDC的诊断准确性,旨在为临床治疗提供有价值的影像学信息。
材料与方法
1.研究对象
回顾性分析2017年1月-2022年5月在本院经手术病理证实的106例IDC患者的临床和影像资料。纳入标准:①所有患者术前行CUS、CEUS及声触诊组织成像量化(virtual touch tissue imaging quantification,VTIQ)技术超声检查,在超声影像工作站中可以获得完整的影像视频及图像资料;②手术后有完整的病理检查及免疫组化检测结果;③手术前未接受过穿刺检查及放化疗。排除标准:①临床资料及超声检查资料不全者;②未获得明确病理学诊断结果;③有超声造影检查禁忌证。
本研究经过医院伦理委员会审批同意(KJ2020-059-01),且所有患者签署了知情同意书。
2.超声检查方法
使用Siemens ACUSON S3000彩色多普勒超声诊断仪,配有VTIQ成像软件及超声造影分析软件,选用9L4线阵探头进行扫查,频率为4~9 MHz,机械指数0.08。超声对比剂为SonoVue,加入0.9%的生理盐水5 mL进行稀释。
CUS及CEUS检查步骤:嘱患者平卧位或者侧卧位,双上肢上举,充分暴露双侧乳腺及腋窝。首先对乳腺肿块行CUS检查,记录肿块CUS超声特征位置、纵横比、后方回声衰减、边缘毛刺征和Adler血流分级。CUS扫查后,选择图像最清晰且血流最丰富的切面进入CEUS模式。经肘静脉快速团注4.4 mL造影剂后,紧接着注入5 mL 0.9%的生理盐水冲管,同时按下计时器和存储按钮。嘱患者平静呼吸,实时观察造影动态视频至少2 min并储存图像及视频,记录病灶CEUS超声特征的增强程度、增强顺序、增强速度、增强后有无灌注缺损、增强范围增大与否以及放射状汇聚。
VTIQ检查方法:CUS检查后启动VTIQ模式,取样范围4.0 cm×2.5 cm。当质量模式图呈现均匀绿色时进入速度模式,以病灶内部呈现红色或黄色、周边呈现浅绿或浅蓝色为标准,获取VTIQ剪切波成像速度模式图像。将取样框(1 mm×1 mm)分别置于肿块的剪切波速度(shear wave velocity,SWV)最高和最低区域、肿块周边区域及最高区域同水平的正常腺体区域,当肿块的SWV超过最大速度上限10 m/s时记录为10 m/s。记录VTIQ特征:剪切波速度最大值(SWVmax)、最小值(SWVmin)、周边平均值(SWV周边AVG)、肿瘤SWV最大值与同切面正常腺体SWV最大值的比值(maxSWVR肿瘤/正常乳腺)、最大值与最小值的比值(SWVRmax/min)。所有数据重复测量3次后取平均值。测量时探头与腺体保持垂直且不施压,避开钙化或液化坏死区CUS、VTIQ及CEUS检查均由两位具有7年以上工作经验的超声科医师进行读片分析,当意见不一致时,需由另外一位具有副高及以上职称的医师参与讨论,并最终达成一致意见。
3.免疫学检查
手术切除标本常规进行HE染色,并采用免疫组织化学染色法检测雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮因子受体2(human epidermal growth factor receptor 2,HER-2)和Ki-67的表达情况。ER、PR阳性结果的判断标准均为每个高倍镜视野内阳性细胞数占比≥10%,<10%为阴性;Ki-67表达水平的判断标准:每个高倍镜视野内阳性细胞数占比≤14%定义为低表达,>14%定义为高表达;HER-2表达情况的判断标准:将阴性和+定义为阴性结果,定义为阳性结果,若HER-2为则进行荧光原位杂交检查,如果HER-2基因扩增则判断为阳性,反之则定义为阴性。
4.统计学分析
使用SPSS 26.0软件软件进行数据分析。根据肿块大小,将患者分为>2 cm组(55例)和≤2 cm组(51例)。计量资料服从正态分布者以均数±标准差表示,组间比较采用t检验,不服从者则以M(Q25,Q75)表示,组间比较采用秩和检验;计资料以例数(百分比)表示,组间比较采用卡方检验。采用Pearson或Spearman检验分析两组之间的相关性。以P<0.05为差异有统计学意义。
结 果
1.临床和病理资料
本研究中共收集106个乳腺IDC。其中>2 cm组有55个,包括IDC 38个、IDC伴其它癌17个(原位癌10个、髓样癌4个、黏液癌2个、小叶癌1个);≤2 cm组有51个,包括IDC 33个、IDC伴其他癌18个(原位癌13个、髓样癌2个、黏液癌2个、小叶癌1个)。>2 cm组及≤2 cm组中患者的年龄分别为52.0(47.0,61.0)岁和51.0(47.0,56.0)岁,差异无统计学意义(Z=-1.032,P=0.302>0.05)。
2.多模态超声特征的比较
>2 cm组与≤2 cm组之间各项超声征象和指标的比较结果详见表1,图1、2。

表1 两组之间多模态超声征象和参数的比较
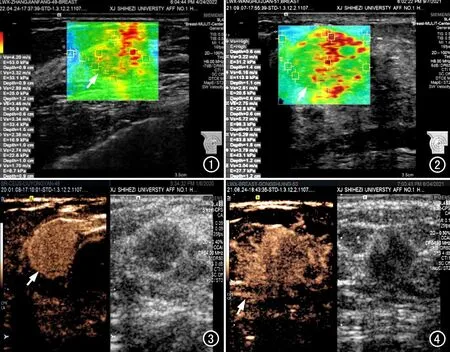
图1 患者女,49岁,病理结果为浸润性导管癌(中分化)伴周边腺病,免疫组化检测显示ER阳性、PR阳性、Her-2阳性和Ki-67高表达。VTIQ超声图像显示肿块(箭)位于右侧乳腺内12点处,大小1.6 cm×1.1 cm,SWVmax=4.20 m/s,SWVmin=2.74 m/s,maxSWVR肿瘤/正常腺体=2.47 m/s,SWVRmax/min=1.53 m/s,SWV周边AVG=3.66 m/s。 图2 患者女,51岁,病理结果为浸润性导管癌,免疫组化检测显示ER强阳性(95%+)、PR阳性、Her-2阴性和Ki-67高表达。超声弹性图像显示肿块(箭)位于右侧乳腺内11点处,大小2.6 cm×1.2 cm,SWVmax=10.00 m/s,SWVmin=3.04 m/s,maxSWVR肿瘤/正常腺体=3.83 m/s,SWVRmax/min=3.28 m/s,SWV周边AVG=7.29 m/s。 图3 患者女,46岁,病理结果为浸润性导管癌(中分化),免疫组化检测显示ER阳性、PR阳性、Her-2阳性和Ki-67高表达。CEUS图像显示右乳肿块大小约1.4 cm×1.3 cm,动脉期病灶内呈快速均匀显著增强,边缘光整(箭),病灶范围较增强前无明显增大。 图4 患者女,50岁,病理结果为浸润性导管癌(中分化),免疫组化检测显示ER阳性、PR阳性、Her-2阴性和Ki-67为高表达。CEUS图像显示左乳肿块大小约2.2 cm×1.6 cm,动脉期病灶内强化早于周围乳腺组织,呈不均匀显著强化,边缘呈放射状汇聚(箭),增强后病灶范围较增强前增大。
在CUS征象中,位置及Adler血流分级在两组之间的差异具有统计学意义(P<0.05);纵横比、后方回声衰减、边缘毛刺征、钙化及淋巴结转移情况在两组之间的差异均无统计学统计学意义(P<0.05)。
在VTIQ定量指标中,SWV周边AVG、maxSWVR肿瘤/正常腺体和SWVRmax/min在两组之间的差异均具有统计学意义(P<0.05);而SWVmax和SWVmin在两组之间的差异均无统计学意义(P<0.05)。
在CEUS征象中,增强程度、增强后放射状汇聚和范围扩大在两组之间的差异均具有统计学意义(P<0.05);增强顺序、灌注缺损和增强速度在两组之间的差异均无统计学意义(P<0.05)。
3.分子生物学指标表达情况的比较
>2 cm组与≤2 cm组之间肿瘤的各项分子生物学指标的表达情况的比较结果见表2。两组之间Ki-67表达水平的差异具有统计学意义(P<0.05),>2 cm组中Ki-67高表达肿瘤的占比高于低表达肿瘤;而ER、PR和HER-2表达水平在两组之间的差异无统计学意义(P>0.05)。
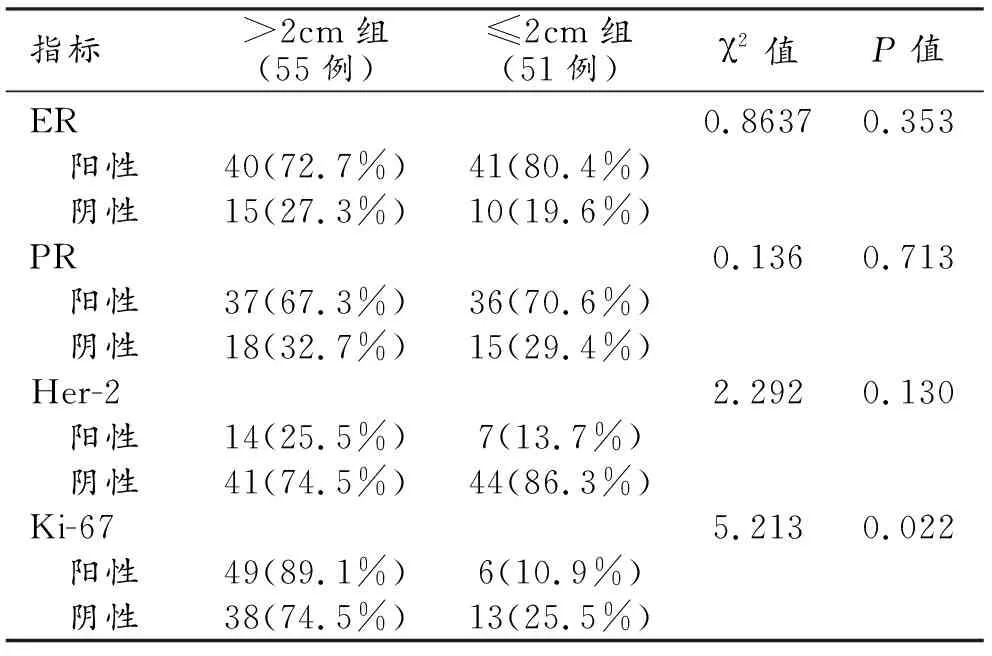
表2 乳腺IDC肿块生物学表达在不同大小的差异性比较 [n(%)]
4.相关性分析
多模态超声征象及分子生物学指标与病灶大小的相关性分析结果见表3。
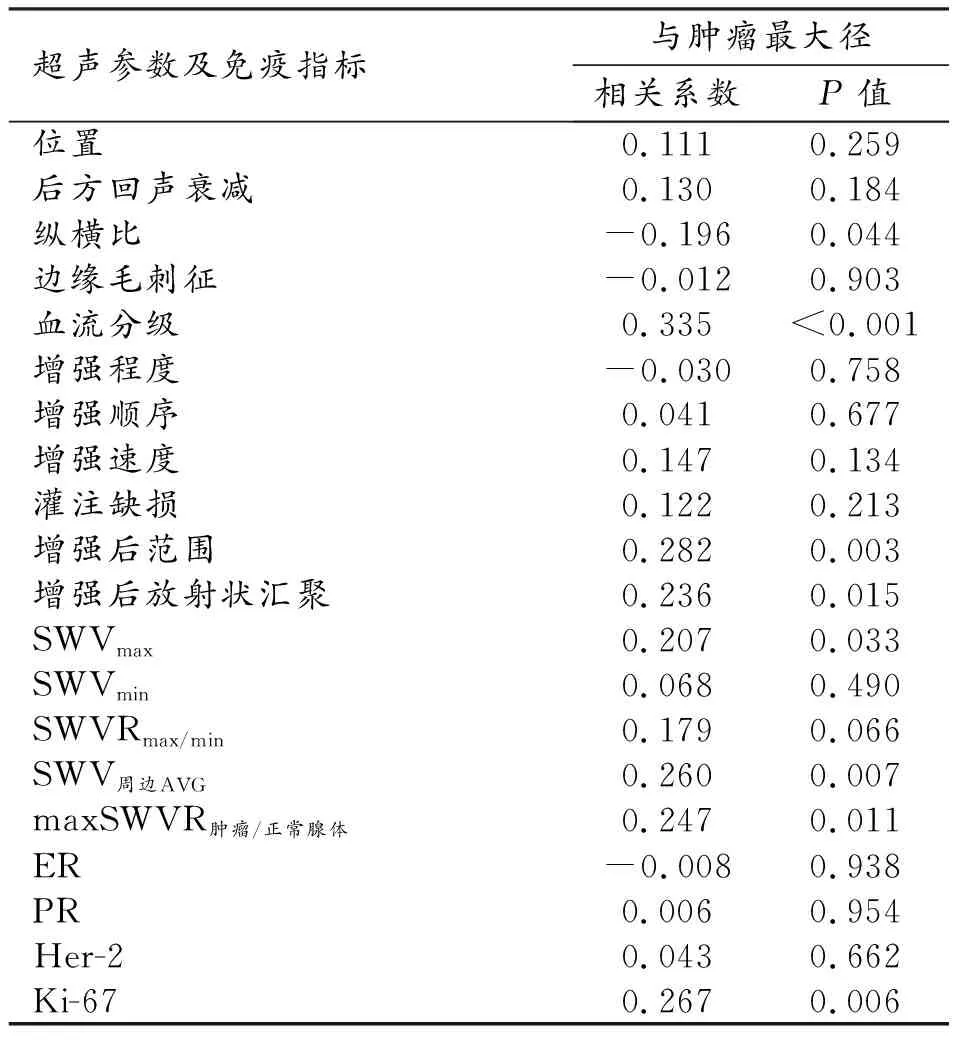
表3 多模态超声特征在不同大小乳腺IDC的相关性分析
乳腺肿块大小与Adler血流分级、增强后范围、增强后边缘放射状汇聚、SWVmax、SWV周边AVG、maxSWVR肿瘤/正常腺体和Ki-67表达水平均呈正相关(P均<0.05),与纵横比呈负相关(P<0.05)。
乳腺肿块的大小与位置、后方回声衰减、边缘毛刺征、增强程度、增强顺序、增强速度、灌注缺损、SWVmin、SWVRmax/min以及ER、PR、Her-2的表达水平之间均无显著相关性(P均>0.05)。
讨 论
IDC是女性乳腺癌中最常见的类型,临床上其发病率占所有乳腺癌的75%以上[8]。不同病理类型乳腺癌的临床和生物学特征不同,治疗后的反应性及预后也不尽相同[9,10]。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南值将≤2 cm且无淋巴结及远处转移的乳腺癌定义为I期乳腺癌,因肿块较小和/或恶性病变与正常组织混杂存在,对此期肿瘤超声诊断有较高的误诊率和漏诊率[11]。中国抗癌协会乳腺癌诊治指南与规范(2021年版)中指出乳腺肿块大小及所在位置不同治疗方式也存在差异[12]。有研究结果表明随着肿瘤逐渐增大,其浸润性生长的特征会越明显,超声检查时呈现出典型的恶性特征,而≤2 cm的乳腺癌病灶,周边的间质反应带常常不明显,因此其恶性征象也不明显,因而给超声医师的诊断带来困扰[13]。而多模态超声检查可以为乳腺肿块特征提供多方位、多角度的定量及定性参数,弥补了常规超声特征的单一性。目前,VTIQ技术及CEUS在乳腺肿块鉴别诊断中的重要作用已经得到多方面的研究和证实,但是目前CUS+VTIQ+CEUS三者联合在乳腺IDC中的应用研究相对比较少。因此本研究以直径2 cm为分界,比较不同大小IDC之间常规超声、VTIQ、CEUS及免疫组化指标的差异性,旨在为术前诊断IDC提供更多有价值的影像学信息。
从超声影像学特征来讲,本研究中发现>2 cm的乳腺IDC位于外上象限的占比高于≤2 cm组,与文献报道的结果一致[14-15]。在乳腺外上象限内腺体组织较其它象限偏多,乳腺密度相对较高,发生乳腺结节的概率也高。此外,乳腺外上象限腺体组织易受到上肢的活动牵拉、压迫等原因,常导致乳腺外上象限的腺体组织发生改变,加之女性体内激素的改变,导致乳腺癌好发与此。另由于外上象限腺体层较厚,位于此处的肿块往往容易被忽略,而IDC是一种高度异质性肿瘤,生长速度较快,导致临床上发现>2 cm的IDC发生在外上象限者较多。本研究中当乳腺IDC的直径>2 cm时其内血流更丰富。Son等[16]的研究中指出新生血管生成是肿瘤生长、进展以及发生侵袭和转移的关键因素,并受血管生成蛋白的调节,如血管内皮生长因子(vascular endothelial growth factor,VEGF)和抗血管生成蛋白,当病灶大小从<1 cm增加至>2 cm时,回归分析发现血管评分提高约0.3倍,充足的血管对肿瘤的发展和持续生长至关重要。
关于IDC的超声弹性成像特征,本研究中分析了SWVmax、SWVmin、SWV周边AVG、maxSWVR肿瘤/正常腺体和SWVRmax/min在>2 cm组与≤2 cm组之间的差异,发现肿瘤周边组织的平均剪切波速度、肿瘤内其最高剪切波速度与最低剪切波速度的比值、肿瘤最高剪切波速度与同水平的正常腺体的比值在不同肿瘤大小中具有统计学意义(P<0.05)。乳腺IDC的肿块大小与SWVmax、SWV周边AVG(r=0.244,P=0.012)、maxSWVR肿瘤/正常腺体呈正相关,即肿瘤越大,其周边组织的平均硬度、肿瘤内剪切波速度最高区域与正常腺体的剪切波速度的比值、以及肿瘤内剪切波速度最高与最低的比值越大。既往的研究结果表明,与IDC弹性成像定量参数最常见的组织学特征是肿瘤大小[17,18]。Evans等[19]分析了101例乳腺IDC的超声弹性成像特征,发现浸润性肿瘤的大小和组织学分级与平均硬度值呈正相关。另外两项研究中均发现只有超声检查测量肿瘤大小或者组织学检查获得的肿瘤大小是影响弹性的独立因素[18,20]。Son等[16]研究中指出浸润性肿瘤的大小是唯一与Emean和Emax独立相关的组织学参数。结合本研究的结果,不难得出IDC的组织学硬度与肿瘤大小具有一定的相关性,且>2 cm组中 IDC的硬度值高于≤2 cm组。
CEUS能实时、动态的观察肿瘤组织的微血管及血流灌注压等情况,可提高对肿瘤血流显示的敏感度,进一步获得相关的生物学信息。本研究中观察了IDC的CEUS表现,包括增强程度、增强速度、增强顺序、增强后放射状汇聚、增强后有无充盈缺损及增强后范围增大与否等,结果表明>2 cm组的超声造影特征主要有高增强、增强后有放射状汇聚和增强后范围增大,与既往的研究结果一致[21,22]。吕文豪等[23]研究了50例乳腺癌病灶,分析CEUS征象中乳腺癌肿块增强后范围扩大程度与免疫组化指标的相关性,结果表明CEUS显示的肿瘤范围增大程度与HER-2的表达水平呈正相关。HER-2与VEGR有密切的关系,在VEGR的作用下,肿瘤外周组织内生成更多的微血管,同时使周围组织的抗侵袭保护屏障受到破坏,致使肿瘤组织不断向周围组织浸润生长。2 cm的IDC肿瘤血供丰富且其周边组织的浸润程度严重,CEUS能够使组织内的微血管显影进而进一步可以从超声图像中观察到肿瘤内的微血管结构,所以在>2 cm的IDC肿块中,超声造影时更容易表现为高增强、增强后周边呈放射状汇聚、增强后肿瘤的范围增大,则进一步指导我们在临床工作中对于超声造影出现高增强、放射状汇聚、范围增大的>2 cm的肿块中更倾向于IDC,为临床医师提供一定的参考依据。
不同大小乳腺IDC的免疫组化指标(ER、PR、HER-2、Ki-67)表达情况的研究结果显示仅Ki-67的表达水平在两组间的差异有统计学意义(χ2=5.213,P<0.05)。免疫组化指标与不同乳腺IDC大小进行相关性分析中发现,Ki-67与肿瘤的大小呈正相关(P<0.05)。这与既往的研究结果一致[3,9,24]。Ki-67是乳腺IDC中最重要的一种肿瘤分子标记物[25,26]。既往研究结果表明Ki-67与细胞分裂周期密切相关[27],当肿瘤组织内处于增殖期的细胞越多,则Ki-67的表达水平越高。Ki-67高表达提示预后不良,然而在乳腺IDC中Ki-67的表达与肿瘤大小是否相关的文献报道较少,需进一步研究。
本研究存在的局限性:①为回顾性研究,可能存在一定的样本选择偏倚;②为单中心研究,尚需进行大样本量的多中心研究 来进一步验证结果;③CEUS提供的均为定性指标,可能存在一定的主观性,仍需进一步进行定量分析。
综述所述,>2 cm与≤2 cm组的乳腺IDC的多模态超声特征具有一定的差异,乳腺IDC的大小与Adler血流分级、肿瘤周边剪切波平均值、肿瘤内剪切波速度最高区域与正常腺体的剪切波速度的比值、以及肿瘤内剪切波速度最高与最低的比值、增强程度、增强后肿瘤周边放射状汇聚、增强后肿瘤范围的变化、Ki-67具有一定的相关性,不同大小的乳腺IDC的不同超声特征与免疫指标可为临床医师及超声医师在诊断乳腺肿块诊断及评估提供参考依据。
