Revolution CT剂量匹配技术对肝脏脂肪含量测量值的影响
2024-04-23王诗瑜刘义军魏巍李贝贝王旭童小雨
王诗瑜,刘义军,魏巍,李贝贝,王旭,童小雨
脂肪肝是全球成人和儿童慢性肝病最常见的病因之一,并且近年来发病呈年轻化趋势[1]。脂肪性肝病早期是可逆的,因此早发现早治疗至关重要。肝脏穿刺活检是目前诊断肝脏脂肪变性的金标准,但已不作为脂肪性肝病的筛查方法[2]。定量CT(quantitative computed tomography,QCT)可以实现对肝脏和腹部内脏脂肪含量的定量测量,临床应用价值较高。目前CT检查中多采用管电压预设置(auto-prescription)技术来开展个体化低剂量扫描,但其是否会对脂肪含量的定量分析造成影响尚有待分析和探讨。因此,本研究采用auto-prescription技术结合不同权重的自适应统计迭代算法(adaptive statistical iterative reconstruction,ASIR-V)进行个体化低剂量扫描,旨在探讨个体化低剂量CT成像参数对QCT肝脏脂肪含量测量及图像质量的影响。
村料与方法
1.研究对象
前瞻性将2022年2月-12月拟在本院GE Revolution CT机上行胸部及上腹部联合CT检查的患者纳入观察。纳入标准:①扫描过程中Auto-prescription技术推荐管电压值为80/100 kVp的患者;②能配合完成检查者。排除标准:①有肝内占位性病变(良性小囊肿、肝内小钙化灶除外);②体内有金属植入物等;③近期服用过任何可能导致肝损伤的药物;④有胰腺炎、急性胆囊炎等病史,影响数据测量者。最终共纳入符合本研究要求的患者253例,男146例、女107例,年龄27~90岁,平均(63.03±11.31)岁。
本研究经医院伦理委员会批准(PJ-KS-KY-2022-293)。所有患者签署了知情同意书。
2.CT检查方法
使用GE Revolution CT机进行扫描。每日于患者扫描前,按照QCT质控标准对QCT体模采用不同扫描条件(80、100、120 kVp)进行校准。患者取仰卧位,头先进,双手上举。采取吸气末屏气扫描,扫描前对患者进行呼吸训练。胸部扫描采用个体化低剂量扫描方案(A组),扫描范围为肺尖至肋膈角下2 cm,管电压120 kVp,管电流采用智能毫安技术(Smart mA),并通过手动调整噪声指数(noise index,NI)来降低管电流,使扫描的辐射剂量等同于基于auto-prescription技术推荐的80或100 kVp的辐射剂量,分别记为A1组(80 kVp,NI=12)和A2组(100 kVp,NI=11)。记录A组扫描时的容积CT剂量指数(volume CT dose index,CTDIvol)和剂量长度乘积(dose length product,DLP)。B组为上腹部常规剂量扫描,扫描范围为膈肌上缘2 cm至髂前上棘(需包含肝、胆、胰、脾),管电压为120 kVp,自动管电流调制技术,NI=10,与A1和A2组对应的患者图像分别归入B1和B2组,A、B组其余扫描及重建参数均一致:管电流50~700 mA ,扫描层厚5 mm,0.5 s/r,螺距0.992,探测器宽度80 mm,前置40% ASIR-V重建算法,重建层厚及层间距均为1.25 mm,标准算法重建。扫描完成后,对A组图像分别采用40%、60%、80%权重的后置ASIR-V算法进行图像重建,对B组图像采用40%权重的后置ASIR-V算法进行图像重建。
3.数据测量和分析
将所有图像传输至QCT工作站及AW4.6后处理工作站。使用Mindways Model 4 QCT Pro V6.1骨密度分析系统,于每例患者的图像中选取胸部及上腹部扫描时相互重叠的含有门静脉的层面,在肝左叶、肝右叶前段或肝右叶后段内勾画ROI(面积约7 mm2,避开血管及胆管)。由1位经过专业培训的放射科医师独立完成肝脏脂肪含量体积百分比(Fat%QCT)的测量和分析,重复测量3次,取平均值。使用AW4.6后处理工作站,在每例患者的图像中选取胸部及上腹部扫描时相互重叠的含有门静脉的层面,分别于肝脏最大层面勾画ROI(面积50~100 mm2),分别测量肝脏和竖脊肌的CT值及其标准差(standard deviation,SD),重复测量3次取平均值。以竖脊肌的SD作为背景噪声,计算SNR 和CNR,计算公式 :
(1)
(2)
4.胸部图像质量主观评分
由两位具有5年以上工作经验的影像科医师采用双盲法对胸部图像(肺窗、纵隔窗)的质量采用五分制进行主观评分,评分标准见表1,评分≥3分即为符合临床诊断要求。

表1 图像质量评分标准
5.统计学分析
使用SPSS 24.0和GraphPad Prism 8.0.1统计软件对数据进行分析。符合正态分布的计量资料采用均数±标准差的形式表示,A组内采用单因素方差分析比较不同权重后置ASIR-V对Fat%QCT测量值的影响。采用配对样本t检验比较A组(后置40% ASIR-V重建算法图像)与B组间CT值、SD值、SNR及CNR的差异。采用 Bland-Altman分析对肝脏脂肪含量(Fat%QCT)在胸部和腹部扫描图像(后置40% ASIR-V重建算法)上测量结果的一致性。两位放射科医师对图像主观质量评分的一致性采用Kappa检验,若观察者之间的一致性较好则采用标准差较小的数据进行Wilcoxon符号秩和检验比较A组(40%、60%、80%不同权重)、B组(40%权重图像)图像质量主观评分的差异性。以P<0.05为差异有统计学意义。
结 果
1.客观评价
A组中不同权重重建图像及B组图像上各定量参数的测量值及组间比较结果见表2~3。肝脏的CT值和Fat%QCT值在A1组与B1组、A2组与B2组之间的差异均无统计学意义(P>0.05)。A1组内和A2组内不同权重重建图像之间Fat%QCT值的差异均无统计学意义(P>0.05)。
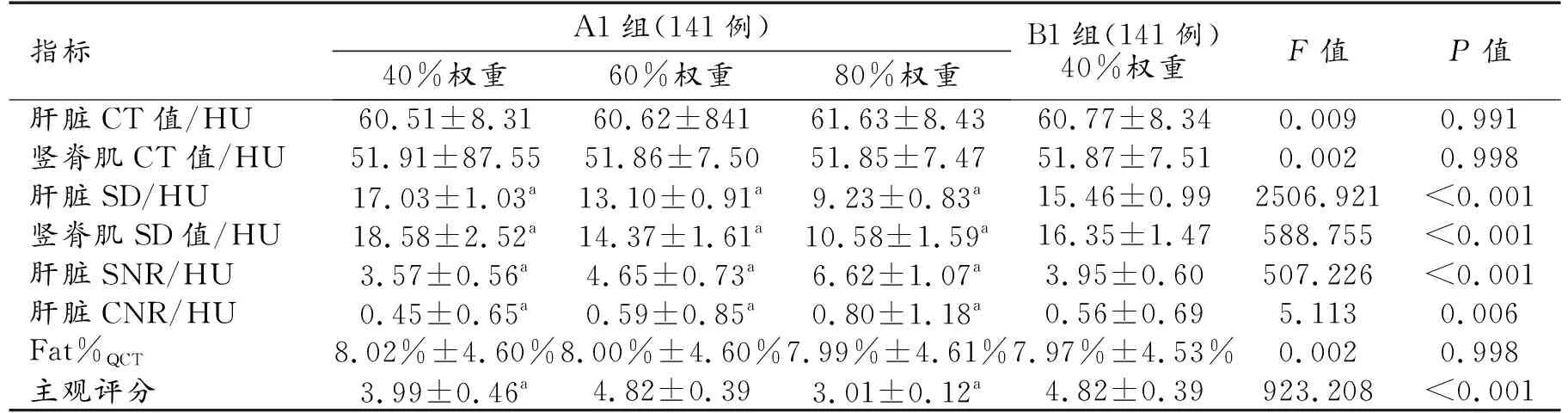
表2 A1组与B1组图像质量主客观评估结果的比较 /例
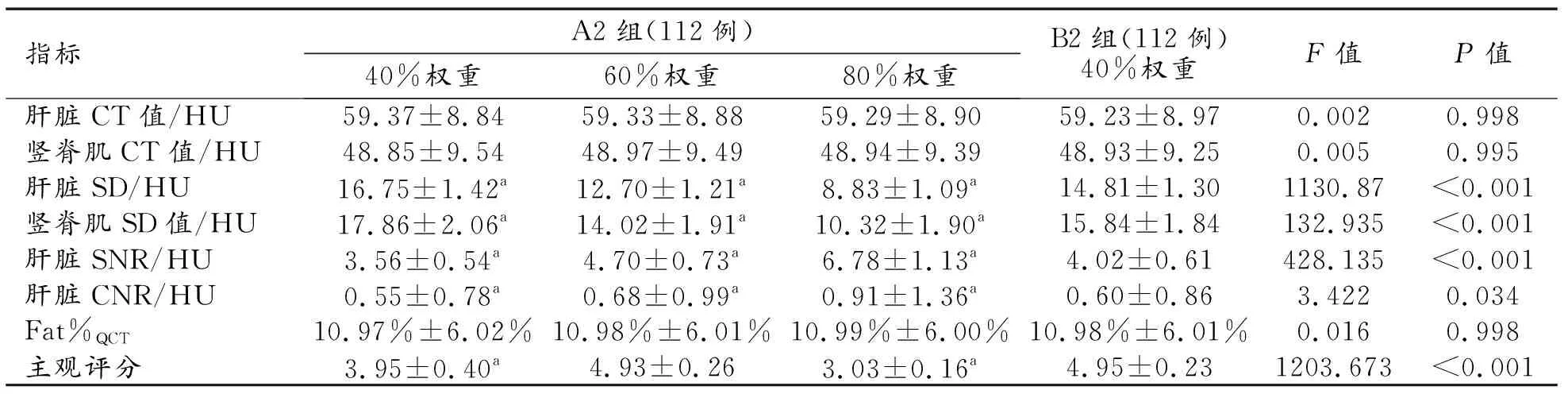
表3 A2组与B2 组图像质量主客观评估结果的比较 /例
A、B组之间肝脏的SD、SNR、CNR及竖直肌的SD的差异均有统计学意义(P<0.05)。A组中后置40%ASIR-V重建图像的SNR和CNR低于B组,SD值高于B组;60%和80%ASIR-V重建图像的SNR和CNR高于B组,SD值低于B组(P<0.05)。
2.主观评价
2位观察者对A组(A1、A2组)40%、60%、80%不同权重ASIR-V、B组(B1、B2组)40% ASIR-V图像质量的主观评分的一致性均较好(Kappa=0.773~0.918,P均<0.05)。A组结合60%后置 ASIR-V的主观评分最高,与B组间的差异无统计学意义(P>0.05),而A组结合40%和80%后置ASIR-V重建图像的主观评分低于B组(P<0.05,表2~3,图1~2)。
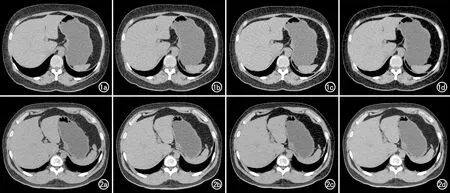
图1 患者,男,43岁,BMI=27.9 kg/m2。a)B组腹部常规扫描图像(120 kVp,NI=10,后置40%-ASIR-V重建);b~d为A组后置40%-、60%-和80%-ASIR-V胸部重建图像(120 kVp,NI=12)。后置60%-ASIR-V重建图像c的SNR和CNR高于图a,主观评分与图a无明显差异。 图2 患者,男,25岁,BMI=24.7 kg/m2。a)B组腹部常规扫描图像(120 kVp,NI=10,后置40%-ASIR-V重建);b~d为A组后置40%-、60%-和80%-ASIR-V胸部重建图像(120 kVp,NI=11)。后置60%-ASIR-V重建图像c的SNR和CNR高于图a,主观评分与图a无明显差异。
采用Bland-Altman对A1组与B1组、A2组与B2组肝脏Fat%QCT测量值进行一致性分析,2组间具有较高的一致性(图3)。

图3 Bland-Altman分析散点图。a)A1组与B1组肝脏Fat%QCT测量值的差值均靠近0轴,表明2组间具有较高的一致性; b)A2组与B2组肝脏Fat%QCT测量值的差值均靠近0轴,表明2组间具有较高的一致性。
3.辐射剂量
A1和A2组中,基于auto-prescription技术推荐管电压80和100 kVp的辐射剂量与实际扫描的辐射剂量差异无统计学意义(t=1.313,1.760,P>0.05)。
讨 论
临床上行胸腹部联合扫描的需求量逐渐增大,两次检查受到的辐射剂量不容小觑。在一次 CT扫描的基础上,通过胸部的低剂量扫描和 QCT分析技术,可以准确地测量椎体的骨密度[3]。但低剂量扫描对QCT肝脏脂肪含量的测量是否有影响目前鲜有报道。在临床实际应用中,低剂量扫描多采用降低管电压(kV)和/或管电流(mA)的方法来实现[4]。动物试验的结果表明低剂量(80 kVp)可用于定量分析肝脏脂肪[5]。因此,本研究通过降低管流实现低剂量扫描,基于胸部及上腹部联合扫描的患者,探讨低管电流对肝脏脂肪含量测量及图像质量的影响。
本研究团队先前的研究结果表明,采用auto-prescription推荐的管电压可以实现胸部个体化低剂量扫描[6]。因此,本研究中探讨在胸部扫描时,使用120 kVp常规管电压,并以auto-prescription技术得到的低管电压个体化辐射剂量作为参考,通过调整NI来降低扫描时的管电流,实现低剂量扫描;并通过与上腹部常规剂量扫描(120 kVp,NI=10,常规管电流)进行对比,分析低管电流对肝脏脂肪含量测量的影响。NI为控制管电流输出的重要指标,有研究表明,NI每降低5%,辐射剂量将增加约10%[7]。随着NI值的增加,CTDIvol和DLP下降,组织的SD增加。本研究结果显示,基于auto-prescription技术推荐的管电压(80/100 kVp)所对应的辐射剂量,实际扫描时采用120 kVp常规管电压,而通过调节NI为11或12来降低管电流,使得实际扫描时的辐射剂量与模拟的辐射剂量相当,也能获得较好的图像质量,且对肝脏脂肪含量的测量无明显影响。由此可见,选用适当的噪音指数,可以平衡图像质量和辐射剂量。
ASIR-V是一种新的迭代重建算法,以往的研究结果表明个体化低剂量扫描联合后置ASIR-V重建技术可以在保持图像质量的情况下减少辐射剂量[8-9]。而且,随着迭代权重的增加,图像改善效果也相应增加[10-12]。本研究结果显示,A组采用的个体化低管电流扫描结合不同权重后置ASIR-V算法时,对肝脏CT值及QCT肝脏脂肪测量值无显著影响,可能是因为管电压是决定X线能量的关键因素,而管电流则与之无显著相关性[13-14]。根据CT值的计算公式[CTM=(UM-U水)/U水×100%(CTM为物质的CT值,U为吸收系数)],可见CT值与物质的X线吸收系数有关,而吸收系数又与物质的类型和X线的能量有关,当物质类型一定时则仅与X线的能量有关。龚筑等[15]的研究表明:各受试者肝脏脂肪含量百分数与肝脏CT值具有较高的一致性,这与本研究的结论一致。因此,在胸部低管电流个体化剂量扫描结合后置60%-ASIR-V时,不仅可以得到高质量的图像和降低辐射剂量,还可以在不增加辐射剂量的条件下用于QCT对肝脏脂肪含量的定量分析,这有利于探索多病共检模式,建立慢病的风险预测模型。
本研究的局限性:①虽然在扫描前对患者进行了呼吸训练,但胸腹部为两次扫描,不能完全避免呼吸运动造成的偏差;②Auto-prescription技术对管电压的推荐与患者的体型相关,推荐使用70 kVp扫描条件的人群较少,因此本文没有对70 kVp进行剂量匹配。
综上所述,低管电流个体化低剂量胸部扫描结合后置60%-ASIR-V,不仅可以保证图像质量,而且能较准确地测量肝脏脂肪含量,也并未额外增加患者的辐射剂量。胸部低剂量扫描结合 QCT技术可一站式测量肝脏脂肪含量,准确评估脂肪肝,在患者的健康管理中具有广泛的应用前景。
