MEBT/MEBO对糖尿病大鼠创面中CaN/NFAT信号通路表达的影响*
2024-04-23葛星月杨雅量李文武竺仕林姚明哲唐乾利
葛星月,杨雅量,李文武,竺仕林,姚明哲,唐乾利
(右江民族医学院研究生学院,广西百色 533000)
随着糖尿病患者数量的不断增加,糖尿病溃疡的发病率也逐年上升,现已成为溃疡患者中仅次于手术后未愈合溃疡的主要原因[1]。由烧伤湿润暴露疗法(moist exposed burn therapy,MEBT)和湿润烧伤膏(moist exposed burn ointment,MEBO)组成的皮肤再生医疗技术(MEBT/MEBO),被首先应用于烧伤创面,后延伸应用于糖尿病溃疡创面,其在创面形成早期可无损伤性地保护治疗创面、液化排除坏死组织及促进皮肤再生修复,对临床糖尿病创面产生巨大的修复治疗作用[2-3]。目前发现MEBT/MEBO可能是通过干预磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)、丝裂原活化蛋白激酶(MAPK)、Wnt/β-连环蛋白(β-catenin)、转化生长因子-β1(TGF-β1)/Smad、核因子-κB(NF-κB)和PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mTOR)等信号通路的表达,影响内皮祖细胞、成纤维细胞、上皮细胞的增殖、迁移,促进血管及肉芽组织的新生,从而参与创面愈合的调控[3]。
活化T细胞核因子(nuclear factor of activated T cells,NFAT)是钙调神经磷酸酶(calcineurin,CaN)信号通路的下游效应因子[4],可结合白细胞介素-2(interleukin-2,IL-2)启动子激活T细胞[5]。CaN/NFAT通路在免疫系统、神经系统及心血管系统疾病治疗机制的研究较多[6-8],而在创面愈合中的作用尚未明确。本研究通过构建糖尿病大鼠创面模型,运用苏木精-伊红(HE)染色、免疫荧光染色和实时荧光定量逆转录PCR(RT-qPCR)技术,探讨MEBT/MEBO对CaN/NFAT信号通路的影响,现报道如下。
1 材料与方法
1.1 材料
1.1.1实验动物
48只健康8周龄无特定病原体(SPF)级Wistar 雄性大鼠,重量220~250 g,购自长沙天勤公司[许可证号SCXK(湘)2019-0013],分笼喂养于SPF级实验室,每笼4只,给予充足的高压灭菌食物和饮用水,每天12 h光照时间,适应性喂养1周后用于后续实验。
动物实验经右江民族医学院伦理委员会批准(2022052701),饲养条件符合SPF实验标准,实验过程及各项操作均符合动物实验伦理审查要求。
1.1.2主要仪器与试剂
湿润烧伤膏(美宝):汕头市美宝制药有限公司生产,批号2101603A;重组牛碱性成纤维细胞生长因子凝胶(贝复新):珠海亿胜生物制药有限公司生产,批号042302A06;Cy3标记驴抗兔二抗、RNA提取液、SYBR Green、枸橼酸缓冲修复液:武汉赛维尔生物科技有限公司生产,货号GB21403、G3013、G3326、G1201;链脲佐菌素(Streptozotocin,STZ)、抗荧光淬灭封片剂(含DAPI):北京索莱宝公司生产,货号S8050、S2110;NFAT、CaN、IL-2一抗:北京博奥森公司生产,货号bs-4246R、bs-11246R、bs-1191R;逆转录试剂盒:美国Thermo Fisher Scientific公司生产,货号M16315。
MDF-U72V型超低温冰箱:日本Sanyo公司生产;低温高速离心机、移液器:德国Eppendorf公司生产;荧光正置显微镜:日本Nikon公司生产;超微量紫外分光光度计:瑞士Mettler Toledo公司生产;实时荧光定量PCR仪:美国Roche公司生产;离心机:湖南湘仪实验室仪器开发有限公司生产。
1.2 方法
1.2.1分组与造模
使用随机数字表法,将48只大鼠分为对照组、模型组、美宝组、贝复新组4组,每组12只。各组大鼠均禁食12 h,模型组、美宝组、贝复新组大鼠进行糖尿病大鼠造模,腹腔注射柠檬酸-柠檬酸钠缓冲液稀释的STZ(稀释浓度1∶100)[9],称量体重后按50 mg/kg注射;注射3 d后,取大鼠尾静脉血检测其空腹血糖,血糖大于 11.1 mmol/L认为造模成功[10];如不成功,再禁食12 h后,腹腔再次注射1%的STZ溶液10 mg/kg。对照组大鼠为控制变量等剂量注射缓冲液。
糖尿病造模成功后,使用剃毛刀及脱毛膏对大鼠进行备皮,后用3%异氟烷吸入麻醉,依据全层皮肤缺损法[11]和沈氏改良塑料环肉芽肿定量法[12]对大鼠进行创面造模,以无菌操作沿大鼠脊椎方向在脊背两侧制成两个对称且直径为20 mm的全层皮肤缺损创面。
1.2.2给药
各组创面制备完成后,先用呋喃西林液(稀释浓度1∶5 000)清洁创面[13],对照组和模型组创面外敷两层生理盐水纱布,美宝组创面外敷两层美宝纱布(0.2 g/cm2),贝复新组创面外敷两层贝复新纱布(60 U/cm2),随后所有组别大鼠均加盖两层消毒干纱布,以胶布固定,每日上午和晚上进行换垫料、换药操作[14-15]。
1.2.3取材
各组按上述方法制备完成后,分别于3、7、14 d 共3个时间点随机取4只大鼠拍照记录其创面愈合情况,断颈处死,从深筋膜下层切取距离创缘0.5 cm的整个创面及周围组织[12],一半用称量纸包裹以防止组织收缩,置于包埋盒,并放入10%甲醛中性缓冲液中,24 h后再放入70%乙醇中,存储于4 ℃冰箱,固定好的组织经脱水、包埋后形成蜡块再保存于4 ℃冰箱,用于HE染色组织学观察和免疫荧光染色。另外一半置于冻存管中,放入液氮罐中备用,再移入-80 ℃冰箱内保存。
1.3 检测方法
1.3.1创面愈合率
使用Image J测定大鼠的创面面积,分别计算3、7、14 d时各组的创面愈合率以评估大鼠创面愈合情况。创面愈合率=(造模时创面面积-该时间点创面面积)/造模时创面面积[16]。
1.3.2HE染色
实验时从4 ℃冰箱取出组织蜡块,用石蜡切片机切片、烤片,37 ℃烘干过夜、65 ℃烤片1.5 h,在通风橱中用二甲苯脱蜡20 min,依次过100%、90%、80%、70%无水乙醇各5 min后用超纯水过滤,以苏木精、伊红染料染色,再经无水乙醇5 min脱水共2次、二甲苯3 min浸润共2次,于通风橱风干0.5 h后封片,荧光正置显微镜下以明场观察创面肉芽组织形态。
1.3.3免疫荧光染色
从4 ℃冰箱取石蜡切片重复上述步骤烤片、脱蜡、依次过100%、90%、80%、70%、50%无水乙醇各5 min后用超纯水过滤,用枸橼酸盐溶液在高压锅内水浴加热修复抗原,冷却后甩干玻片。用免疫组织化学笔沿组织边缘描圈,圈内点上以1%牛血清白蛋白(BSA)稀释的驴血清(稀释浓度1∶10),在37 ℃烘箱内封闭0.5 h,甩干玻片,再加入1% BSA稀释的一抗(稀释浓度1∶500),4 ℃冰箱内过夜孵育一抗。第2天室温复温后用磷酸盐缓冲液(PBS)洗涤3次,每次10 min,此后所有操作均避光进行。室温孵育Cy3标记驴抗兔二抗1 h,再用PBS洗涤3次,每次10 min。洗涤完成后甩干玻片,用擦镜纸擦干圈外多余水滴,加入含DAPI的抗荧光淬灭剂封片,盖上盖玻片后用指甲油在玻片两端封层以固定盖玻片。玻片避光保存于4 ℃冰箱内,待DAPI孵育完成后用正置荧光显微镜观察各组大鼠CaN、NFAT、IL-2的表达情况。
1.3.4RT-qPCR
从-80 ℃冰箱内取出冻存的创面组织,以Trizol法[17]提取组织RNA,再用超微量紫外分光光度计测量其浓度和纯度后,按说明书步骤添加逆转录盒内试剂并设置相应程序行逆转录,再以无酶水将所得样品进行稀释,按照SYBR Green说明书在100 μL八联管中依次加样后,于实时荧光定量PCR仪中设定相应反应程序进行实验,测得相应Ct值,再用2-ΔΔCt法[18]对得到的数据进行处理、分析,以此检测NFAT的mRNA基因转录水平。NFAT引物由南宁捷尼斯生物公司生产合成,其具体序列为正向:5′-CAG GTG TTT GTG GGC AAT GAC-3′、R:5′-GCA CGG AGT TGT GTT TCG C-3′。
1.4 统计学处理

2 结 果
2.1 各组大鼠创面愈合率对比
3、7、14 d 3个时间点,与模型组相比,对照组、美宝组和贝复新组大鼠创面愈合情况更好,见图1。
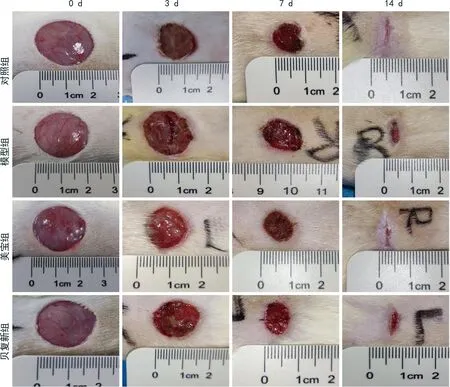
图1 各组大鼠不同时间点创面愈合情况
3 d时,对照组大鼠创面愈合率(0.51±0.02)优于模型组(0.48±0.02),差异有统计学意义(P<0.05),其余各组组间差异无统计学意义(P>0.05);7、14 d时,与模型组相比,对照组、美宝组和贝复新组大鼠的创面愈合率更高,差异均有统计学意义(P<0.05),见表1。

表1 各组大鼠创面愈合率
2.2 HE染色结果
3、7 d时,对照组、美宝组和贝复新组大鼠创面组织有少量出血、部分坏死细胞、散在炎性细胞浸润,而模型组有大量出血、整个视野炎性细胞浸润甚至有坏死带的出现;14 d时,对照组、美宝组、贝复新组大鼠创面组织有大量新生毛细血管生成,也观察到皮脂腺等皮肤附件的形成,而模型组仍有大量炎性细胞及细胞坏死带。且在3、7、14 d时,可观察到对照组、美宝组和贝复新组大鼠创面组织中炎性细胞浸润和坏死细胞呈逐渐减少趋势,模型组则无明显减少,见图2。
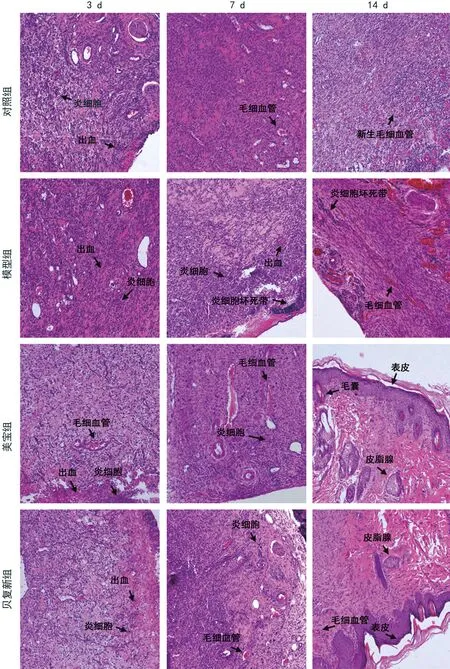
图2 各组大鼠创面组织病理学结果(HE染色,200×)
2.3 NFAT、CaN、IL-2表达情况
3、7、14 d时,对照组、美宝组和贝复新组创面组织中NFAT、CaN表达水平明显高于模型组;3、7、14 d时,模型组IL-2表达水平高于对照组、美宝组、贝复新组(P<0.05),见图3。
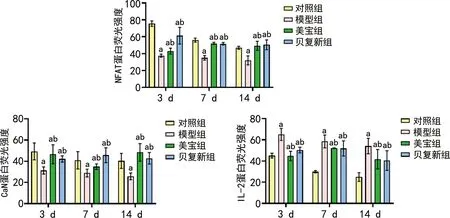
a:P<0.05,与相同时间点对照组比较;b:P<0.05,与相同时间点模型组比较。
2.4 各组大鼠创面组织中NFAT mRNA表达水平
3 d时,对照组、美宝组和贝复新组创面组织中NFAT mRNA表达水平高于模型组,差异均有统计学意义(P<0.05);7 d时,对照组、美宝组创面组织中NFAT mRNA表达水平高于模型组,差异均有统计学意义(P<0.05),但贝复新组和模型组组间差异无统计学意义(P>0.05);14 d时,对照组创面组织中NFAT mRNA表达水平仍高于模型组,但美宝组和贝复新组表达水平低于模型组,差异均有统计学意义(P<0.05),见图4。
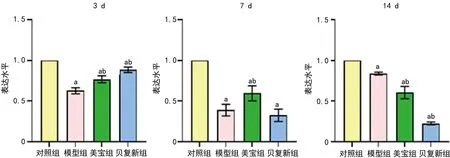
a:P<0.05,与相同时间点对照组比较;b:P<0.05,与相同时间点模型组比较。
3 讨 论
MEBT/MEBO应用于治疗糖尿病慢性难愈合创面,成本低廉、预后较好,受到广泛关注,但其具体作用机制仍不明确。创面的愈合往往与新生血管关系密切,已有研究表明,MEBT/MEBO可能通过增加血管内皮生长因子(vascular endothelial growth factor,VEGF)表达来促进创面成纤维细胞的分裂增殖及新生毛细血管的增殖,促进肉芽组织形成加速创面愈合[19]。而有实验证明VEGF诱导血管生成需要激活NFAT,这种转录因子作为刺激信号和抑制信号在血管生成调节中的收敛点起着关键作用[20],NFAT信号通路的核因子在VEGF启动后参与血管生成,许多血管生成基因与NFAT通路相关[21]。同时也有研究表明,钙依赖的丝氨酸/苏氨酸蛋白磷酸酶CaN可使NFAT去磷酸化,从而使核转位和靶基因转录[22],且CaN/NFAT信号通路在促进IL-2等细胞因子的表达中起着至关重要的作用[23]。这提示MEBT/MEBO影响VEGF表达加快创面愈合的机制可能与CaN/NFAT通路相关。故本研究探讨MEBT/MEBO在治疗糖尿病创面时的部分作用机制,观察了MEBT/MEBO对大鼠糖尿病创面组织CaN、NFAT、IL-2表达水平的影响。
前期有实验研究[24]表明,NFAT在大鼠全层创缘组织中第1天时高表达,第3天表达水平有所下降,第5~7天低表达,在第7天之后几乎不表达。血管的新生为愈合中的组织提供了氧、生长因子和免疫支持,而血管在大量生成及成熟之后则会发生受控性消退,因此在治疗第14天创面组织CaN/NFAT表达降低,可能与创面基本完成愈合有关。根据免疫荧光结果,在治疗第14天时,美宝组及贝复新组的NFAT、CaN、IL-2表达水平都明显下降,与文献报道[24]相似,这提示CaN/NFAT信号通路可能仅在治疗前期发挥作用。
本研究结果显示,在治疗3、7 d时,与对照组相比,模型组糖尿病创面组织中NFAT、CaN表达水平降低,同时从表型观察结果比较,模型组创面愈合明显慢于对照组,且病理染色切片显示新生血管较少,愈合中后期仍存在大量炎性细胞及坏死细胞。而模型组与对照组的治疗方法完全一致,区别仅在于模型组大鼠为糖尿病模型,这提示CaN/NFAT通路在糖尿病大鼠创面中的表达可能受到抑制。根据免疫荧光和RT-qPCR结果,3、7 d时与模型组比较,MEBT/MEBO治疗的美宝组创面组织中NFAT、CaN表达水平都较高,而IL-2表达水平较低,且NFAT mRNA表达水平也明显高于模型组,提示MEBT/MEBO激活并上调了糖尿病创面中受抑制的CaN/NFAT通路。
综上所述,MEBT/MEBO治疗前期可能通过上调CaN/NFAT信号通路的表达,促进新生血管形成,加速糖尿病大鼠慢性难愈合创面愈合。但本研究仅从治疗结果观察CaN、NFAT、IL-2表达水平而得出结论,未探究生物体内普遍存在的负反馈调节对以上因子表达可能造成的影响,有待增加相应免疫抑制组进一步展开研究。
