基于NLRP3/IL-1β/TGF-β1通路探讨低氧环境下红景天苷对糖尿病肾病大鼠足细胞焦亡损伤的拮抗效应
2024-04-23李佳武秦凤宋生琴翟婷辛宏云巴应贵
李佳武 秦凤 宋生琴 翟婷 辛宏云 巴应贵


基金项目:青海省科技计划项目(2022-ZJ-763)
引用本文:李佳武,秦凤,宋生琴,等. 基于NLRP3/IL-1β/TGF-β1通路探讨低氧环境下红景天苷对糖尿病肾病大鼠足细胞焦亡损伤的拮抗效应[J]. 中国全科医学,2024,27(21):2617-2622. DOI:10.12114/j.issn.1007-9572.2023.0678.[www.chinagp.net]
LI J W,QIN F,SONG S Q,et al. Antagonistic effect of salidroside on podocyte pyroptosis in diabetic kidney disease rats under hypoxia based on NLRP3/IL-1β/TGF-β1 pathway[J]. Chinese General Practice,2024,27(21):2617-2622.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.
【摘要】 背景 紅景天苷对糖尿病肾病(DKD)大鼠具有保护作用,但在低氧环境下是否同样起效及具体作用机制尚不明确。目的 观察低氧环境下红景天苷对DKD大鼠模型血生化指标、肾组织病理损伤、肾脏细胞焦亡相关蛋白表达情况,并探讨其作用机制。方法 2022年3月—2023年3月40只6周龄SPF级SD雄性大鼠,随机抽取8只作为对照组,其余大鼠造模。将24只DKD成模大鼠随机分为模型组、红景天苷组、红景天苷+Nod样受体蛋白3(NLRP3)激活剂组进行干预,每组8只。干预结束后腹主动脉取血进行生化指标检测,苏木素-伊红(HE)染色及透射电镜观察大鼠肾脏病理改变情况,酶联免疫吸附试验(ELISA)检测大鼠血清白介素(IL)1β、IL-18水平。免疫印迹试验(Western bloting)检测肾组织半胱天冬酶1(Caspase-1)、消皮素D(GSDMD)、NLRP3和转化生长因子β1(TGF-β1)蛋白表达水平。结果 造模后造模大鼠体质量低于对照大鼠,差异有统计学意义(P<0.05)。与对照组相比,模型组大鼠三酰甘油(TG)、总胆固醇(TC)、空腹血糖(FBG)、尿微量白蛋白(UMA)、尿素氮(BUN)、血肌酐(Scr)水平明显升高(P<0.05);与模型组相比,红景天苷组大鼠BUN、UMA、Scr水平明显降低(P<0.05);与红景天苷组相比,红景天苷+NLRP3激活剂组大鼠UMA、BUN、Scr水平明显升高(P<0.05)。HE染色及透射电镜结果可见红景天苷组大鼠肾脏组织病理改变较模型组明显减轻,红景天苷+NLRP3激活剂组较红景天苷组加重。与对照组相比,模型组血清IL-1β、IL-18水平明显升高(P<0.05);与模型组相比,红景天苷组大鼠血清IL-1β、IL-18水平明显降低(P<0.05);与红景天苷组相比,红景天苷+NLRP3激活剂组IL-1β、IL-18水平明显升高(P<0.05)。与对照组相对,模型组Caspase-1、GSDMD、NLRP3、TGF-β1蛋白表达明显升高(P<0.05);与模型组相对,红景天苷组Caspase-1、GSDMD、NLRP3、TGF-β1蛋白表达明显降低(P<0.05);与红景天苷组相对,红景天苷+NLRP3激活剂组Caspase-1、GSDMD、NLRP3、TGF-β1蛋白表达明显升高(P<0.05)。结论 低氧环境下,红景天苷以不降低血糖和血脂为前提发挥了对DKD大鼠的治疗作用,考虑该作用可能与抑制NLRP3从而影响NLRP3/IL-1β/TGF-β1信号通路,最终改善足细胞焦亡损伤密切相关。
【关键词】 糖尿病肾病;细胞焦亡;红景天苷;低氧;大鼠;足细胞
【中图分类号】 R 587.24 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0678
Antagonistic Effect of Salidroside on Podocyte Pyroptosis in Diabetic Kidney Disease Rats under Hypoxia Based on NLRP3/IL-1β/TGF-β1 Pathway
LI Jiawu1,QIN Feng2,SONG Shengqin2,ZHAI Tin3,XIN Hongyun1,BA Yinggui1*
1.Department of Nephrology,Qinghai University Affiliated Hospital,Xining 810000,China
2.Department of Out-patient,Qinghai University Affiliated Hospital,Xining 810000,China
3.Department of Endocrinology,Qinghai University Affiliated Hospital,Xining 810000,China
*Corresponding author:BA Yinggui,Chief physician;E-mail:bayinggui@163.com
【Abstract】 Background Salidroside has been shown to protect diabetic kidney disease(DKD)rats,however,whether it is equally effective in a hypoxic environment and the specific mechanism of action remain unclear. Objective To observe the effects of salidroside on biochemical parameters,renal tissue pathological lesion,and the expression of cell pyroptosis-related proteins in a rat model of DKD under hypoxia,and explore its mechanisms of action. Methods From March 2022 to March 2023,forty 6-week-old SPF-grade SD male rats were used,with eight randomly selected as the control group,the remaining were modeled. Twenty-four DKD model rats were randomly divided into three groups of the model group,salidroside group,and salidroside+nod-like receptor protein 3(NLRP3)activator group for intervention,with 8 in each group. After the intervention,blood was collected from the abdominal aorta for biochemical parameter testing,hematoxylin-eosin(HE)staining,and transmission electron microscopy were used to observe renal pathological changes. Enzyme-linked immunosorbent assay(ELISA)was used to detect serum levels of interleukin(IL)1β and IL-18. Western blotting was used to measure the expression levels of Caspase-1,Gasdermin D(GSDMD),NLRP3,and transforming growth factor β1(TGF-β1)in renal tissue. Results The body weight of the rats after modeling was significantly lower than that of the control group(P<0.05). Compared to the control group,the levels of triglyceride(TG),total cholesterol(TC),fasting blood glucose(FBG),urinary microalbumin(UMA),blood urea nitrogen(BUN),and serum creatinine(Scr)were significantly higher in the model group(P<0.05). Compared to the model group,the BUN,UMA,and Scr levels were significantly lower in the salidroside group(P<0.05). Compared to the salidroside group,the UMA,BUN,and Scr levels were significantly higher in the salidroside+NLRP3 activator group(P<0.05). HE staining and transmission electron microscopy revealed that renal tissue pathological changes in the salidroside group were significantly reduced than the model group,and aggravated in the salidroside+NLRP3 activator group. Compared to the control group,serum IL-1β and IL-18 levels were significantly higher in the model group(P<0.05);these levels were significantly lower in the salidroside group compared to the model group(P<0.05),and higher in the salidroside+NLRP3 activator group compared to the salidroside group(P<0.05). Compared to the control group,the expression of Caspase-1,GSDMD,NLRP3,and TGF-β1 proteins was significantly higher in the model group
(P<0.05);it was significantly lower in the salidroside group compared to the model group(P<0.05),and higher in the salidroside+NLRP3 activator group compared to the salidroside group(P<0.05). Conclusion Salidroside exerted therapeutic effects on DKD rats in a hypoxic environment without reducing blood glucose and lipid levels,this effect may be related to the inhibition of NLRP3,affecting the NLRP3/IL-1β/TGF-β1 signaling pathway,ultimately improving podocyte pyroptosis injury.
【Key words】 Diabetic kidney disease;Pyroptosis;Salidroside;Hypoxia;Rat;Podocytes
糖尿病腎病(DKD)是糖尿病导致的代谢紊乱引起相关损伤因素累及微血管后出现的一种严重且常见的并发症,研究表明2011年起DKD已发展成为我国慢性肾脏病的首要原因[1]。损伤因素作用于肾脏导致微量白蛋白尿,而蛋白尿反过来加重肾脏损害,最终发展为大量蛋白尿,乃至终末期肾病,其中足细胞受损被认为是关键环节[2]。炎症反应是目前DKD发病机制的研究热点[3]。细胞焦亡作为一种伴随剧烈炎症反应的细胞程序性死亡,以Nod样受体蛋白3(NLRP3)炎症小体形成、半胱天冬酶1(Caspase-1)活化、消皮素D(GSDMD)暴露N端结构域、促炎因子白介素1β(IL-1β)、白介素18(IL-18)释放为特征[4]。焦亡在DKD中起到的作用也被实验证实,有研究表明高糖导致机体氧化应激会使NLRP3炎症小体活化,从而引起肾脏组织细胞发生焦亡损伤并扩大炎症反应[5]。作为扩大炎症反应的一环,转化生长因子β1(TGF-β1)则会受到IL-1β调节而产生,并损伤足细胞[6]。医学上通常将海拔2 500 m以上,并可引起人体相应生物效应的地区称为高原地区[7],该地区DKD患者的病情通常有着更快的进展速度[8]。
红景天苷是传统中药材红景天的有效成分,其对于因缺氧而损伤的组织有着很好的保护效应,临床实践中已被广泛用于治疗急性高原反应以及慢性缺氧所致的疾病[9],研究表明红景天苷可以通过抑制NLRP3的激活、改善线粒体代谢功能等多种方式发挥对DKD的保护作用[10]。本研究通过观察低氧环境下大鼠的生化指标、肾组织病理、足细胞损伤及NLRP3/IL-1β/TGF-β1信号通路介导的细胞焦亡相关蛋白表达情况,进一步探究低氧环境下红景天苷对DKD大鼠的治疗机制,从而为低氧环境下的DKD进展提供新的治疗方案。
1 材料与方法
1.1 实验时间
2022年3月—2023年3月。
1.2 实验动物
40只6周龄SPF级SD雄性大鼠,平均体质量(160±10)g,购自成都达硕实验动物科技有限公司,实验动物许可证号:SYXK(川)2019-189。饲养温度22~25 ℃,相对湿度(60±10)%,12 h/12 h明暗交替,自由摄食水,适应性饲养1周。本研究经青海大学附属医院科研伦理委员会批准(P-SL-2021163)。
1.3 主要试剂
红景天苷(粉末,上海碧云天生物技术有限公司,货号:SM8036);链脲佐菌素(STZ)(美国sigma公司,货号:V900890);二乙基二硫代氨基甲酸酯(DDC)(美国sigma公司,批号:S-0319);柠檬酸钠无菌缓冲液(Solarbio公司,货号:C1010);BCA蛋白定量试剂盒(赛默飞,货号:23225);RIPA细胞裂解液、蛋白酶抑制剂(上海碧云天生物技术有限公司,货号:P0013C、P1005);相关蛋白一抗、HRP-羊抗兔/小鼠二抗(赛默飞,货号:MA5-32255、14-9832-82、PA5-119680、MA1-21595、A-21247);IL-1β、IL-18酶联免疫吸附试验(ELISA)试剂盒(武汉伊莱瑞特有限公司,货号:E-EL-R0012c、E-EL-R0567c)。
1.4 动物分组、造模、给药
随机抽取8只大鼠作为对照组,继续予以常规饲料喂养,其余大鼠进行造模。造模大鼠予以高脂、高糖饲料(0.5%胆固醇、5%蛋黄粉、10%猪油、10%蔗糖)喂养4周后每日腹腔注射35 mg/kg STZ,连续4 d,末次注射72 h后测空腹血糖(FBG),若FBG≥16.7 mmol/L,则判定糖尿病模型造模成功,继续予以高脂、高糖饲料喂养4周后,转移至代谢笼,收集24 h尿液,24 h尿蛋白定量≥30 mg,则判定DKD大鼠造模成功。最终DKD大鼠造模成功24只。将造模成功大鼠随机分为模型组、红景天苷组、红景天苷+NLRP3激活剂组,每组8只,并将包括对照组在内的4组大鼠置于低压、低氧氧舱内(模拟海拔5 000 m,温度20~26℃,相对湿度40%~70%),参照文献[11]的方法,红景天苷组予以红景天苷80 mg/kg灌胃(以10 mg∶1 mL比例溶于0.9%氯化钠溶液中),1次/d;红景天苷+NLRP3激活剂组予以同等剂量红景天苷灌胃1 h后予以DDC 300 mg/kg灌胃[12],隔天1次;其余各组予以同等体积蒸馏水灌胃,连续饲养4周。
1.5 大鼠生化指标检测
末次给药后将大鼠代谢笼收集尿液后使用戊巴比妥钠40 mg/kg麻醉,腹主动脉取血,离心后使用全自动生化分析仪测定各组大鼠总胆固醇(TC)、三酰甘油(TG)、FBG、尿素氮(BUN)、血肌酐(Scr)、尿微量白蛋白(UMA)水平。
1.6 苏木素-伊红(HE)染色及透射电镜观察大鼠肾脏病理改变情况
将麻醉后的大鼠解剖、分离出双侧肾脏,收集肾组织标本,各组随机选取4例将肾组织标本置于4%多聚甲醛溶液中固定48 h,脱水、石蜡包埋切片,将切片脱蜡水化,进行HE染色,置于光学显微镜下观察。将各组随机选取3例少量肾组织标本置于2.5%戊二醛中进行固定,脱水、包埋、切片及染色后在电镜下观察足细胞超微结构。
1.7 ELISA检测大鼠血清IL-1β、IL-18水平
参照试剂盒操作方法检测血清标本IL-1β、IL-18水平。
1.8 免疫印迹试验(Western bloting)检测肾组织Caspase-1、GSDMD、NLRP3和TGF-β1蛋白表达水平
将剪碎的肾组织置入RIPA裂解液离心后提取总蛋白,采用BCA法测定蛋白浓度,行凝胶电泳分离并转膜,使用5%脱脂奶粉于室温中封闭2 h,加入NLRP3、Caspase-1、TGF-β1、GSDMD一抗并按比例稀释,4 ℃孵育过夜,洗涤后加入二抗,温室孵育2 h,增强化学发光显色处理过后置于发光图像分析仪上分析。
1.9 统计学方法
采用SPSS 20.0统计学软件进行数据分析,符合正态分布的计量资料以(x-±s)表示,两组比较采用两独立样本t检验,同组造模前后比较采用配对样本t检验,多组间比较使用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 造模前后大鼠体质量比较
造模前对照大鼠与造模大鼠體质量比较,差异无统计学意义(P>0.05);造模后造模大鼠体质量低于对照大鼠,差异有统计学意义(P<0.05)。组内比较结果显示,对照大鼠和造模大鼠造模后体质量均高于造模前,差异有统计学意义(P<0.05),见表1。
表1 造模前后对照大鼠与造模大鼠体质量比较(x-±s,g)
Table 1 Comparison of body mass between the two groups of rats before and after modeling
组别 只数 造模前 造模后 t配对值 P值
对照大鼠 8 170.4±7.8 439.7±14.1 -53.99 <0.05
造模大鼠 24 173.0±6.6 328.7±17.7 -44.86 <0.05
t值 -0.95 16.08
P值 0.35 <0.05
2.2 各组大鼠生化指标检测结果
各组大鼠TG、TC、FBG、UMA、BUN、Scr比较,差异均有统计学意义(P<0.05),其中与对照组相比,模型组大鼠TG、TC、FBG、UMA、BUN、Scr水平明显升高(P<0.05);与模型组相比,红景天苷组大鼠BUN、UMA、Scr水平明显降低(P<0.05);与红景天苷组相比,红景天苷+NLRP3激活剂组大鼠UMA、BUN、Scr水平明显升高(P<0.05),见表2。
2.3 各组大鼠肾组织HE染色结果
对照组可见肾小管轻微空泡变性;模型组与对照组相比大鼠肾小管上皮细胞明显肿胀及变性坏死;红景天苷组与模型组相比肾组织病理改变明显减轻;红景天苷+NLRP3激活剂组与红景天苷组相比部分肾小管上皮细胞变性坏死加重。各组大鼠肾组织HE染色结果见图1。
2.4 各组大鼠肾组织透射电镜结果
对照组足细胞无明显病理变化;模型组与对照组相比足细胞内线粒体发生严重肿胀,足突区域部分融合,基底膜可见弥漫性增厚;红景天苷组与模型组相比足细胞线粒体肿胀、足突融合及基底膜增厚情况有所改善;红景天苷+NLRP3激活剂组与红景天苷组相比足细胞线粒体肿胀加重、足突融合增加,基底膜弥漫性增厚。各组大鼠肾组织透射电镜结果见图2。
2.5 各组大鼠血清IL-1β、IL-18水平
各组大鼠血清IL-1β、IL-18水平比较,差异有统计学意义(P<0.05),其中与对照组相比,模型组血清IL-1β、IL-18水平升高;与模型组相比,红景天苷组大鼠血清IL-1β、IL-18水平降低;与红景天苷组相比,红景天苷+NLRP3激活剂组IL-1β、IL-18水平升高,差异均有统计学意义(P<0.05),见表3。
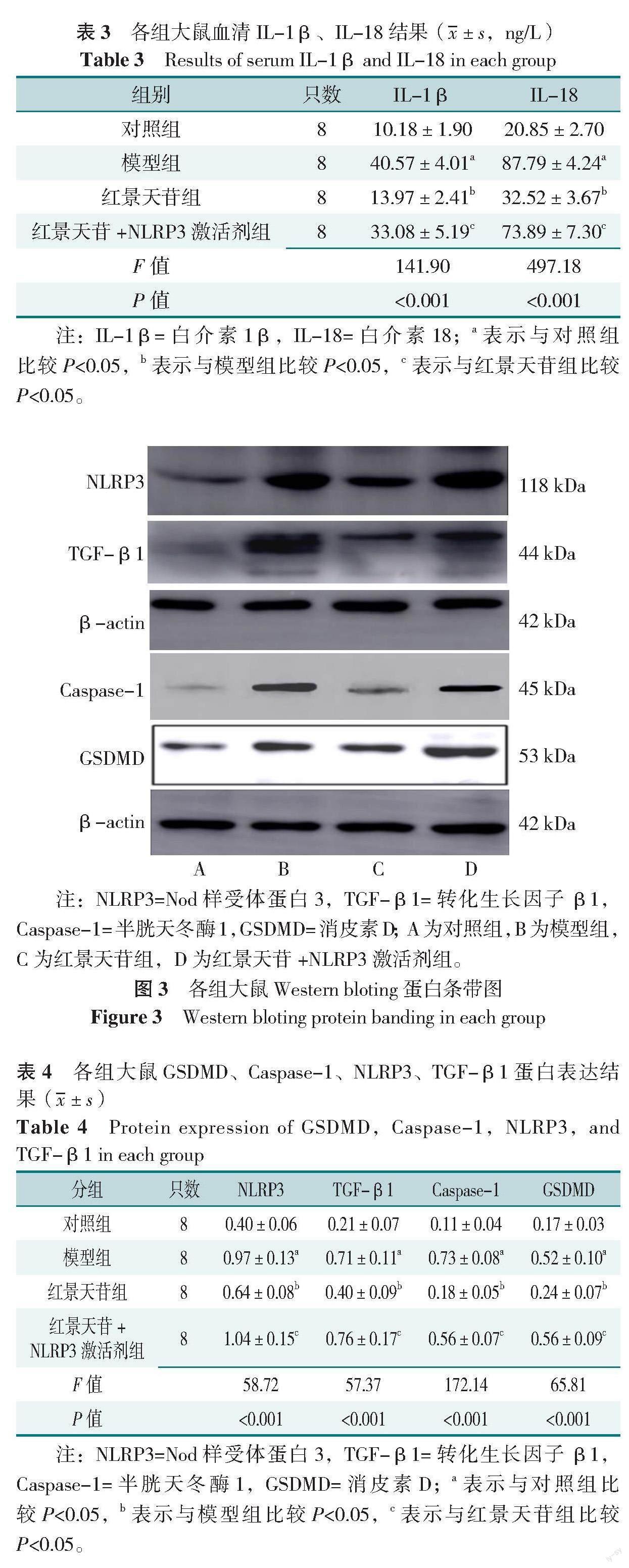
2.6 各组大鼠GSDMD、Caspase-1、NLRP3、TGF-β1蛋白表达结果
各组大鼠GSDMD、Caspase-1、NLRP3、TGF-β1蛋白表达水平比较,差异有统计学意义(P<0.05),其中与对照组比较,模型组Caspase-1、GSDMD、NLRP3、TGF-β1蛋白表达明显升高;与模型组比较,红景天苷组Caspase-1、GSDMD、NLRP3、TGF-β1蛋白表达明显降低;与红景天苷组比较,红景天苷+NLRP3激活剂组Caspase-1、GSDMD、NLRP3、TGF-β1蛋白表达明显升高,差异均有统计学意义(P<0.05),见图3、表4。
3 讨论
作为糖尿病重要微血管并发症的DKD可导致终末期肾脏病的发生,严重降低了患者的生活质量并给国家医疗系统造成了沉重的负担[13],而高原低氧的环境则可以进一步加快DKD的进展[14]。临床工作中可以注意到许多DKD患者早期除了糖尿病相关症状外通常没有明显临床表现,只有当肢体出现水肿或其他浆膜腔大量积液时才会察觉,此时DKD一般已经进展到了Ⅳ期甚至可以到达Ⅴ期。因此临床上目前对DKD强调早期诊断并采取针对性的保护措施,微量白蛋白尿是早期DKD的标志,同样也会加重肾脏的损害[15],而作为肾脏滤过屏障中最为关键的足细胞被认为与微量白蛋白尿的发生密不可分[16]。DKD拥有错综复杂的发病机制,既往研究忽略了细胞焦亡所起到的作用,随着越来越多的实验展开,焦亡机制也逐渐被重视,经典通路的细胞焦亡通过炎症小体受体NLRP3感受上游损伤信号[4],活化的NLRP3与接头蛋白ASC以及pro-Caspase-1共同组成炎症小体复合物,前体形式的Caspase-1在该炎症小体复合物的激活作用下转变为有活性的Caspase-1。Caspase-1一方面可以切割焦亡标志性蛋白GSDMD,另一方面可以活化促炎因子IL-1β以及IL-18[17-18]。TGF-β1具有促进细胞外基质积累的作用,并抑制这些过度积累的细胞外基质降解,从而导致组织发生病理变化,对机体造成损害[19],在过度的细胞焦亡中随着IL-1β被大量激活释放,TGF-β1过度产生[20]。胡龙江等[21]研究发现糖尿病患者体内的NLRP3/IL-1β/TGF-β1信号通路相关蛋白、Caspase-1、GSDMD蛋白表达显著增加,并认为该通路介导的细胞焦亡对糖尿病相关并发症的发展有重要作用。本研究观察到对照组的HE染色可见肾小管上皮细胞轻度空泡变性,考虑系低氧环境可以对肾脏造成一定损伤所致。与对照组相比,模型组大鼠生化指标均升高,肾间质及足细胞出现明显损伤,血清IL-1β、IL-18水平升高,肾组织NLRP3、TGF-β1、Caspase-1、GSDMD蛋白表达明显增加。因此认为低氧环境下DKD大鼠的足细胞损伤可能与NLRP3/IL-1β/TGF-β1信号轴介导的细胞焦亡密切相关。
红景天苷在现代药理学中被证实具有抗炎、抗缺氧等方面的功效[22],对DKD的潜在治疗价值方面也有实验相佐证,有报道证实其可以通过抑制NLRP3的激活改善高糖刺激下大鼠肾小球系膜细胞的增殖以及细胞外基质的累积[23]。本研究可见,当应用红景天苷干预大鼠4周后,肾小管病变减轻,肾功能指标改善、UMA减少,足细胞损伤也得到了显著改善,血清IL-1β、IL-18及焦亡发生相关蛋白的表达均明显降低,但血糖、血脂水平较模型组无明显改变,与朴敏虎等[24]使用红景天苷100 mg-1·kg-1·d-1干预DKD大鼠10周可降低血糖及血脂水平的实验结果有所不同。一方面可能是两项实验使用红景天苷干预的剂量和时间不同,另一方面不排除低氧环境可能对实验结果产生了一定影响。本课题组发现低氧环境下红景天苷可以早期通过抑制NLRP3/IL-1β/TGF-β1信号通路从而改善足细胞焦亡损伤进而发挥肾脏保护作用。此外本研究同时设置了红景天苷+NLRP3激活剂组,通过将其与红景天苷组比较,发现在应用红景天苷的同时加用NLRP3激活剂后,电镜下可以观察到足细胞再次出现明显病变,细胞焦亡相关蛋白表达水平及血清IL-1β、L-18显著上调,同时肾功能指标出现恶化,说明NLRP3激活剂减弱了红景天苷的效应,证实了前述的推论,并且说明该效应与红景天苷拮抗NLRP3密切相关。
综上所述,红景天苷可以在低氧环境中以不降低血糖和血脂为前提,改善DKD大鼠的肾功能及焦亡导致的足细胞损伤。该效应可能是以NLRP3/IL-1β/TGF-β1信号通路为靶向产生,这在一定程度上阐明了红景天苷在低氧环境下保护DKD的具体作用机制,证明了红景天苷在治疗DKD领域有着广阔的应用前景。
作者贡献:李佳武参与设计研究方案、论文撰写与修改、后期审查;李佳武、秦凤、宋生琴、翟婷负责动物实验实施、样本采集、指标化验及检测;辛宏云负责数据整理、数据录入、统计分析、图片整理;巴应贵负责研究的设计、研究质量控制、指导论文撰写及论文内容审校。
本文无利益冲突。
参考文献
ZHANG L X,LONG J Y,JIANG W S,et al. Trends in chronic kidney disease in China[J]. N Engl J Med,2016,375(9):905-906. DOI:10.1056/NEJMc1602469.
DENHEZ B,GERALDES P. Regulation of nephrin phosphorylation in diabetes and chronic kidney injury[J]. Adv Exp Med Biol,2017,966:149-161. DOI:10.1007/5584_2017_62.
JUNG S W,MOON J Y. The role of inflammation in diabetic kidney disease[J]. Korean J Intern Med,2021,36(4):753-766. DOI:10.3904/kjim.2021.174.
SEOK J K,KANG H C,CHO Y Y,et al. Therapeutic regulation of the NLRP3 inflammasome in chronic inflammatory diseases[J]. Arch Pharm Res,2021,44(1):16-35. DOI:10.1007/s12272-021-01307-9.
QIU Y Y,TANG L Q. Roles of the NLRP3 inflammasome in the pathogenesis of diabetic nephropathy[J]. Pharmacol Res,2016,114:251-264. DOI:10.1016/j.phrs.2016.11.004.
CALLE P,HOTTER G. Macrophage phenotype and fibrosis in diabetic nephropathy[J]. Int J Mol Sci,2020,21(8):2806. DOI:10.3390/ijms21082806.
WEST J B. Recent advances in high altitude medicine and biology[J]. High Alt Med Biol,2015,16(2):73. DOI:10.1089/ham.2015.28999.jbw.
SAYARLIOGLU H,ERKOC R,DOGAN E,et al. Nephropathy and retinopathy in type 2 diabetic patients living at moderately high altitude and sea level[J]. Ren Fail,2005,27(1):67-71.
崔雅妹,穆超超,李书宁,等. 红景天临床应用概况[J]. 实用中医内科雜志,2019,33(4):74-77. DOI:10.13729/j.issn.1671-7813.z20190006.
XUE H Y,LI P P,LUO Y S,et al. Salidroside stimulates the Sirt1/PGC-1α axis and ameliorates diabetic nephropathy in mice[J]. Phytomedicine,2019,54:240-247. DOI:10.1016/j.phymed.2018.10.031.
LI R,GUO Y J,ZHANG Y M,et al. Salidroside ameliorates renal interstitial fibrosis by inhibiting the TLR4/NF-κB and MAPK signaling pathways[J]. Int J Mol Sci,2019,20(5):1103. DOI:10.3390/ijms20051103.
朱四民,王会芳,林凤平,等. 葛根提取物通过调控NOD样受体蛋白3/半胱氨酸天冬氨酸蛋白酶1通路减轻糖尿病大鼠肾损伤的研究[J]. 中国糖尿病杂志,2019,27(11):852-857. DOI:10.3969/j.issn.1006-6187.2019.11.010.
TSAI J L,CHEN C H,WU M J,et al. New approaches to diabetic nephropathy from bed to bench[J]. Biomedicines,2022,10(4):876. DOI:10.3390/biomedicines10040876.
ZHAO L J,WANG X,WANG T L,et al. Associations between high-altitude residence and end-stage kidney disease in Chinese patients with type 2 diabetes[J]. High Alt Med Biol,2020,
21(4):396-405. DOI:10.1089/ham.2020.0076.
ZOJA C,ABBATE M,REMUZZI G. Progression of renal injury toward interstitial inflammation and glomerular sclerosis is dependent on abnormal protein filtration[J]. Nephrol Dial Transplant,2015,30(5):706-712. DOI:10.1093/ndt/gfu261.
DIMAS G G,DIDANGELOS T P,GREKAS D M. Matrix gelatinases in atherosclerosis and diabetic nephropathy:progress and challenges[J]. Curr Vasc Pharmacol,2017,15(6):557-565. DOI:10.2174/1570161115666170202162345.
LATZ E,XIAO T S,STUTZ A. Activation and regulation of the inflammasomes[J]. Nat Rev Immunol,2013,13(6):397-411. DOI:10.1038/nri3452.
SHI J J,ZHAO Y,WANG K,et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J]. Nature,2015,526(7575):660-665. DOI:10.1038/nature15514.
REDONDO S,NAVARRO-DORADO J,RAMAJO M,et al. The complex regulation of TGF-β in cardiovascular disease[J]. Vasc Health Risk Manag,2012,8:533-539. DOI:10.2147/VHRM.S28041.
KOLB M,MARGETTS P J,ANTHONY D C,et al. Transient expression of IL-1beta induces acute lung injury and chronic repair leading to pulmonary fibrosis[J]. J Clin Invest,2001,107(12):1529-1536. DOI:10.1172/JCI12568.
胡龙江,周音频,曹运兰,等. NLRP3-ASC-Caspase-1-IL-18/IL-1β-TGF-β信号通路与Ⅱ型糖尿病临床相关性研究[J]. 西部医学,2018,30(3):335-340,346. DOI:10.3969/j.issn.1672-3511.2018.03.005.
PU W L,ZHANG M Y,BAI R Y,et al. Anti-inflammatory effects of Rhodiola rosea L:a review[J]. Biomed Pharmacother,2020,121:109552. DOI:10.1016/j.biopha.2019.109552.
WANG S Y,ZHAO X X,YANG S X,et al. Salidroside alleviates high glucose-induced oxidative stress and extracellular matrix accumulation in rat glomerular mesangial cells by the TXNIP-NLRP3 inflammasome pathway[J]. Chem Biol Interact,2017,278:48-53. DOI:10.1016/j.cbi.2017.10.012.
樸敏虎,王程瑜,李香丹,等. 红景天苷对糖尿病肾病大鼠的治疗作用及其机制探讨[J]. 山东医药,2017,57(10):34-36. DOI:10.3969/j.issn.1002-266X.2017.10.010.
(收稿日期:2023-07-28;修回日期:2023-12-05)
(本文编辑:邹琳)
