RasGRP1启动子区甲基化对脂多糖诱导人T淋巴细胞炎症的作用及机制*
2024-04-22刘磊刘美言高源1闵洁煜1殷永强钟毅
刘磊, 刘美言, 高源1,, 闵洁煜1,, 殷永强, 钟毅
(1.贵州医科大学附属医院 麻醉科, 贵州 贵阳 550001; 2.贵州医科大学 麻醉学院, 贵州 贵阳 550004)
脓毒症是宿主对感染的反应失调引起的危及生命的器官功能障碍,严重时可发展为脓毒症休克,甚至死亡[1]。DNA甲基化是一种重要的表观遗传学修饰,已有研究表明在脓毒症诊疗中某些基因的甲基化修饰对患者疾病转归具有重要作用[2]。在脓毒症早期炎症阶段,体内数千个基因的表达就已经发生了改变,涉及数百个基因的DNA甲基化水平也发生了改变[3-4],这些基因大多与细胞炎症反应和干扰素(interferon,IFN)信号转导有关,同时还能够决定T细胞的分化方向[5-6]。Hopp等[7]在对社区获得性肺炎患者全血样本的分析中发现,DNA甲基化在脓毒症的急性炎症中起重要作用;新生儿脓毒症患者中炎症相关基因的甲基化水平有显著改变,某些基因的DNA甲基化可作为生物标志物区分早期和晚期脓毒症[8]。采用生物信息学分析筛选脓毒症诊断和预后生物标志物[9],并结合本课题组前期研究,RAS鸟苷酸释放蛋白1(ras guanyl nucleotide releasing protein 1,RasGRP1)在脓毒症患者中存在表达差异且甲基化程度高。因此,本研究旨在通过由细菌脂多糖(lipopolysaccharide,LPS)诱导淋巴细胞炎症模型,使用甲基化转移酶抑制剂5-Aza-2′-脱氧胞苷(5-Aza-2′-deoxycytidine)与LPS共处理,验证RasGRP1及其甲基化修饰在LPS诱导淋巴细胞炎症模型中的作用。
1 材料与方法
1.1 实验材料
1.1.1细胞株来源 人T淋巴细胞白血病细胞JurkatE6-1(CL-0129),由武汉普诺赛生命科技有限公司提供,由学校转化医学研究中心保存。
1.1.2主要试剂与仪器 JurkatE6-1细胞专用培养基洛斯维·帕克纪念研究所(Roswell Park Memorial Institute,RPMI)1640培养基,由武汉普诺赛生命科技有限公司提供;甲基化转移酶抑制剂5-Aza-2′-脱氧胞苷(美国MedChemExpress公司),脂多糖(北京索莱宝科技有限公司),细胞总RNA、DNA提取试剂盒(广州美基生物科技有限公司),二喹啉甲酸(bicinchoninicacid,BCA)蛋白定量试剂盒(上海碧云天生物技术有限公司),DNA重亚硫酸盐转化试剂盒(北京天根生化科技有限公司),RasGRP1一抗、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)一抗、磷酸化细胞外调节蛋白激酶(phosphorylated extracellular regulated protein kinases,p-ERK1/2)一抗(武汉ABclonal公司),3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗(武汉三鹰生物技术有限公司),山羊抗兔二抗(英国Abcam公司),实时荧光定量PCR(real-time fluorescent quantitative PCR,RT-qPCR)第一链互补DNA(complementary DNA,cDNA)合成试剂盒、荧光定量试剂盒(上海翌圣生物科技股份有限公司),酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒(武汉伊莱瑞特生物科技股份有限公司),乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒(南京建成生物工程有限公司);酶标仪(美国Thermo Fisher 公司),CFX96实时荧光PCR仪(美国Bio-Rad公司),奥林巴斯激光共聚焦显微镜(日本Olympus公司)。
1.2 研究方法
1.2.1细胞培养和分组 JurkatE6-1细胞复苏后使用RPMI-1640培养基于5% CO2、37 ℃的培养箱培养;取生长状态良好的细胞计数后接种于培养皿中,细胞培养箱中培养24 h,使细胞同步化;当细胞生长至融合度达80%左右时传代并进行后续实验;确认细胞生长状态良好后,分为对照(完全培养基,C)组、1 mg/L(低浓度)LPS(L1)组、10 mg/L(高浓度)LPS(L2)组及10 μmol/L甲基化转移酶抑制剂5-Aza-2′-脱氧胞苷+10 mg/L LPS(LA)组。LA组细胞给予10 μmol/L 5-Aza-2′-脱氧胞苷处理4 d,期间每12 h更换含相同浓度5-Aza-2′-脱氧胞苷的完全培养基;C组、L1组及L2组等时等量完全培养基换液4 d。持续4 d,L1组细胞予1 mg/L LPS处理24 h,L2组和LA组细胞给予10 mg/L LPS处理24 h,C组细胞继续用完全培养基培养24 h。各组细胞继续培养24 h,1 200 r/min离心3 min,收集细胞、取上清夜,保存于-80 ℃冰箱。
1.2.2荧光显微镜观察细胞形态学变化 取“1.2.1”项下处于对数生长期的JurkatE6-1细胞(5×106个/孔)接种于六孔板,分组及处理同“1.2.1”,置于荧光显微镜下观察细胞形态学变化。
1.2.3ELISA法检测细胞上清液炎症因子浓度和比色法检测LDH活性 取“1.2.1”项下处于对数生长期的JurkatE6-1细胞(5×106个/孔)接种于六孔板,分组及处理同“1.2.1”,参照ELISA试剂盒,使用酶标仪检测各孔450 nm处的吸光度值,绘制标准曲线,计算肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)浓度;参照LDH测定试剂盒,使用酶标仪测定450 nm处吸光度值,绘制标准曲线,计算LDH活性。
1.2.4RT-qPCR法检测细胞中总RNA的表达 取“1.2.1”项下处于对数生长期的JurkatE6-1细胞(5×106个/孔)接种于6孔板,分组及处理同“1.2.1”,参照细胞总RNA提取试剂盒,按照说明书提取细胞总RNA,测定总RNA浓度和纯度。按照说明书逆转录合成第一链cDNA;使用RT-qPCR试剂盒,按说明书进实验,扩增条件为95 ℃预变性2 min,95 ℃变性10 s、60 ℃退火延伸30 s、共40个循环;以GAPDH为内参,以2-ΔΔCt法计算RasGRP1、ERK1/2、TNF-α、IL-6、DNA甲基转移酶(DNA methyl trans-ferases,DNMT)1、DNMT3a基因mRNA的相对表达量。引物序列见表1。
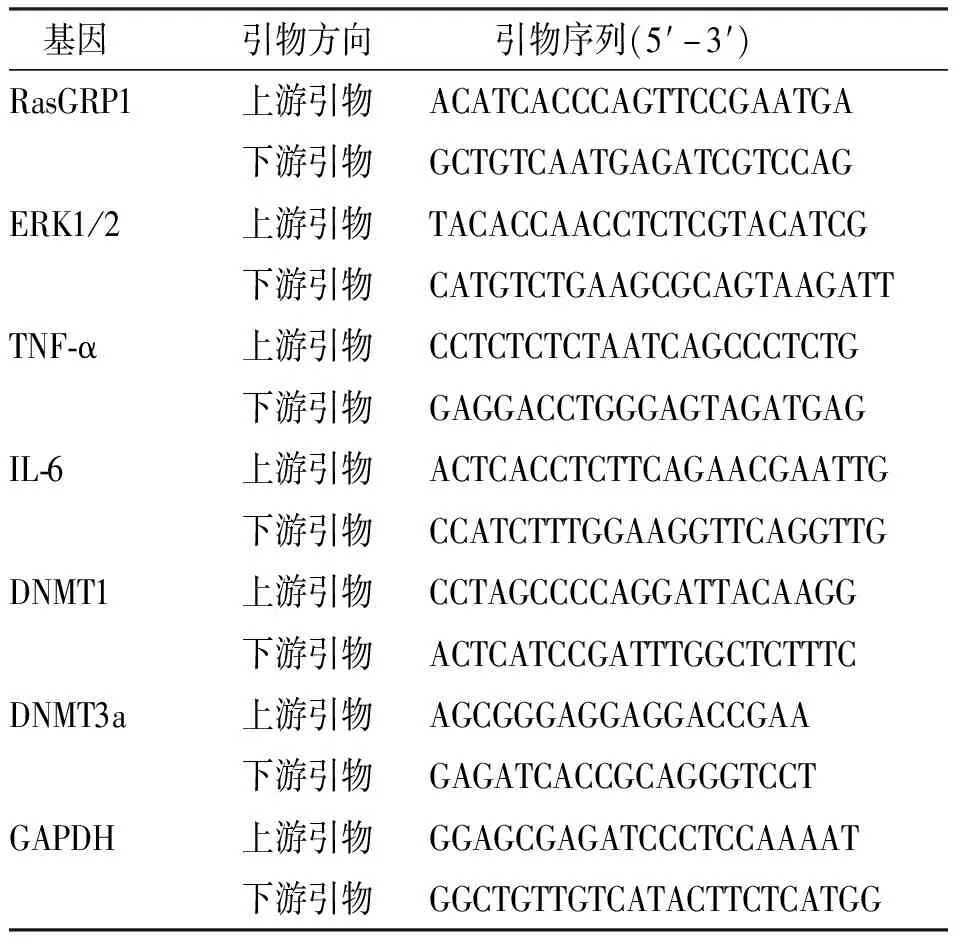
表1 RT-qPCR引物序列Tab.1 Primer sequences of RT-qPCR
1.2.5Western blotting法检测细胞RasGRP1、ERK1/2及p-ERK1/2蛋白的表达 取“1.2.1”项下处于对数生长期的JurkatE6-1细胞(5×106个/孔)接种于六孔板,分组及处理同“1.2.1”,加适量细胞裂解液,充分裂解后4 ℃、12 000 r/min离心10 min,收集上清液,使用BCA蛋白定量试剂盒检测蛋白质浓度,定量后蛋白质经95 ℃煮沸10 min变性,-80 ℃冰箱中备用;取待测样本50 μg于10%聚丙烯酰胺凝胶进行电泳,结束后将分离的蛋白转印至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF);高效封闭液封闭30 min,加一抗RasGRP1(1∶1 000)、ERK1/2(1∶1 500)、p-ERK1/2(1∶1 000)及GAPDH(1∶2 000),4 ℃孵育过夜;第2天洗膜后加入辣根过氧化物酶标记的山羊抗兔二抗(1∶ 6 000)孵育,室温下轻摇1.5 h,洗膜后于化学发光法显色,用红外成像仪对膜进行扫描;以GAPDH为内参,ImageJ软件进行蛋白灰度值相对定量分析。
1.2.6甲基化特异性PCR(methylating-specific PCR,MSP)法和琼脂糖凝胶电泳检测RasGRP1启动子区甲基化状态 取“1.2.1”项下处于对数生长期的JurkatE6-1细胞(5×106个/孔)接种于6孔板,分组及处理同“1.2.1”,使用DNA提取试剂盒提取细胞DNA,使用DNA重亚硫酸盐转化试剂盒将DNA样品中非甲基化胞嘧啶转化为尿嘧啶,而甲基化胞嘧啶保持不变,因此使用Methyl Primer Express v1.0软件设计出甲基化引物和非甲基化引物。引物序列如下:RasGRP1非甲基化引物(unmethylation primer,UM)的上游引物序列为5-ATTGTAGTGTTTTGAGTAGTGGTT-3,下游引物序列为5-AAAACAAACTCCCAACTACCA-3;RasGRP1甲基化引物(methylation primer ,M)的上游引物序列为5-GTAGTGTTTCGAGTAGCGGTC-3,下游引物序列为5-AACGAACTCCCGACTACC-3。将经过DNA重亚硫酸盐转化试剂盒处理后的DNA样本按照设计好的引物序列进行甲基化特异性PCR,扩增条件:95 ℃ 5 min预变性,94 ℃ 20 s、60 ℃ 30 s、72 ℃ 20 s,共35个循环,再以72 ℃扩增5 min。将扩增产物经160 V琼脂糖凝胶电泳25 min,用凝胶成像分析系统对凝胶进行拍照。
1.3 统计学分析
2 结果
2.1 细胞形态学
各组细胞相应处理5 d后,光学显微镜结果显示(图1),C组JurkatE6-1细胞生长状态良好;L1组、L2组使用LPS处理24 h后细胞数量明显减少,细胞形态趋于碎片化,死亡细胞逐渐增加,随LPS浓度增加而增加;LA组使用甲基化转移酶抑制剂5-Aza-2′-脱氧胞苷预处理4 d、LPS处理细胞24 h后,较L2组细胞数量及形态明显好转。

图1 各组JurkatE6-1细胞相应处理5 d后明视夜野下细胞数量及形态(20×)Fig.1 The number and morphology of JurkatE6-1 cells in each group after 5 days of treatment under bright light field (20×)
2.2 细胞炎症损伤水平
LPS处理细胞24 h后,ELISA和RT-qPCR结果显示(表2),与C组比较,L1组细胞上清液LDH活性和TNF-α、IL-6浓度及其mRNA表达升高,差异均有统计学意义(P<0.05);与L1组比较,L2组细胞上清液LDH活性和TNF-α、IL-6浓度及其mRNA表达升高,差异均有统计学意义(P<0.05);与L2组比较,LA组细胞上清液LDH活性和TNF-α、IL-6浓度及mRNA表达降低,差异均有统计学意义(P<0.05)。
表2 各组细胞LDH活性和TNF-α、IL-6浓度及mRNA表达Tab.2 LDH activity, the concentrations and mRNA expression levels of TNF-α and IL-6 in each
2.3 细胞RasGRP1和ERK1/2 mRNA的表达
LPS处理细胞24 h,RT-qPCR结果显示(表3),与C组比较,L1组细胞RasGRP1 mRNA表达升高,差异有统计学意义(P<0.05);与L1组比较,L2组细胞RasGRP1 mRNA表达降低,差异有统计学意义(P<0.05);与L2组比较,LA组细胞RasGRP1 mRNA表达升高,差异有统计学意义(P<0.05);各组间ERK1/2 mRNA表达比较,差异无统计学意义(P>0.05)。
表3 各组细胞RasGRP1和ERK1/2 mRNA的表达Tab.3 mRNA expression levels of RasGRP1 and ERK1/2 in each
2.4 细胞RasGRP1、ERK1/2及p-ERK1/2蛋白的表达
LPS处理细胞24 h,Western blotting结果显示(图2),与C组比较,L1组细胞RasGRP1、p-ERK1/2蛋白表达升高(P<0.05),差异均有统计学意义(P<0.05);与L1组比较,L2组细胞RasGRP1、p-ERK1/2蛋白表达降低(P<0.05),差异均有统计学意义(P<0.05);与L2组比较,LA组细胞RasGRP1、p-ERK1/2蛋白表达升高(P<0.05),差异均有统计学意义(P<0.05);各组间ERK1/2 蛋白总量比较,差异无统计学意义(P>0.05)。

注:A为各组细胞蛋白表达的Western blotting检测结果;B:各组细胞蛋白表达的定量结果;(1)与C组比较,P<0.05;(2)与L1组比较,P<0.05;(3)与L2组比较,P<0.05。
2.5 细胞DNMT1和DNMT3a mRNA的表达
甲基化转移酶抑制剂5-Aza-2′-脱氧胞苷预处理4 d,LPS处理细胞24 h后,RT-qPCR结果显示(表4),与C组比较,L1组DNMT1、DNMT3a mRNA表达比较,差异无统计学意义(P>0.05);与L1组比较,L2组DNMT1、DNMT3a mRNA表达升高,差异均有统计学意义(P<0.05);与L2组比较,LA组DNMT1、DNMT3a mRNA表达降低,差异均有统计学意义(P<0.05)。
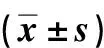
表4 各组细胞DNMT1和DNMT3a mRNA的表达Tab.4 mRNA expressions of DNMT1 and DNMT3a
2.6 RasGRP1启动子区甲基化状态
甲基化转移酶抑制剂5-Aza-2′-脱氧胞苷预处理4 d,LPS处理细胞24 h后,MSP及琼脂糖凝胶电泳结果显示(图3),与C组比较,L1组RasGRP1启动子区未检测到甲基化改变;与L1组比较,L2组RasGRP1启动子区呈现高甲基化表达;与L2组比较,LA组RasGRP1启动子区未检测到甲基化。

注:U为非甲基化引物扩增产物,M为甲基化引物扩增产物。
3 讨论
脓毒症是一种病理生理机制难以阐明的临床综合征,现免疫抑制已被公认是脓毒症患者重要死亡原因之一[10]。近年来,脓毒症导致的免疫抑制可能比最初的高炎症反应更能导致死亡率上升,免疫抑制程度较高的基因与死亡率增加相关[11]。在脓毒症的发展过程中,淋巴细胞等免疫细胞凋亡可导致免疫功能紊乱,导致对继发感染的敏感性增加,促炎反应和抗炎反应失衡,严重时可发展为多器官功能障碍,甚至引起死亡[12-13]。与本研究结果一致,使用LPS处理引起淋巴细胞炎症损伤,细胞数量减少,碎片化细胞增多,且随浓度升高而加重;因此,本研究使用不同浓度LPS诱导JurkatE6-1细胞炎症模型,探究体外脓毒症可能的发病机制。
RasGRP1又称RAS鸟苷酸释放蛋白1,是鸟嘌呤核苷酸交换蛋白家族成员之一,主要在T淋巴细胞中表达,通过介导抗原启动的信号通路激活淋巴细胞中的Ras-Raf-MEK-ERK通路,调控T细胞激活和发育[14]。RasGRP1表达异常的患者会出现淋巴细胞功能障碍,而适应性免疫功能受损增加了对各种病原体反复、早发和严重感染的易感性[15]。研究发现,核受体相关转录因子1(nuclear receptor related 1,Nurr1)通过与RasGRP1基因第二内含子中特定位置结合来调节LPS诱导的炎症信号级联反应,在转录水平负向调节RasGRP1的表达,在神经炎症中起到抗炎介质的作用[16];在自身免疫的患者中,活动性炎症的严重程度与CD4+T细胞中RasGRP1水平降低相关[17]。另外,Guo等[18]在RasGRP1基因敲除小鼠行盲肠结扎穿刺的脓毒症模型研究中发现,RasGRP1敲除小鼠的IgM抗体分泌和IL-10产生的障碍,且10 d存活率明显降低,表明RasGRP1基因缺陷增加了小鼠患脓毒症的敏感性;以上研究表明,RasGRP1与脓毒症炎症反应密切相关。与本研究结果一致,JurkatE6-1细胞在低浓度LPS处理后RasGRP1的表达升高;高浓度LPS处理后,RasGRP1表达下降,DNMT1、DNMT3a mRNA的表达升高。不同浓度LPS诱导后RasGRP1表达趋势相反,可能是低浓度LPS刺激淋巴细胞保护性应激反应使其表达升高,而高浓度LPS刺激细胞导致严重的炎症反应,并可能诱导了RasGRP1启动子区高甲基化,基因表达水平受到抑制;为了进一步验证RasGRP1启动子区甲基化改变其及在炎症反应中调控作用,本研究使用甲基化转移酶抑制剂5-Aza-2′-脱氧胞苷和LPS共处理JurkatE6-1细胞,使用DNA重亚硫酸盐转化法,将DNA样品中非甲基化胞嘧啶转化为尿嘧啶,而甲基化胞嘧啶保持不变,使用Methyl Primer Express v1.0软件设计出甲基化引物和非甲基化引物,将硫化后的DNA进行甲基化特异性PCR扩增,并将产物进行琼脂糖凝胶电泳检测RasGRP1启动子区甲基化状态。
DNA甲基化是指真核生物中DNA甲基转移酶类将甲基供体S-腺苷甲硫氨酸中的甲基转移到DNA序列中CpG岛的胞嘧啶上的过程[19]。在人单核细胞系中,脂多糖刺激导致肿瘤坏死因子启动子的低甲基化,提高肿瘤坏死因子转录水平,促进了炎症反应[20-21]。Shih等[22]DNMT1抑制剂普鲁卡因胺治疗内毒素休克大鼠的研究显示,抑制抗炎基因IL27RA的DNA甲基化,对循环衰竭和多器官功能障碍具有保护作用;Huang等[23]研究表明,DNMT抑制剂5-Aza-2′-脱氧胞苷可抑制脓毒症性急性肺损伤(acute lung injury,ALI)小鼠炎症反应和氧化应激;Rump等[24]研究显示,水通道蛋白5(aquaporin 5,AQP5)基因nt-937胞嘧啶位点可与NF-κB结合有关,脓毒症死亡患者该位点上的甲基化水平明显高于脓毒症幸存者。根据体内外研究和现有人类脓毒症表观遗传学研究的数据证明,表观遗传学修饰可能是脓毒症发病机制的核心,DNA甲基化可能是治疗脓毒症和改善器官衰竭的预后靶点。本研究参照文献[25]方法,使用5-Aza-2′-脱氧胞苷与高浓度LPS同时处理JurkatE6-1细胞,使用MSP法和琼脂糖凝胶电泳检测RasGRP1启动子区甲基化表达情况,结果显示,高浓度LPS刺激诱导了细胞RasGRP1启动子区高甲基化,甲基化转移酶抑制剂预处理逆转了RasGRP1启动子区高甲基化,因此RasGRP1及其mRNA表达上调;而细胞培养上清液炎症因子TNF-α、IL-6浓度以及LDH活性降低,提示细胞炎症损伤有所减轻。另外,本研究结果表明,细胞p-ERK1/2蛋白表达也随之上调,ERK1/2总蛋白不受影响,表明RasGRP1可能通过激活MAPK通路,调节下游蛋白ERK1/2磷酸化发挥作用。以上研究结果表明,高浓度LPS刺激细胞的严重炎症反应诱导了RasGRP1启动子区高甲基化改变,通过抑制其启动子区甲基化,上调RasGRP1的表达水平,可以减轻细胞炎症反应,这可能与激活MAPK通路促进ERK1/2磷酸化,调节淋巴细胞免疫应答有关,其具体调节机制还需深入研究。
综上所述,本研究结果揭示RasGRP1表达及其启动子区甲基化在LPS诱导的JurkatE6-1细胞炎症模型中可能有调控作用,甲基化修饰疗法可减轻细胞炎症损伤,并可能通过调控下游ERK信号通路发挥作用。
