右美托咪定对异丙酚诱导的发育期大鼠海马组织细胞焦亡的作用及机制*
2024-04-22王迪何祥杨剑
王迪, 何祥, 杨剑
(1.贵州医科大学附属医院 麻醉科, 贵州 贵阳 550004; 2.贵州医科大学 麻醉学院, 贵州 贵阳 550004; 3.贵州省人民医院 麻醉科, 贵州 贵阳 550004 )
异丙酚因其具有诱导快速稳定、苏醒迅速及术后恶心呕吐发生率低等特点,被广泛应用于婴幼儿的全身麻醉手术[1-2]。然而,有动物实验表明,异丙酚诱导可致新生大鼠神经元细胞焦亡,与异丙酚激活NOD样受体家族Pyrin域蛋白-3(NOD-like receptor family,pyrin domain containing 3,NLRP3)炎性小体途径有关[3-5]。NLRP3炎性小体是一种细胞内蛋白复合物,在许多病理学中已成为炎症的关键介质,微生物和危险信号激活NLRP3后,导致促炎细胞因子白细胞介素-1β(interleukin-1β,IL-1β)和IL-18的释放,以及Gasdermin-D蛋白(gasdermin-D protein,GSDMD)介导的焦亡[6]。GSDMD介导的细胞焦亡是一种促炎类型的程序性细胞死亡,其特征是NLRP3炎性小体激活,同时下游天冬氨酸特异性半胱天蛋白酶-1(aspartate-Specific caspase 1,Caspase-1)被激活,影响细胞膜的通透性,释放IL-1β和IL-18等炎性细胞因子产生炎症反应,进而引发细胞焦亡[7-10],而神经元炎症反应和细胞焦亡会引起认知功能障碍[11]。因此,接受异丙酚麻醉后,可能会对新生儿神经系统的结构和功能产生损害。探索降低异丙酚麻醉后对新生大鼠神经元细胞发生焦亡的具体机制,可深入了解降低异丙酚引起的不良反应提供一定的理论依据。右美托咪定是一种高选择性α2受体激动剂,具有镇痛、镇静、抑制炎症反应的作用,临床上常用于镇静、麻醉等[12]。不过,目前右美托咪定对大脑神经元细胞焦亡的改善机制还没有完全清楚。研究发现,通过激活蛋白激酶A(protein kinase A,PKA)的活性,右美托咪定可以改善神经元的炎症反应[13],还可以抑制NLRP3炎性小体途径的炎症反应,改善神经元细胞焦亡[14-15]。A激酶锚定蛋白150(a-kinase anchoring protein 150,AKAP150)作为A激酶锚定蛋白家族成员,在PKA水平上调控其活性,通过将PKA锚定于适当的底物,提高磷酸化效率和信号传导的准确性,在信号传递中起着重要的作用[16-18]。因此,本研究在前期研究的基础上[19],对发育期SD大鼠进行异丙酚和AKAP150腺病毒处理,构建发育期大鼠细胞焦亡及AKAP150敲除模型,并通过右美托咪定预处理,探讨AKAP150在右美托咪定改善异丙酚诱导的发育期大鼠海马组织细胞焦亡中的作用,为促进右美托咪定在减轻神经元细胞焦亡领域中的应用提供新的科学依据。
1 材料与方法
1.1 实验材料
1.1.1实验动物 7 d龄健康新生SD大鼠40只,体质量14~18 g,雌雄不限,购自斯贝福(北京)生物技术有限公司[SCXK(京)2019-0010],所有大鼠均分笼饲养于恒温标准动物房,12 h光照,环境安静,温度20~24 ℃,湿度50%~65%,标准饲料,自由饮食、饮水,定期更换垫料,保持动物房干净整洁。本研究已获医院伦理委员会批准(2001633)。
1.1.2主要仪器和试剂 超微量紫外可见光分光光度计(杭州米欧仪器有限公司),PCR仪(杭州米欧仪器有限公司),台式高速冷冻离心机(湖南可成仪器设备有限公司),电泳仪电源(北京龙方科技有限公司),垂直电泳槽(北京六一仪器厂),eBlotTML1 快速湿转仪(金斯瑞生物科技股份有限公司),Multiskan FC型酶标仪(Thermo scientific),透射电子显微镜(HITACHI,HT7700);AKAP150腺病毒由复百澳(苏州)生物医药科技有限公司设计并合成,丙泊酚中/长链脂肪乳注射液(北京费森尤斯卡比医药有限公司),盐酸右美托咪定注射液(扬子江药业集团有限公司),胞浆胞核蛋白提取试剂盒(南京凯基生物),所有抗体和引物设计合成均购自武汉华研生物科技有限公司。
1.2 研究方法
1.2.1动物分组及模型建立 40只健康SD大鼠按随机数字表法均分对照(control,Con)组、异丙酚(propofol,Pro)组、右美托咪定预先给药(dexmedetomidine was preadministered,DP)组及AKAP150腺病毒+DP(A-kinase anchoring protein 150 adenovirus+DP,ADP)组。Con组大鼠腹腔注射与药物处理组等容量的生理盐水;Pro组大鼠首次腹腔注射异丙酚50 mg/kg,待大鼠翻正反射恢复后,即刻追加异丙酚50 mg/kg;DP组大鼠腹腔注射右美托咪定25 μg/kg,20 min后按Pro组给药方案对大鼠进行异丙酚麻醉;ADP组大鼠予AKAP150腺病毒腹腔注射,注射结束后1 h按DP组方案对大鼠进行药物处理。
1.2.2标本采集 “1.2.1”项下Con组大鼠于注射结束后2 h、其余组大鼠麻醉苏醒后2 h,采用颈椎脱臼法处死,取海马组织,于-80 ℃低温保存供后续研究检测。
1.2.3透射电镜下观察海马组织超微结构变化 取各组大鼠海马组织,2.5%戊二醛固定液固定,饿酸固定,磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗3次,梯度乙醇脱水,丙酮渗透,包埋,制成60~80 nm超薄切片,铀铅双染色各8 min,放入铜网盒内室温干燥过夜,将切片置于透射电子显微镜下观察,采集图像分析。
1.2.4蛋白印迹实验(Western blot)检测海马组织AKAP150、磷酸化PKA(phosphorylation-PKA,p-PKA)、NLRP3、GSDMD 、IL-1β及IL-18蛋白的表达 取“1.2.2”项下各组大鼠海马组织,加细胞裂解液充分裂解,4 ℃下12 000 r/min离心5 min,取上清液分装于0.5 mL离心管,置于-20 ℃保存;聚氰基丙烯酸正丁酯(bicin choninic acid,BCA)试剂盒测定蛋白浓度,加样缓冲液,加热,冷却后上样,依次经过电泳、转膜、封闭、漂洗,加一抗(GAPDH 1∶2 000、AKAP5 1∶1 000、NLRP3 1∶1 000、GSDMD 1∶1 000、IL-1β 1∶1 000、IL-18 1∶1 000及p-PKA 1∶1 000)过夜;洗涤缓冲液(tris-buffered saline and tween,TBST)洗涤5次,加相应的加辣根过氧化物酶(horseradish peroxidase,HRP)标记二抗(1∶10 000),室温摇床孵育2 h;TBST洗涤5次,增强型化学发光试剂(enhanced chemiluminescence,ECL)发光试剂盒进行化学发光、显影、定影及冲洗胶片,用ipp分析胶片灰度值,以GAPDH为内参计算目标蛋白相对表达量。
1.2.5实时荧光PCR(quantitative reverse transcription PCR,RT-qPCR)检测海马组织AKAP150、PKA、NLRP3、GSDMD、IL-1β及IL-18 mRNA表达 取“1.2.2”项下各组大鼠海马组织100 mg提取总RNA,测定总浓度,使用反转录试剂盒反转录合成反转录DNA(complementary DNA,cDNA)。以cDNA产物作为模版,配置逆转录反应体系为正向引物0.4 μL、反向引物0.4 μL、cDNA 10 μL及灭菌水4.8 μL;反应程序为预变性(95 ℃ 10 min)1次循环,变性(95 ℃ 15 s)40次循环,退火延伸(60 ℃ 60 s)40次循环,溶解曲线采集(60 ℃ 60 s、95 ℃ 15 s)1次循环,用2-ΔΔCt分析相关基因转录情况。引物序列见表1。

表1 荧光定量PCR引物序列Tab.1 Primer sequences for fluorescent quantitative polymerase chain reaction
1.3 统计学分析
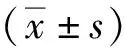
2 结果
2.1 组织学特征
Con组大鼠海马组织细胞结构基本正常;Pro组、ADP组大鼠海马组织损伤程度较高,主要表现为细胞膜破损严重,形成孔道;DP组大鼠海马组织损伤程度较轻,细胞膜结构基本完整。见图1。
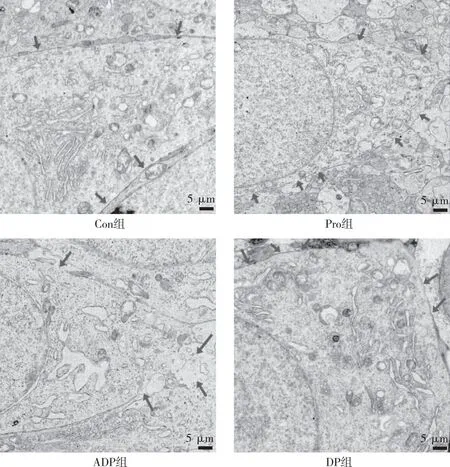
注:箭头表示细胞膜。
2.2 海马组织中AKAP150、p-PKA、NLRP3、GSDMD、IL-1β及IL-18 蛋白的表达
Western blot检测结果显示(图2),与Con相比,Pro组、DP组及ADP组大鼠海马组织AKAP150、p-PKA蛋白表达均下调(P<0.05),NLRP3、GSDMD、IL-1β、IL-18蛋白表达均上调(P<0.05);与Pro组相较,DP组大鼠海马组织AKAP150、p-PKA蛋白表达均上调,NLRP3、GSDMD 、IL-1β及IL-18蛋白表达均下调(P<0.05);与DP组相比,ADP组大鼠海马组织AKAP150、p-PKA蛋白表达均下调,NLRP3、GSDMD 、IL-1β、IL-18蛋白表达均上调(P<0.05)。
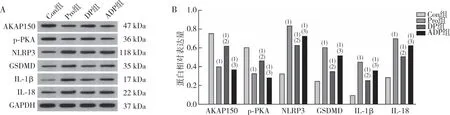
注:A为各蛋白的电泳结果,B为各蛋白的定量结果;(1)与Con组比较,P<0.05;(2)与Pro组比较,P<0.05;(3)与DP组比较,P<0.05。
2.3 海马组织中AKAP150、PKA、NLRP3、GSDMD、IL-1β及IL-18 mRNA的表达
RT-qPCR检测结果显示(图3),与Con相比,Pro组、DP组、ADP组大鼠海马组织AKAP150、PKA mRNA表达均下调(P<0.05),NLRP3、GSDMD 、IL-1β及IL-18 mRNA表达均上调(P<0.05);与Pro组相比,DP组大鼠海马组织AKAP150、PKA mRNA表达均上调(P<0.05),NLRP3、GSDMD 、IL-1β及IL-18 mRNA表达均下调(P<0.05);与DP组相比,ADP组大鼠海马组织AKAP150、PKA mRNA表达均下调(P<0.05),NLRP3、GSDMD 、IL-1β及IL-18 mRNA表达均上调(P<0.05)。
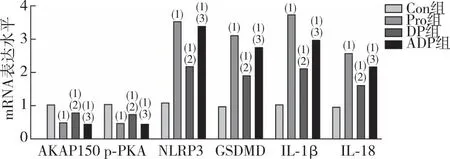
注:(1)与Con组比较,P<0.05;(2)与Pro组比较,P<0.05;(3)与DP组比较,P<0.05。
3 讨论
越来越多的研究表明,异丙酚麻醉会造成新生大鼠海马组织细胞焦亡[19-20]。这意味着,异丙酚麻醉可能会对新生儿产生神经毒性,从而影响其大脑认知功能。细胞焦亡是一种炎症性程序性细胞死亡,其特征是由炎症小体NLRP3触发并由GSDMD蛋白执行,造成细胞膜穿孔,进而引起细胞死亡,在死亡的过程中释放炎性因子IL-1β和IL-18,导致并放大炎症反应,这也被认为是细胞焦亡的经典信号通路[21]。
因右美托咪定具有良好的镇静、镇痛及抗焦虑等作用,还能抑制炎症反应[22],在儿科医学上的应用广泛[23-25]。研究表明,神经元细胞发生焦亡时,NLRP3、GSDMD表达上调,炎性因子IL-1β和IL-18的合成分泌增多[5-6]。右美托咪定可以通过NLRP3炎症小体途径减轻丙泊酚诱导的海马组织细胞焦亡[4],当PKA的活性增强时,可以抑制NLRP3炎性小体介导的神经元细胞焦亡[14]。最新研究表明,右美托咪定可通过上调PKA活性而改善神经元的炎症反应及细胞焦亡,PKA参与了调控NLRP3炎症小体引起的细胞焦亡和炎性反应,当PKA活性增强时,下游的NLRP3、IL-1β及IL-18表达下调,从而减轻了神经元炎性反应和细胞焦亡[13,26-28]。而PKA的活性取决于A激酶锚定蛋白[29],该蛋白通常被认为是PKA的支架蛋白,磷酸化事件通过与各种支架蛋白的相互作用来控制[17]。AKAP150属于A激酶锚定蛋白家族成员,可精确地调控一系列信号转导事件的空间位置和时间顺序,通过将PKA锚定于适当的底物并形成相应的复合物,在PKA水平上调控其活性,提高磷酸化效率以及确保信号传导的准确性[16,18]。本研究结果显示,异丙酚麻醉后的发育期大鼠,海马组织AKAP150的表达明显下调,同时PKA活性也随之下调,细胞焦亡相关蛋白NLRP3、GSDMD以及炎性因子IL-1β、IL-18的表达明显上调。右美托咪定预先给药后,海马组织AKAP150的表达明显上调,同时PKA活性也随之上调,细胞焦亡相关蛋白NLRP3、GSDMD以及炎性因子IL-1β、IL-18的表达明显下调。为进一步验证AKAP150与PKA、NLRP3、GSDMD以及炎性因子IL-1β、IL-18的相关性,通过腺病毒将AKAP150敲除后发现,AKAP150的表达被抑制的同时,PKA活性也随之明显下调,细胞焦亡相关蛋白NLRP3、GSDMD以及炎性因子IL-1β、IL-18的表达则明显上调。同时,细胞焦亡的特征是膜孔形成,本研究中透射电镜图像分析表明,异丙酚麻醉后,海马组织细胞膜结构破坏,膜孔增加,右美托咪定预给药后减轻了这一趋势。综上所述,有理由考虑,右美托咪定可能通过激活AKAP150表达,增强了PKA的活化水平,抑制了细胞焦亡相关蛋白NLRP3、GSDMD的表达,减少了海马组织中炎性因子IL-1β和IL-18的合成和分泌,从而发挥出改善异丙酚所致的发育期大鼠海马组织细胞焦亡的作用。因此,临床上可考虑将右美托咪定视为一种具有潜力药用前景的麻醉辅助用药,但其作用机制和毒理性有待进一步研究。
