酸性微环境对巨噬细胞中周期生物钟1的表达及M2型极化的影响*
2024-04-22刘新宇赵茂杨颖颖邱炜
刘新宇, 赵茂, 杨颖颖, 邱炜
(贵州医科大学 生物与工程学院 & 健康医药现代产业学院, 贵州 贵阳 550025)
包括黑色素瘤在内的多种肿瘤中,无论是否有氧气参与,肿瘤细胞都会倾向将丙酮酸转换为乳酸,这种状态被称为“Warburg效应”[1]。随着乳酸代谢物不断积累,最终形成pH介于5.8~7.4的肿瘤酸性微环境[2]。肿瘤酸性微环境能诱导肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)向替代途径激活的巨噬细胞(alternatively activated or healing macrophage,M2型)极化[3-5]。M2型TAMs通过分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)、精氨酸酶-1(arginase1,ARG-1)等细胞因子促进肿瘤血管生成、肿瘤细胞侵袭与转移[6-9]。同时,M2型TAMs积累也被认为是患者预后不良的原因之一[8,10]。因此,肿瘤微环境中酸性特性如何诱导TAMs向M2型极化已成为TAMs肿瘤治疗的重点研究方向之一[11]。阳离子脂质体具有生物相容性好、合成简单及可塑性良好等特点,是当前靶向特定组织和细胞进行基因治疗的优良载体[12]。周期生物钟1(period 1,PER1)是昼夜节律的核心基因之一,在控制哺乳动物昼夜节律、细胞周期及DNA损伤反应中起关键作用[13];PER1的异常表达与结肠癌、前列腺癌、乳腺癌等恶性肿瘤的发生和发展密切相关[14-16]。然而,目前PER1对巨噬细胞极化的相关研究较少。因此,本研究通过构建阳离子脂质体辅助递送PER1-小干扰RNA(small interfering RNA,siRNA),进而研究PER1对巨噬细胞极化的影响,为基于巨噬细胞极化的肿瘤免疫治疗提供新的理论基础。
1 材料与方法
1.1 实验材料
1.1.1动物及细胞来源 6~8周龄C57/6J雌性小鼠20只,体质量18~20 g,购自学校动物实验中心[SYXK(贵)2023-0001],B16-F10黑色素瘤细胞和RAW264.7巨噬细胞购自武汉普诺赛生物科技有限公司。
1.1.2主要试剂和仪器 RPMI-1640培养基、DMEM培养基、胎牛血清(美国Gibco公司),溴化三甲基-2, 3-二油酰氧基丙基铵(1,2-dioleoyl-3-trimethylammonium-propane, DOTAP)、二油酰基磷酰基乙醇胺(1,2-Dioleoyl-sn-glycero-3-phosphoethanolamine, DOPE)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(2000)-琥珀酰胺(DSPE-PEG2000-NHS,西安瑞禧生物技术有限公司),胆固醇(上海默克化工有限公司),TB Green Premix Ex Taq、TaKaRa PrimeScript RT reagent Kit逆转录试剂盒及Trizol试剂(宝日医生物技术有限公司),藻红蛋白-成熟小鼠巨噬细胞标志物(phycoerythrin-anti-mouse EGF-like module-containing mucin-like hormone receptor-like 1,PE-F4/80)、别藻蓝蛋白-甘露糖受体(allophycocyanin- anti-mannose receptor,APC-CD206;赛默飞世尔科技有限公司),PER1-siRNA以及实时荧光定量PCR(real-time quantitative PCR detecting,RT-PCR)引物都由上海生工生物技术有限公司合成,其他试剂耗材购自无锡耐斯特生物技术股份有限公司;QuantStudio 3型实时荧光定量PCR系统(赛默飞世尔科技), 激光共聚焦显微镜(日本Olympus公司),F-4600荧光分光光度计(日本Hitachi公司),精密酸度计(上海大普仪器有限公司)。
1.2 研究方法
1.2.1小鼠腹腔巨噬细胞提取培养及分组 小鼠饲养于清洁环境,腹腔注射含5%淀粉的生理盐水2 mL,连续3 d,麻醉处死,75%酒精浸泡5 min,置于无菌超净台;去除小鼠腹部皮肤,腹腔注射RPMI-1640培养基5 mL,按摩1~2 min,静置5 min,回收小鼠腹腔内溶液至50 mL离心管;800 r/min离心5 min,弃上清;含10%血清、1%双抗的RPMI-1640培养基重悬细胞,调整至合适密度接种至6孔板,置于37 ℃的5%CO2培养箱培养2 h;去除悬液,磷酸盐缓冲液(phosphate buffered saline,PBS)溶液清洗6孔板,加完全培养基培养,贴壁细胞即为小鼠腹腔巨噬细胞;将等渗盐酸加入RPMI-1640中,将培养基pH分别调至6.5、7.3;将1 mol/L乳酸加到pH7.3的RPMI-1640中,使培养基中乳酸的终浓度为20 mmol/L;小鼠腹腔巨噬细胞分组设为pH7.3组、pH6.5组、0.02 mol/L乳酸组,分别加pH7.3、pH6.5、乳酸终浓度为0.02 mol/L的培养基,于37 ℃的5%CO2培养箱中培养。
1.2.2实时荧光定量PCR(real-time quantitative PCR detecting,RT-PCR)检测小鼠腹腔巨噬细胞中白介素1β(inerleukins-1β,IL-1β)、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、ARG-1、VEGF及PER1的表达 取“1.2.1”项下提取3组小鼠腹腔巨噬细胞,于37 ℃的5%CO2培养箱中培养24 h,PBS溶液清洗3次;Trizol试剂提取总RNA,使用微量核酸仪测定所提取RNA浓度和纯度,琼脂糖胶电泳检测RNA降解情况;使用TaKaRa PrimeScript RT reagent Kit 逆转录试剂盒逆转录为互补DNA(complementary DNA,cDNA);以此cDNA为模板进行RT-PCR检测,反应条件:95 ℃预变性30 s,95 ℃变性5 s、60 ℃复性34 s、72 ℃延伸30 s、40个循环;采用2-ΔΔCt法计算相关基因表达量。RT-PCR引物序列见表1。

表1 腹腔巨噬细胞极化相关基因RT-PCR引物序列Tab.1 RT-PCR primer sequences for polarization-related genes in peritoneal macrophages
1.2.3酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)检测巨噬细胞极化相关分子IL-10、IL-12、VEGF、TNF-α的分泌量 取“1.2.1”项下3组小鼠腹腔巨噬细胞,于各自培养基中培养24 h,收集上清液,1 700 r/min离心10 min。根据ELISA试剂盒说明书检测IL-10、IL-12、VEGF、TNF-α的分泌水平。
1.2.4阳离子脂质体制备和鉴定 通过薄膜水合法制备阳离子脂质体。首先,称量DOTAP 1.265 mg、DOPE 1.35 mg、胆固醇0.5 mg、DSPE-PEG2000-NHS(摩尔比为7∶7∶5∶1)0.75 mg充分溶解于氯仿溶液3 mL中,使用旋转蒸发仪以60 ℃、120 r/min条件旋蒸1 h,形成脂质体薄膜;其次,加无核酸酶双蒸水5 mL,超声水浴仪60℃超声30 min,置于冰上,超声探头超声水合5 min;最后,使用小型挤压器按400 nm、200 nm、100 nm的顺序通过聚碳酸酯膜得到单层脂质体,置于4℃避光保存。使用无酶水溶解siRNA,将siRNA与脂质体溶液按照1∶10的质量比于室温下震荡混匀;随后按照1∶1 000体积比加APC-CD206抗体,室温避光孵育30 min得到脂质体-PER1复合体(liposome-PER1,Lipo-PER1)阳离子脂质体。取Lipo-PER1 2 mL按体积比1∶10、1∶100及1∶500加无菌无酶双蒸水稀释,分别滴加至铜网,2%磷钨酸负染,室温通风干燥,透射电子显微镜于200 KV电压观察样品。PER1-siRNA序列:sense为GACCATTCCCCTATTCGCT,Anti-sense为CTTTATGGCGACCCAACAC。
1.2.5B16-F10黑色素瘤细胞、RAW264.7巨噬细胞培养及共聚焦显微镜观察Lipo-PER1靶向巨噬细胞 B16-F10黑色素瘤细胞、RAW264.7巨噬细胞加入含10%胎牛血清、1%青霉素链霉素的高糖培养基,置于37 ℃的5%CO2培养箱培养;对数生长期的RAW264.7、B16-F10细胞按1∶1比例混合并调整至合适密度,以1∶1 000体积比加PE-F4/80抗体避光孵育30 min;细胞接种至盖玻片,加三甲川花菁染料(cyanine 3,cy3)标记的Lipo-PER1,加OPTI-MEM无血清培养基,置于37 ℃的5%CO2培养箱避光培养6 h,使用共聚焦显微镜对细胞进行观察并拍照。
1.2.6RT-PCR检测Lipo-PER1对巨噬细胞极化相关因子CD86、IL-1β、ARG-1及IL-10表达的影响 RAW264.7巨噬细胞接种至6孔板中培养,分为空白对照(Control)组、liposomes(Lps)空白脂质体对照组、Lipo-NC阴性对照组及Lipo-PER1组,后3组分别加空白脂质体、Lipo-NC、Lipo-PER1;加无血清OPTI-MEM培养基混匀,置于37 ℃的5%CO2培养箱培养6 h;更换完全培养基培养24 h;PBS溶液清洗3次,Trizol试剂提取总RNA,使用微量核酸仪测定所提取RNA浓度和纯度,琼脂糖胶电泳检测RNA降解情况;使用TaKaRa PrimeScript RT reagent Kit 逆转录试剂盒合成cDNA,以此cDNA为模板使用TB Green Premix Ex Taq进行RT-PCR检测;反应条件为95 ℃预变性30 s,95 ℃变性5 s、60 ℃复性34 s、72 ℃延伸30 s、40个循环;采用2-ΔΔCt法计算CD86、IL-1β、ARG-1及IL-10基因的表达。RT-PCR引物序列见表2。
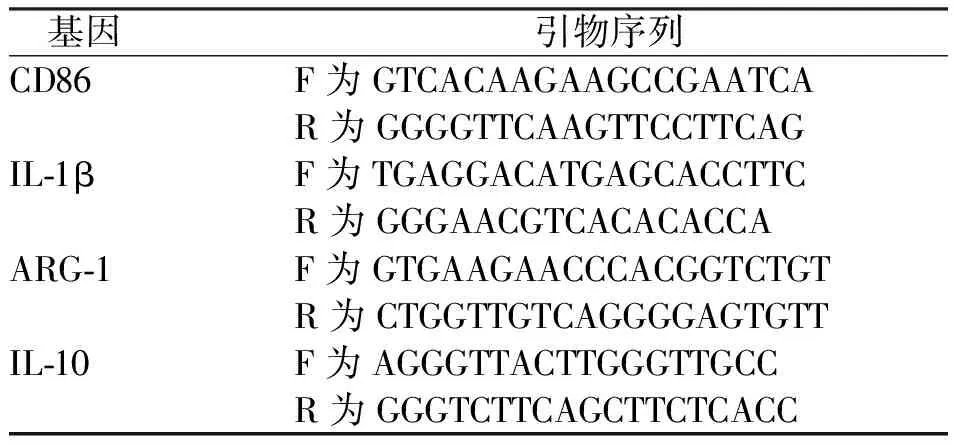
表2 RAW264.7巨噬细胞极化相关基因RT-PCR引物序列Tab.2 RAW264.7 RT-PCR primer sequence of macrophage polarization-related gene
1.3 统计学分析
2 结果
2.1 腹腔巨噬细胞中ARG-1、VEGF、HIF-1α、PER1 mRNA和蛋白的表达
RT-PCR结果表明(图1),与pH7.3组对比,pH6.5组和0.02 mol/L乳酸组小鼠腹腔巨噬细胞IL-1β mRNA表达下调(P<0.05),ARG-1、VEGF、HIF-1α及PER1mRNA表达上调(P<0.05);ELISA结果表明(图2),相比于pH7.3组,pH6.5与0.02 mol/L乳酸组小鼠腹腔巨噬细胞IL-12、TNF-α蛋白水平减少(P<0.000 1),IL-10、VEGF蛋白水平增加(P<0.01)。

注:与pH7.3组比较,(1)P<0.05,(2)P<0.01。

注:与pH7.3组比较,(1)P<0.01,(2)P<0.0001。
2.2 纳米颗粒的表面特征
Lipo-PER1冷冻透射电镜观察结果显示(图3),Lipo-PER1是具有明显双层膜的类球状脂质体,其粒径为(113.2±21.03)nm。

注:A为Lipo-PER1的冷冻透射电镜图(12 000×); B为Lipo-PER1粒径分布统计。
2.3 Lipo-PER1转染RAW264.7巨噬细胞
共聚焦显微镜观察结果显示(图4),Lipo-PER1能够成功包裹PER1-siRNA(红色荧光)被RAW264.7巨噬细胞(绿色荧光)摄取,而黑色箭头指向B16-F10黑色素瘤细胞内部无荧光;RT-PCR结果表明,与Lipo-NC组相比,Lipo-PER1组RAW264.7巨噬细胞中PER1 mRNA表达下调(P<0.000 1)。
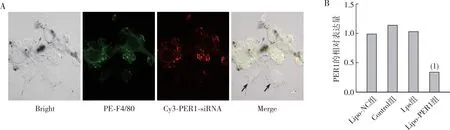
注:A为共聚焦显微镜观测Lipo-PER1靶向RAW264.7巨噬细胞(600×),绿色荧光为PE-F4/80代表RAW264.7巨噬细胞,红色荧光代表Cy3-PER1-siRNA,黑色箭头指向B16-F10黑色素瘤细胞;B为RT-PCR检测RAW264.7巨噬细胞中PER1的相对表达量;(1)与Lipo-NC组比较,P<0.000 1。
2.4 RAW264.7巨噬细胞中IL-1β、CD86、ARG-1、IL-10 mRNA和蛋白的表达
RT-PCR结果表明(图5),与Lipo-NC组相比,Lipo-PER1组RAW264.7巨噬细胞中IL-1β、CD86mRNA表达上调(P<0.05或P<0.001),ARG-1、IL-10 mRNA表达下调(P<0.01或P<0.05);ELISA结果表明(图6),与Lipo-NC组相比,Lipo-PER1组RAW264.7巨噬细胞中TGF-β蛋白表达增加(P<0.000 1),TNF-α蛋白表达减少(P<0.05)。
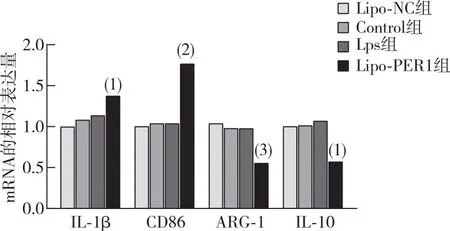
注:与Lipo-NC比较,(1)P<0.05,(2)P<0.001,(3)P<0.01。

注:与Lipo-NC相比,(1)P<0.05,(2)P<0.0001。
3 讨论
巨噬细胞源自于骨髓中前体细胞,是先天免疫反应中重要成员之一[17]。巨噬细胞在不同的刺激下改变其表型,如:经典途径激活的巨噬细胞M1型和M2型[18]。M1巨噬细胞由辅助性T细胞1型细胞因子如干扰素-γ(interferon γ,IFN-γ)、脂多糖(lipopolysaccharide,LPS)等诱导激活。M1巨噬细胞能表达IL-1β、IL-6及TNF-α等细胞因子,进而发挥抗肿瘤作用[19]。M2巨噬细胞由IL-4及IL-13等细胞因子诱导激活,并通过表达M2标志分子如TGF-β、VEGF等进而抑制炎症和促进伤口愈合[20];肿瘤细胞的高糖酵解可导致乳酸和H离子积累,并最终形成肿瘤酸性微环境[21];在缺氧和细胞外高浓度乳酸的条件下,乳酸可以转运到细胞内,通过不同机制激活HIF-1α进而促进TAMs向M2型极化和ARG-1、VEGF的表达[21]。本研究结果显示,乳酸和H离子形成的酸性微环境能够上调小鼠腹腔巨噬细胞中ARG-1、VEGF、HIF-1α、PER1 mRNA表达,抑制IL-1β mRNA表达,表明酸性微环境能促进巨噬细胞M2型极化、抑制M1型极化。这提示PER1可能参与酸性微环境诱导巨噬细胞M2型极化。PER1是生物钟机制的重要组成部分,而生物钟功能已被证明可以影响巨噬细胞表型[22];抑制PER1的表达可上调由高脂肪饮食诱导的小鼠的脂肪和肝脏组织炎症中M1型巨噬细胞占比[23];Xu等[24]发现通过上调PER1的表达,能够上调骨髓细胞中M2巨噬细胞的占比;Ding 等[25]研究显示,通过体外模拟低氧环境实验能上调RAW264.7巨噬细胞中PER1的表达。其研究表明PER1能抑制M1巨噬细胞极化、促进M2巨噬细胞极化。本研究结果也表明,酸性微环境能上调小鼠腹腔巨噬细胞中PER1 mRNA的表达。在肿瘤微环境中由于缺氧和异常的糖酵解形成酸性微环境,这提示肿瘤酸性微环境可能通过上调小鼠腹腔巨噬细胞中PER1的表达,进而促进巨噬细胞M2型极化。
为了进一步验证PER1对巨噬细胞极化的影响,本研究通过构建Lipo-PER1纳米颗粒靶向递送PER1-siRNA,结果显示,Lipo-PER1能够成功靶向RAW264.7巨噬细胞并下调PER1 mRNA的表达。本研究结果表明,在成功沉默PER1的表达后,RAW264.7巨噬细胞中M1标志分子CD86、IL-1β mRNA表达上调,M2标志分子ARG-1、IL-10 mRNA表达下调。同时,ELISA结果显示,相比Lipo-NC组,Lipo-PER1组RAW264.7巨噬细胞中TGF-β的分泌量上调,TNF-α的分泌量下调。TGF-β是M2型巨噬细胞分泌的主要免疫抑制细胞因子之一。上述结果提示PER1能促进RAW264.7巨噬细胞M2型极化、抑制M1型极化。
综上所述,肿瘤酸性微环境能上调巨噬细胞中PER1的表达,进而可能促进巨噬细胞M2型极化。但本研究还存在一定的局限性,PER1调控巨噬细胞M2型极化的具体机制与Lipo-PER1体内靶向研究是本课题今后进一步的研究方向。
