基于标准提取物的欧洲越橘提取物质量控制方法及药效活性关联研究
2024-04-22安若凡岳中宝贺瑞坤
李 镇,李 俊,安若凡,孙 伟,岳中宝,杨 维*,贺瑞坤*
基于标准提取物的欧洲越橘提取物质量控制方法及药效活性关联研究
李 镇1, 2,李 俊2,安若凡2,孙 伟2,岳中宝3,杨 维2*,贺瑞坤3*
1. 大理大学药学院,云南 大理 671000 2. 中国中医科学院中药研究所 中药鉴定与安全性评估北京市重点实验室,北京 100007 3. 汤臣倍健股份有限公司营养健康研究院,广东 广州 510663
建立对照品非依赖性的20种花青素类成分定量分析方法,并利用该法对市售欧洲越橘提取物进行质量控制,同时筛选出代表性抗氧化活性成分。以欧洲越橘标准对照提取物替代对照品,采用超高效液相色谱-三重四极杆串联质谱(UPLC-QQQ-MS/MS)联用技术,建立一种针对20种花青素类成分的定量方法,并利用该法对10批市售欧洲越橘提取物中的花青素类成分含量进行研究。采用DPPH自由基清除法和总抗氧化能力测试法评价不同欧洲越橘提取物的抗氧化能力。方法学验证结果显示,20种花青素类成分线性良好,为0.999 4~1.000 0,精密度RSD为0.05%~4.23%,稳定性RSD为0.29%~3.38%,平均加样回收率为98.1%~102.1%,RSD为0.50%~4.12%。样品分析结果显示,不同样品中部分花青素类成分含量存在显著差异,其中锦葵素变化最大,RSD为18.23%。欧洲越橘提取物具有较好的DPPH自由基清除能力和总抗氧化能力。其中矢车菊素与DPPH自由基率相关性为0.94,芍药素-3--半乳糖苷与总抗氧化活性相关性为0.93。二者有望作为欧洲越橘提取物清除DPPH自由基活性和总抗氧化活性的潜在质控成分。基于UPLC-QQQ-MS/MS所建立的对照品非依赖性的欧洲越橘提取物中20种花青素类成分定量分析方法,灵敏度高,准确性好,方法简单,适用于欧洲越橘提取物中20种花青素类成分的含量测定,为中药对照提取物替代单体对照品在中药质量控制中的应用提供了数据支撑,为中药材质量控制研究提供新的研究思路。
欧洲越橘;对照提取物;UPLC-QQQ-MS/MS;抗氧化能力;质量控制;花青素;矢车菊素-3--葡萄糖苷;芍药素- 3--葡萄糖苷;飞燕草素3--半乳糖苷;锦葵素;矢车菊素;芍药素-3--半乳糖苷
欧洲越橘L.是杜鹃花科(Ericaceae)的一种落叶灌木,原产于欧洲北部和中部的山区,也广泛分布在意大利阿尔卑斯山和亚平宁山脉。越橘提取物含有丰富的花青素,具有缓解眼疲劳,保护肝脏、心脑血管,抗癌等作用,已被广泛应用于保健食品、药品等领域[1-2]。
花青素是欧洲越橘提取物的主要活性成分,其中常见的花青素类成分多达20种[3]。花青素结构中含有多个酚羟基,这一特点为其提供了强大的抗氧化活性基础。由于花青素性质不稳定,且部分单体成分的提取分离难度大,加之储存、运输条件高,导致部分花青素对照品价格过高。越橘对照提取物是指经过特定工艺制备得到的含有多种主要成分或指标性成分的标准物质,具有易制备、性质稳定、价格低廉等特点[3]。同时欧洲药典(EP 10.0)中对越橘对照提取物的提取方法、性状、所含花青素种类、含量、干燥失重、总灰分等指标进行了严格控制。因此,本研究拟以越橘对照提取物替代对照品,对市售越橘提取物进行定量研究。
目前,花青素类成分常用的检测方法有紫外分光光度法、薄层色谱法、高效液相-紫外分光光度法(HPLC-UV)等[4-5]。相较于以上方法,液质联用技术具有选择性强、灵敏度高、分离能力好等优点[6-7]。因此,本研究拟以欧洲越橘标准对照提取物代替对照品,采用超高效液相色谱-三重四极杆串联质谱(UPLC-QQQ-MS/MS)联用技术,建立一种针对20种花青素类成分的定量方法,并利用该法对10批市售欧洲越橘提取物中的花青素类成分含量进行研究。对不同欧洲越橘提取物的抗氧化能力进行评价,并筛选欧洲越橘提取物清除DPPH自由基活性和总抗氧化活性的潜在质控成分。本研究有望为欧洲越橘花青素类成分的质量控制提供新方法。
1 仪器与材料
1.1 仪器
Spectra Max I3X型多功能酶标仪,美谷分子仪器(上海)有限公司;Agilent G6470型三重四极杆质谱仪、Agilent 1290型超高效液相色谱仪,美国安捷伦有限公司;台式DK-3450 Mini型高速离心机,丹麦Labogene公司;Mettler Toledo ME155DU型十万分之一级电子分析天平,赛多利斯科学仪器北京有限公司;移液器,大龙兴创实验仪器(北京)股份公司;舒美KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;Blue Pard型恒温振荡器,上海一恒科学仪器有限公司。
1.2 材料
10批市售欧洲越橘提取物分别购自汤臣倍健股份有限公司(批号20S0303003,编号S1)、宁波绿之健药业有限公司(批号20221202/10962、20230102/10962、20230202/10962,编号S2~S4)、杨凌萃健生物工程技术有限公司(批号20221203、20230402、20230701,编号S5~S7)、桂林莱茵生物科技股份有限公司(批号23021302,编号S8)和诺黛然股份有限公司(批号118190120、118181018,编号S9、S10)。标准越橘对照提取物,批号ZEP-Y0001788-C1A,购自上海甄准生物科技有限公司。
对照品矢车菊素-3--葡萄糖苷(C11,批号CFN92046)、芍药素-3--葡萄糖苷(C14,批号CFN92046)和飞燕草素3--半乳糖苷(C15,批号CFN92037),Chem Faces®,质量分数≥98%,均购于武汉天植生物技术有限公司。
1,1-二苯基-2-苦苯肼(DPPH),批号300267,购自Sigma公司;水溶性维生素E(Trolox),批号C14735198,质量分数≥99%,购自上海麦克林生化科技有限公司;总抗氧化能力检测试剂盒(T-AOC),批号BC1315,购自北京索莱宝科技有限公司;甲醇、甲酸,质谱级,均购自赛默飞世尔科技(中国)有限公司;屈臣氏蒸馏水购自广州屈臣氏食品饮料有限公司。
2 方法与结果
2.1 液质联用条件
2.1.1 色谱条件 色谱柱为Agilent Eclipse Plus C18柱(100 mm×2.1 mm,1.8 µm);柱温35 ℃;流动相为0.5%甲酸水溶液(A)和含0.5%甲酸的98%乙腈水溶液(B);洗脱梯度为0~10 min,5%~10% B;10~25 min,10%~25% B;25~30 min,25%~95% B;30~33 min,95%~5% B;体积流量0.3 mL/min;进样量3 µL。
2.1.2 质谱条件 使用电喷雾离子源(ESI源),正离子模式,鞘气温度250 ℃。鞘气体积流量11 L/min,喷嘴电压500 V,雾化器压力310.28 kPa。毛细管电压:正电压4 000 V;干燥气温度300 ℃;干燥气体积流量5 L/min;各路气体均为氮气。数据采集模式为多反应监测模式。各定量成分的质谱参数见表1。

表1 20种花青素类成分的质谱信息
2.2 样品制备
2.2.1 越橘提取物制备 精确称取越橘提取物1 mg(精确至0.01 mg),加入1 mL 40%甲醇水溶液,超声提取5 min,12 000 r/min离心5 min,取上清,用40%甲醇水稀释10倍,过0.22 μm微孔滤膜,制成100 μg/mL的供试品溶液。
2.2.2 标准越橘对照提取物制备 精确称取越橘提取物1 mg(精确至0.01 mg),加入1 mL 40%甲醇水溶液(料液比1∶1),超声提取5 min,12 000 r/min离心(离心半径5 cm)5 min,取上清,制备成1 mg/mL的储备液。用40%甲醇水稀释将储备溶液依次稀释成500.0、250.0、125.0、62.5、31.3、15.6 μg/mL的对照提取物溶液。
2.2.3 混合越橘提取物制备 取6种不同来源的越橘提取物,制成混合越橘提取物,按照“2.2.1”项下的方法制备混合越橘提取物溶液。
2.2.4 对照品溶液制备 精确称取C11、C14和C15各1 mg,加入40%甲醇水溶液,制备成1 mg/mL的对照品储备液。精密吸取3种对照品溶液,混合,用40%甲醇水稀释将储备溶液依次稀释成含C11(8 μg/mL)、C14(8 μg/mL)和C15(8 μg/mL)的混合对照品溶液,依次稀释得一系列混合对照品溶液,分别为4、2、1、0.5 μg/mL。
2.3 方法学考察
2.3.1 线性关系考察 精密吸取“2.2.2”和“2.2.4”项下不同质量浓度的标准越橘对照提取物溶液和对照品溶液,按“2.1.1”和“2.1.2”项下的方法进行分析,记录花青素的峰面积响应值。以溶液质量浓度为横坐标(),峰面积响应值为纵坐标(),用最小二乘法进行线性回归,得回归方程。
基于标准越橘对照提取物的回归方程分别为C1=5.840 1-2.569,=0.999 9;C2=4.974 6+49.224,=0.999 8;C3=1.873+5.454,=1.000 0;C4=3.429-8.500,=0.999 7;C5=1.063 5+0.528 7,=0.999 7;C6=9 303.8+166 970.0,=0.999 6;C7=1 912.0+23 430.0,=0.999 6;C8=7 578.2+125 615.0,=0.999 6;C9=3 759.6+64 990.0,=0.999 7;C10= 11 182.0+44 570.0,=0.999 9;C11=11 511.0+121 451.0,=0.999 7;C12=4 490.3- 5 913.0,=0.999 7;C13=2 691.1+26 678.0,=0.999 6;C14=7 535.9+266 948.0,=0.999 5;C15=9 450.3+55 708.0,=0.999 6;C16=9 618.7+49 714.0,=0.999 6;C17=5 108.5+44 329.0,=0.999 6;C18=9 399.1+103 213.0,=0.999 5;C19=3 767.7+47 512.0,=0.999 7;C20=12 926.0+76 915.0,=0.999 7;C1~C20的线性范围均为15.6~500.0 μg/mL。
基于对照品溶液的回归方程分别为C11= 2 280 466.4+82 554.0,=0.999 8;C14= 1 374 443.9+74 505.0,=0.999 5;C15= 1 404 172.2+52 319.0,=0.999 5;C11、C14、C15的线性范围均为0.5~8.0 μg/mL。
2.3.2 精密度考察 按“2.2.1”项下方法制备标准越橘对照提取物溶液,按照“2.1.1”和“2.1.2”项的色谱条件和质谱条件连续进样6次,详细记录20种花青素的峰面积响应值,并计算各成分峰面积的RSD值。结果(表2)显示20种花青素峰面积的RSD值在0.05%~4.23%,表明仪器精密度良好。
2.3.3 稳定性试验 按“2.2.3”项下的方法制备混合越橘提取物溶液,并将其放置在4 ℃保存。分别于0、2、4、6、8、12、24 h,按“2.1.1”和“2.1.2”项下的方法对20种成分进行测定,详细记录各成分峰面积响应值,计算RSD值,结果(表2)显示RSD值为0.29%~3.38%,表明供试品溶液在24 h内稳定。
2.3.4 重复性试验 按“2.2.3”项下的方法平行制备6份混合越橘提取物溶液,按照“2.1.1”和“2.1.2”项下色谱条件和质谱条件对6份提取物溶液进行检测,获取20种花青素的峰面积响应值,并计算各成分质量分数的RSD值。结果(表2)显示RSD值在1.02%~4.03%,表明该方法重复性良好。

表2 20种花青素类成分的精密度、稳定性、重复性和加样回收率试验结果(对照提取物法)
2.3.5 加样回收率试验 精确称取“2.2.3”项下越橘提取物0.5 mg,分别加入越橘对照提取物约1.250、0.500、0.156 mg,加入1 mL 40%甲醇水溶液,超声提取5 min,12 000 r/min离心(离心半径5 cm)5 min,取上清,用40%甲醇水稀释10倍,过0.22 μm微孔滤膜。按照“2.1.1”和“2.1.2”项下的方法测定,记录花青素峰面积,计算平均加样回收率和RSD。结果(表2)显示RSD均小于5.00%,表明该方法加样回收率良好。
精密吸取3种对照品储备液适量,混合,用40%甲醇水稀释,配制成含C11(40 μg/mL)、C14(40 μg/mL)和C15(40 μg/mL)的混合对照品溶液(QC-高),用甲醇依次稀释,制备成含C11(20 μg/mL)、C14(20 μg/mL)和C15(20 μg/mL)的中质量浓度质控溶液(QC-中),以及含C11(10 μg/mL)、C14(10 μg/mL)和C15(10 μg/mL)的低质量浓度质控溶液(QC-低)。先测定混合越橘提取物中C11、C14、C15含量后,精确称混合越橘提取物0.5 mg,分别加入1 mL QC-高、QC-中和QC-低(每组平行6份),超声提取5 min,12 000 r/min离心(离心半径5 cm)5 min,取上清,用40%甲醇水稀释10倍,过0.22 μm微孔滤膜。按照“2.1.1”和“2.1.2”项下的方法测定,记录花青素峰面积,计算平均加样回收率和RSD。结果(表3)显示RSD均小于5.00%,表明该方法加样回收率良好。
2.4 花青素类成分含量测定
2.4.1 样品中20种花青素类成分的含量测定 取待测样品,按照“2.2.1”项下方法制备供试品溶液,按“2.1.1”和“2.1.2”项下方法测定。进行3次平行实验,记录峰面积根据随行标准曲线计算供试品溶液中各成分质量浓度,按照下式计算样品中各成分含量。
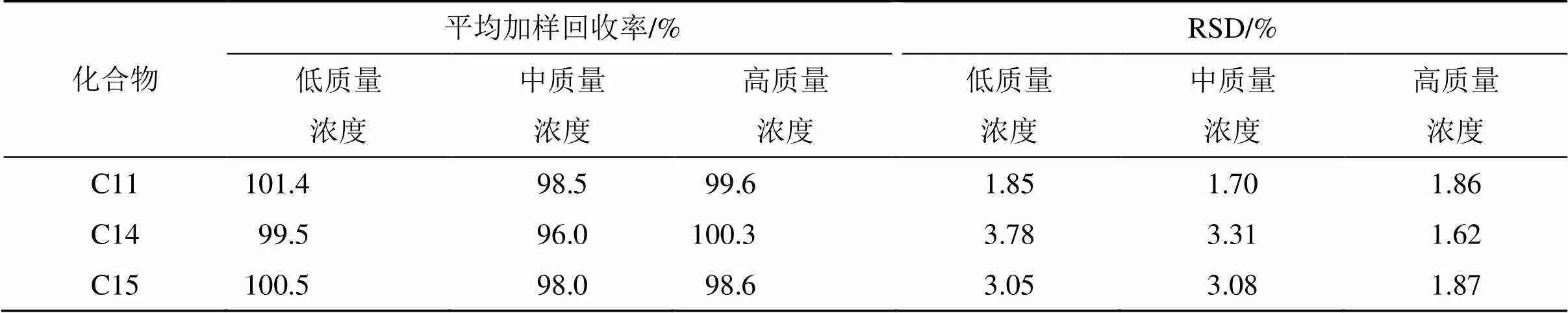
表3 3种花青素类成分的加样回收率结果(对照品法)
被测成分相对于对照越橘提取物中该成分的量=(标准曲线上计算出的各化合物浓度×所用提取溶剂体积×稀释倍数)/所取样品质量
采用建立的对照品非依赖性花青素类UPLC-QQQ-MS/MS定量方法,对10批市售欧洲越橘提取物中的花青素类成分含量进行研究。正离子模式下的提取离子流色谱图见图1。按照“2.4”项下公式计算被测成分相对于对照越橘提取物中该成分的量,结果表明不同产家中化合物C1、C4、C6、C10、C13、C14、C16~C18和C20含量差异相对较小(RSD<5.00%),而其余化合物含量波动较大,其中化合物C5的含量差异最为明显(RSD为18.23%)。结果详见表4。
2.4.2 20种花青素类成分的相关性分析 相关性分析是指对2个或多个具备相关性的变量元素进行分析,从而衡量2个变量因素的相关性密切程度(0<||≤0.3为微弱相关,0.3<||≤0.5为低度相关,0.5<||≤0.8为显著相关,0.8<||≤1.0为极显著相关)。为了解花青素之间的相关性密切程度,用SPSS 22.0软件对20种花青素类成分含量进行相关性分析,应用Graphpad Prism软件对数据进行绘图展示。结果如图2所示。结果表明,矢车菊素与C6(=0.87,<0.01)、芍药素与C7(=0.86,<0.01)、飞燕草素与C16(=0.95,<0.01)、飞燕草素与C15(=0.91,<0.01)、矮牵牛素与C17(=0.90,<0.01)呈极显著相关。此外,C11与飞燕草素(=−0.67,<0.05)、C16(=−0.55,<0.05)、C8(=−0.68,<0.05)呈显著负相关。此外,C10与C13(=−0.62,<0.05)、锦葵素与C18(=−0.60,<0.05)也呈显著负相关。
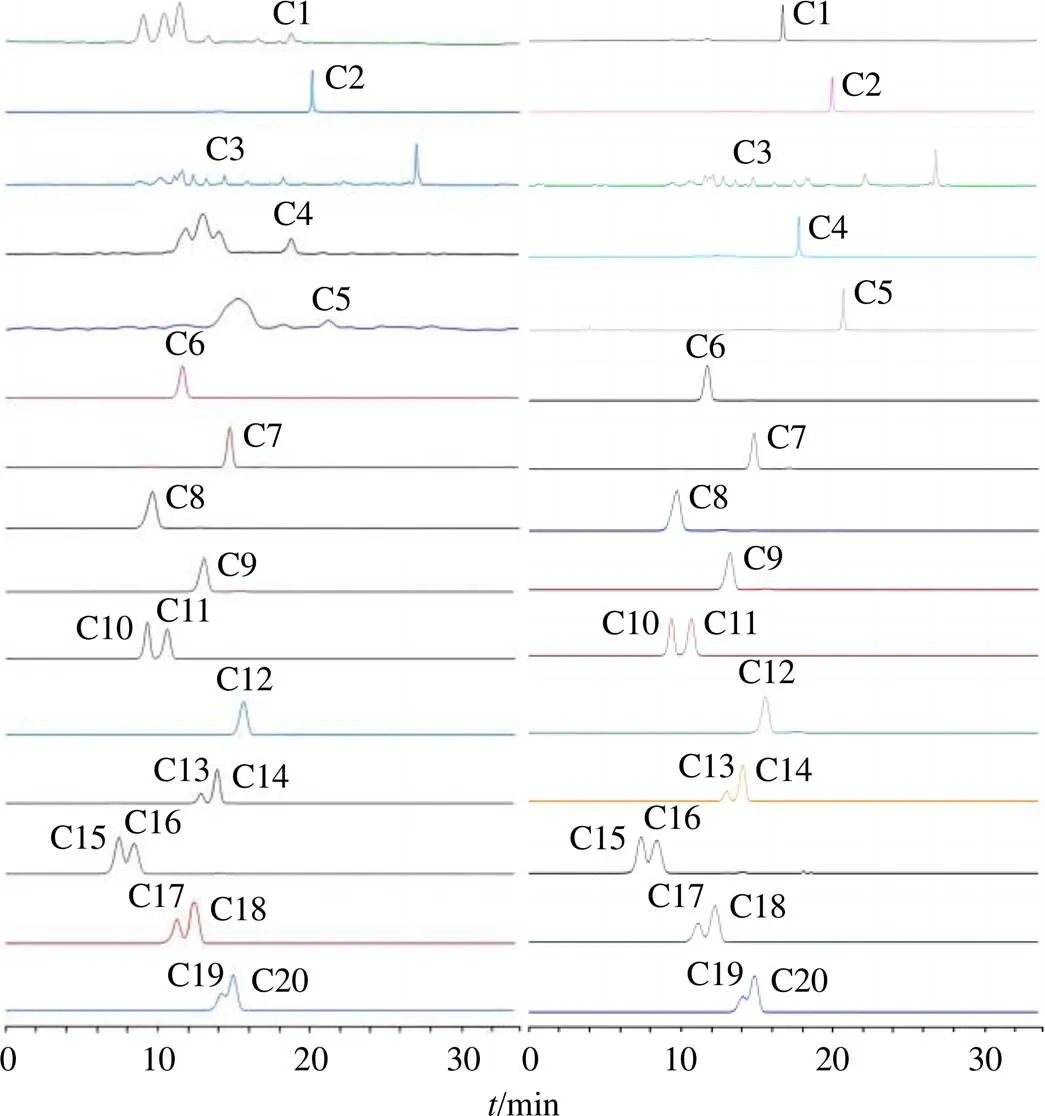
图1 越橘标准提取物(A) 和越橘提取物(S1, B) 中20种花青素类成分(C1~C20) 的MRM色谱图

表4 10批越橘提取物样品中20种花青素类成分相对于对照越橘提取物中该成分的量
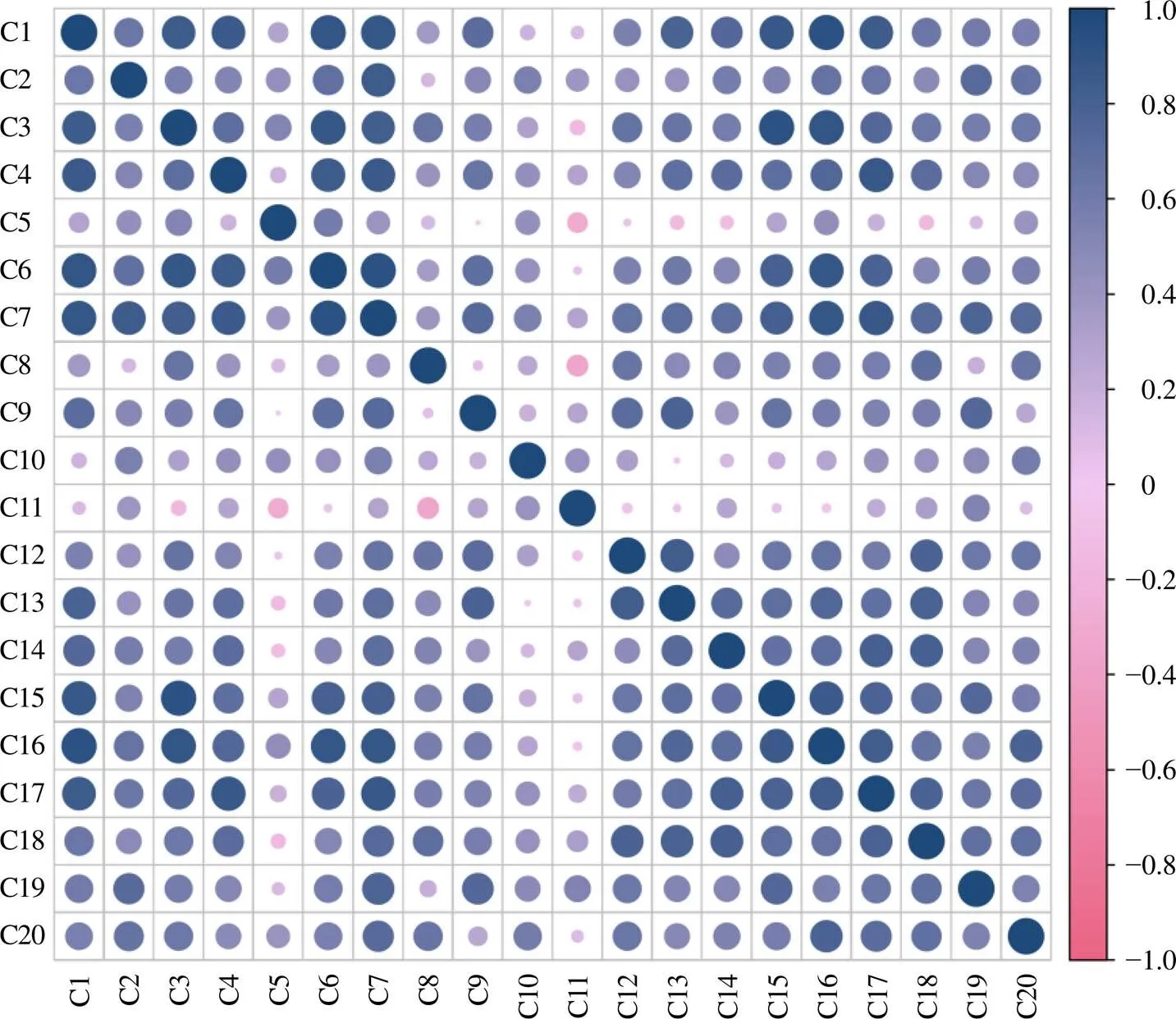
图2 20种花青素类成分的相关性分析
2.5 体外抗氧化活性检测
2.5.1 DPPH自由基清除活性的测定 DPPH自由基清除能力测定参考文献方法[8]。
(1)标准曲线绘制:精确称取10.012 mg的水溶性维生素E(Trolox)对照品粉末,加入无水乙醇溶解200 mL,配制成200 μmol/L的Trolox母液。随后将母液稀释为20、40、60、100、140、160、180 µmol/L的Trolox标准梯度液。准确吸取0.9 mL不同浓度的Trolox对照品溶液于不同离心管中,随后加入0.9 mL 100 μmol/L的DPPH乙醇溶液,混匀后在室温下黑暗静置30 min。在517 nm波长下测定吸光度值(1),同样的方法检测Trolox对照品与25%甲醇溶剂的吸光度值(2),以及25%甲醇溶剂与100 μmol/L DPPH溶液混合后的吸光度值(3),利用以下公式计算DPPH自由基的清除率。
清除率=1-(1-2)/3
根据Trolox浓度()和DPPH自由基清除率()绘制标准曲线,得回归方程为=0.005 6-0.031 1,=0.999 0,线性范围为20~180 μmol/L。依据上述标准曲线,得到样品的DPPH清除能力,单位为每克样品干质量的µmol Trolox当量(Trolox µmol/g DW)。
(2)样品的DPPH自由基清除率:分别取“2.2.1”项下制备的越橘提取物溶液和100 μmol/L DPPH溶液各0.9 mL,充分混合,室温避光静置30 min后,于517 nm处测定其吸光度()值,每个样品重复3次。DPPH自由基清除率公式同上。
对10批越橘提取物清除DPPH自由基活性研究,结果如表5所示,在质量浓度为0.1 mg/mL下,所有越橘提取物的DPPH自由基清除率均高于90%。样品S1的DPPH自由基清除率最高,为96.7%,该样品在质量浓度0.1 mg/mL时与178.26 Trolox µmol/g DW的清除率相当;样品S10的清除率最低,为91.4%,该样品在质量浓度0.1 mg/mL时与168.80 Trolox µmol/g DW的清除率相当。

表5 不同批次越橘提取物的DPPH自由基清除率和总抗氧化能力检测结果(, n = 3)
2.5.2 总抗氧化活性测定
(1)标准曲线绘制:精确称取FeSO4·7H2O 10 mg。加入0.9 mL蒸馏水,20 μL浓硫酸,配制成40 μmol/mL FeSO4标准溶液母液。将母液用蒸馏水稀释为100.0、50.0、25.0、12.5、62.5、3.125 μmol/L的标准梯度液。根据总抗氧化能力试剂盒说明书,分别取500 μL标准溶液(蒸馏水作空白)加入500 μL工作液,充分混匀,反应10 min,测定593 nm下的,计算Δ标准=标准-空白,此时Fe2+终浓度为50.0、25.0、12.5、6.25、3.125、1.562 5 μmol/L。根据Fe2+终浓度(,μmol/L)和Δ标准(),建立标准曲线,得回归方程为=5.118 6-0.000 7,=0.999 8,线性范围为1.562 5~50.0 μmol/L。
(2)样品总抗氧化活性测定:根据总抗氧化能力试剂盒说明书,分别取“2.2.1”项下制备的越橘提取物溶液30 μL,蒸馏水90 μL及混合工作液900 μL充分混匀,室温准确反应10 min,随后于593 nm波长处测定值。将值代入标准曲线,得到达到同样吸光度变化值(Δ)所需的标准液离子浓度(μmol/mL)。根据以下公式计算样品总抗氧化能力(μmol/g)。
总抗氧化能力(μmol/g)=×反总÷(样÷样总×)=34×÷
样总为加入提取液体积,1 mL;反总为反应总体积,1.02 mL;样为反应中样品体积,0.03 mL;为标准液离子浓度;为样品质量
越橘提取物总抗氧化能力的结果如表5所示,其中,样品S1的总抗氧化能力最高,为4.92 μmol/g,样品S10的总抗氧化能力最低,为3.65 μmol/g。与DPPH自由基清除率实验结果一致。
2.5.3 20种花青素类成分抗氧化活性的相关性分析 20个花青素类成分与抗氧化活性的相关性见表6。矢车菊素、C15与DPPH自由基清除率相关性均大于0.90,其中矢车菊素最高,为0.94。锦葵素、C10及C11相关性≤0.30。C9、C13与总抗氧化能力相关性均大于0.90,其中C13最高,为0.93。锦葵素和C10相关性≤0.30。

表6 20种花青素类成分与DPPH自由基清除率和总抗氧化能力的相关性
3 讨论
3.1 标准对照提取物在含量测定中的优势
对照品在被测物质含量测定过程中能够起到至关重要的作用。但是,实际操作中常常面临的问题是对照品价格较高或者较难获得,这些因素无形中增加了科研的难度和阻力[9]。而利用标准对照提取物进行含量测定,相较于单体化合物最大的优势在于其能够同时对多个化合物进行含量测定,且标准对照提取物更稳定、易获取,价格便宜,能够解决部分单体化合物稳定性差、制备要求严苛、制备成本高、运输保存难等问题[10-13]。欧洲越橘的标准对照提取物在《欧洲药典》10.0中有记载,从定义、含量、生产过程、特征及鉴别5个方面对其进行了限制,质量可控。目前,《中国药典》2020年版收载的对照提取物有23种,集中在挥发油、脂肪酸、皂苷类成分[14],且这些对照提取物主要被用于定性鉴别,而在含量测定项目中应用较少。
3.2 检测方法的选择
目前,常见的花青素类成分含量测定方法有分光光度法、高效液相色谱紫外分光光度法及薄层色谱法等[15-16]。分光光度法虽然简单常用,但不具备分离能力,不能同时对多个成分进行定量,且结果受到溶剂选择、样品颜色和杂质的影响,容易引入误差;薄层色谱法快速,较多用于定性研究,具有分离能力,但分离能力不佳。综合考虑本研究采用同时兼具液相色谱的高分离能力和质谱的高灵敏度等优点的LC-MS联用法[6,17]。三重四极杆质谱(QQQ)的多反应监测模式(MRM)具有极高的灵敏度,可对样品中的微量成分精确定量,结果准确可靠,是中药定量分析中的有效手段[18-19],因此,本实验利用UPLC-QQQ-MS/MS建立越橘中20种花青素类成分的定量分析方法。
3.3 不同批次越橘提取物中花青素含量测定
通过对10批市售提取物含量测定结果可以看出,化合物C2、C3、C5、C7~C9、C11、C12、C15和C19在各样品中含量波动较大(RSD>5.00%),其中以C5差异最为显著,RSD值为18.23%,而C1、C4、C6、C10、C13、C14、C16~C18和C20的含量波动相对较小(RSD<5.00%)。此外,除S9和S10 2批样品以外,其余8批样品中化合物C4、C8、C16和C18的含量均高于越橘对照提取物,造成这种差异的原因可能是由于不同厂家生产工艺差异或材料来源不同等,导致越橘提取物中花青素含量波动较大。因此对越橘提取物中花青素类成分含量的控制显得尤为重要。
本实验对花青素类成分含量进行相关性分析,结果显示矢车菊素与C6、芍药素与C7、飞燕草素与C15及C16、矮牵牛素与C17呈极显著相关,可能是因为在花青素合成通路中,花青素是各类花青苷合成的前体,在类黄酮-3-葡糖基转移酶的作用下花青素实现糖基化变成较为稳定的花青苷,因此,它们的含量变化紧密相关。此外,C11与飞燕草素、C16、C8呈显著负相关。可能是因为在花青素合成过程中,二氢黄酮醇在类黄酮3′-羟化酶、类黄酮3′,5′-羟化酶作用下分别生成二氢槲皮素和二氢杨梅黄酮,二者在二氢黄酮醇还原酶和花青素合成酶的作用下分别生成矢车菊素和飞燕草素[20],矢车菊素、飞燕草素及二者糖苷皆由二氢黄酮醇分化而来,因此它们可能存在竞争关系,这一原因可能导致了它们呈负相关。
3.4 抗氧化活性的研究
目前,关于花青素抗氧化机制的研究已经取得了显著进展。研究者认为花青素的抗氧化活性受到分子结构的影响,苷元、糖基、甲基和酰化酸的类型、糖基化、甲基化和酰化的位置和程度对其抗氧化能力均有影响。此外,花青素的质量分数也是影响抗氧化活性的重要因素[21]。本研究发现,在20种花青素类成分与抗氧化活性相关性研究中矢车菊素与DPPH自由基清除能力呈极显著相关,C13与总抗氧化能力呈极显著相关,建议将二者作为抗氧化活性的标志性成分,便于对后续花青素抗氧化活性的研究。
4 结论
欧洲越橘作为重要的“功能性食品”拥有悠久的食用史,随着现代科学技术的发展及人民生活水平的提高,越橘提取物因其丰富的花青素含量而备受关注。本研究以《欧洲药典》中的越橘标准提取物代替对照品,基于UPLC-QQQ-MS/MS建立了同时测定欧洲越橘提取物中20种花青素的定量方法,该方法稳定性高,精密度好,重复性强能够准确测定越橘中花青素的含量。
同时定量结果表明,来自不同产家样品中花青素含量差异,这可能是由于花青素本身不稳定或者生产工艺、材料来源等原因导致。此外抗氧化活性实验表明,矢车菊素有望作为欧洲越橘提取物清除DPPH自由基活性的质控成分,而C13有望作为总抗氧化活性的质控成分。本研究为欧洲越橘花青素类成分的质量控制提供了新方法。
利益冲突 所有作者均声明不存在利益冲突
[1] Schantz M, Mohn C, Baum M,. Antioxidative efficiency of an anthocyanin rich bilberry extract in the human colon tumor cell lines Caco-2 and HT-29 [J]., 2010, 1(1): 25-33.
[2] Colak N, Torun H, Gruz J,. Bog bilberry phenolics, antioxidant capacity and nutrient profile [J]., 2016, 201: 339-349.
[3] 毛丹, 冯睿, 程益清, 等. 越橘提取物中花色苷及游离花青素的测定[J]. 食品与药品, 2021, 23(4): 306-310.
[4] Chandra A, Rana J, Li Y. Separation, identification, quantification, and method validation of anthocyanins in botanical supplement raw materials by HPLC and HPLC-MS [J]., 2001, 49(8): 3515-3521.
[5] Flamini R, D T. The anthocyanin content in berries of the hybrid grape cultivars Clinton and Isabella [J]., 2000, 2(39): 79.
[6] 张黎媛. 液质联用技术在中药质量控制中的应用[J]. 世界中医药, 2018, 2(13): 513-516.
[7] 高渐联, 周霖, 王肖辉, 等. 基于液质联用结合网络药理学的复方伤痛胶囊中5种药效成分定量及作用机制研究 [J]. 中草药, 2023, 54(6): 1793-1803.
[8] Brand-Williams W, Cuvelier M E, Berset C. Use of a free radical method to evaluate antioxidant activity [J]., 1995, 28(1): 25-30.
[9] 吴婉莹, 果德安. 中药整体质量控制标准体系构建的思路与方法[J]. 中国中药杂志, 2014, 39(3): 351-356.
[10] 朱星宇, 赵根华, 高倩倩, 等. 对照提取物法测定补骨脂饮片中7种成分含量[J]. 中国实验方剂学杂志, 2017, 23(15): 85-91.
[11] 张鑫, 张苗苗, 王云霞, 等. 对照提取物法测定银杏叶制剂中总黄酮醇苷的含量[J]. 中南药学, 2016, 14(8): 867-870.
[12] 陈沛, 金红宇, 孙磊, 等. 对照提取物在中药整体质量控制中的应用[J]. 药物分析杂志, 2016, 36(2): 185-195.
[13] 刘刚, 刘金梅, 穆开朗, 等. 2-异丁基苹果酸葡萄糖氧基苄酯类对照提取物在白及质量控制中的应用研究 [J]. 中草药, 2023, 54(4): 1260-1266.
[14] 中国药典[S]. 四部. 2020: 433.
[15] 刘芳芳, 向成钢, 张宏, 等. 高效液相色谱法与pH示差法测定紫荚豌豆花青素含量的比较[J]. 食品科技, 2022, 47(1): 298-303.
[16] 李夏. 葡萄中花青素含量的测定与分析[J]. 粮食流通技术, 2022, 15(28): 179-182.
[17] 刘荣霞, 果德安, 叶敏, 等. 液质联用技术(LC/MS)在中药现代研究中的应用[J]. 世界科学技术—中医药现代化, 2005, 7(5): 33-40.
[18] 李俊, 米要磊, 王思嘉, 等. 基于UPLC-QQQ-MS/MS的工业大麻中6种大麻素类成分定量研究[J]. 中草药, 2022, 53(4): 1163-1172.
[19] 刘祥东, 梁琼麟, 罗国安, 等. 液质联用技术在医药领域中的应用[J]. 药物分析杂志, 2005, 25(1): 110-116.
[20] 贾赵东, 马佩勇, 边小峰, 等. 植物花青素合成代谢途径及其分子调控[J]. 西北植物学报, 2014, 34(7): 1496-1506.
[21] 李煦, 白雪晴, 刘长霞, 等. 天然花青素的抗氧化机制及功能活性研究进展[J]. 食品安全质量检测学报, 2021, 12(20): 8163-8171.
Quality control method and pharmacological activity correlation study ofextract based on reference extract
LI Zhen1, 2, LI Jun2, AN Ruofan2, SUN Wei2, YUE Zhongbao3, YANG Wei2, HE Ruikun3
1. College of Pharmaceutical Science, Dali University, Dali 671000, China 2. Key Laboratory of Beijing for Identification and Safety Evaluation of Chinese Medicine, Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100007, China 3. Institute of Nutrition & Health, BYHEATH Co., Ltd., Guangzhou 510663, China
To establish a method for the quantitative analysis of 20 anthocyanin components based on the reference extract of Ouzhouyueju () and to utilize the method for the quality control of commercializedmacrocarpon extracts, and screen out a representative antioxidant active ingredient.An ultra-performance liquid chromatography-triple quadrupole tandem mass spectrometry (UPLC-QQQ-MS/MS) method was developed for the quantification of 20 anthocyanin components using reference extract ofmacrocarpon as the standard, and the method was utilized to investigate 10 batches of commercially availablemacrocarpon extracts. The antioxidant capacity of differentextracts was evaluated using the DPPH free radical scavenging method and the total antioxidant test.A UPLC-QQQ-MS/MS method was developed for the quantitative analysis of 20 anthocyanin compounds in the extract ofwith reference extract. Methodological validation demonstrated good linearity (: 0.999 4—1.000 0), precision RSD (0.05%—4.23%), stability (0.29%—3.38%), and average recovery rate (98.1%—102.1%) of the 20 anthocyanin components. The results of the sample analysis showed that there were significant differences in the content of some components in different samples, with the greatest variation being malvidin with an RSD of 18.23%.extract has better DPPH radical scavenging and total antioxidant capacity. Cyanidin and peonidin-3--galactoside could be potential quality control components for assessing the DPPH radical scavenging and total antioxidant activity ofextracts, respectively.A quantitative analysis method of 20 anthocyanin components inextract was established in this study based on UPLC-QQQ-MS/MS. The method is sensitive, accurate, simple, and suitable for the determination of the content of 20 anthocyanin components in theextract, which provides data support for the application of the reference extract of traditional Chinese medicine to replace the single standard in the quality control of traditional Chinese medicine. The method provides a new research idea for the quality control study of traditional Chinese medicine.
L.; reference extract; UPLC-QQQ-MS/MS; antioxidant capacity; quality control; anthocyanins; cyanidin-3--glucoside; peonidin 3--glucoside; delphinidin-3--galactoside; malvidin; cyanidin; peonidin-3--galactoside
R283.6
A
0253 - 2670(2024)08 - 2561 - 10
10.7501/j.issn.0253-2670.2024.08.007
2023-09-26
中央级公益性科研院所基本业务费专项资金资助(ZZ13-YQ-45);中国中医科学院科技创新工程项目(CI2021A04902);中央级公益性科研院所基本业务费专项资金资助(ZXKT18015)
李 镇(1996—),男,彝族,硕士研究生,从事药动学研究。E-mail: lizhen77649@126.com
通信作者:杨 维,副研究员,从事药动学研究。E-mail: wyang@icmm.ac.cn
贺瑞坤,从事天然产物功效研究及保健食品开发。E-mail: herk@by-health.com
[责任编辑 郑礼胜]
