高光学纯度乳酸菌株的筛选及发酵性能研究
2024-04-22刘兰李鹏王通黄筱萍
刘兰,李鹏,王通,黄筱萍
(江西省科学院微生物研究所,江西 南昌,330096)
乳酸又名2-羟基丙酸(2-hydroxy propanoic acid),作为生物基大宗化学品,在化工、医药、食品等领域有着广泛的应用。根据乳酸的旋光性质可分为L-乳酸、DL-乳酸和D-乳酸[1-4]。目前全球乳酸行业主要是以生产DL-乳酸和L-乳酸为主,仅有少数几家企业能生产D-乳酸,且产量很低。随着可生物降解的绿色环保塑料聚乳酸(polylactic acid,PLA)的兴起,对高光学纯度L-乳酸、D-乳酸的需求量急剧增加[5-6]。以L-乳酸为原料制成的聚L-乳酸(PLLA)存在多种性能不稳定的缺点,通过在PLLA中加入一定量的聚D-乳酸(PDLA)进行共混,形成的聚乳酸(scPLA)具有更高的溶解温度和更好的机械性能[7],可用于高附加值工程塑料领域和改善PLA性能拓展等领域,但对制备PLA的原料L-乳酸和D-乳酸的光学纯度有很高的要求[8-10]。微生物利用淀粉质原料发酵生产乳酸,大多数乳酸菌只产生DL-乳酸[11-12],只有极少数的菌株和一些工程改造菌能生产高光学纯度的L-乳酸或D-乳酸[13-14]。尤其是D-乳酸在发酵菌种的多样性及发酵水平方面存在较大的差距,光学纯度难以达到生产聚合级乳酸标准,远远不能满足PLA工业市场的需要。尽管国内外众多学者多年来已经在发酵法生产L-或D-乳酸取得了很多的研究成果,但仍存在光学纯度低、产酸低或发酵周期长等问题[15-19]。孙家夺等[20]报道了利用Sporolactobacillussp.YBS1-5发酵90 h,D-乳酸产量为111.8 g/L,产酸速率为1.24 g/(L·h),光学纯度为98.0%。胡中华等[21]采用凝结芽孢杆菌JD-DFT011发酵生产L-乳酸,在套接菌种量为28%时,L-乳酸最高光学纯度和回收率分别达99.80%和98.57%。通过基因改造在获得高光学纯度L-乳酸和D-乳酸菌方面取得了较大的进展。但由于工程菌的稳定性及生产上的适用性等原因,菌株在工业化生产中的应用亦很困难[22]。因此筛选高光学纯度的L-乳酸或D-乳酸生产菌成为乳酸行业发展首要解决的问题,而通过从自然界中分离高光学纯度的L-乳酸或D-乳酸产生菌,是获得高光学纯度乳酸生产菌的有效方法。
基于自然界产乳酸的菌株十分丰富,本研究旨在通过建立高效的筛选方法,分离获得高光学纯度的L-乳酸或D-乳酸产生菌,作为后续菌种改良和发酵调控的出发菌株。为工业化生产提供高产酸量、高光学纯度的优良菌种资源。
1 材料与方法
1.1 材料与仪器
1.1.1 样本采集
从江西省安义县凤凰山桃园、南丰县罗里石蜜桔种植基地、赣州信丰县裕和脐橙种植基地、九江市葡萄种植基地、福建莆田和龙岩的龙眼、荔枝种植基地的果园土壤、腐烂果实和树皮中采集样品,以及在市售的酸菜、泡菜中采集样品,装入无菌的采样袋中,置4 ℃冰箱保存。
1.1.2 仪器与试剂
BX43相差生物显微镜,美国OLYMPUS公司;D30分光光度计,德国Eppendorf股份公司;Arktik多功能PCR仪,赛默飞世尔科技有限公司;2695e高压液相色谱仪、2414示差检测器、2489紫外检测器,美国Waters公司;Practum 224-ICN分析天平,德国Sartorius公司;H1650-W高速离心机,湖南湘仪离心机仪器有限公司;ZWY-2102C恒温培养振荡器,上海智城分析仪器制造有限公司;SPX-250B-Z生化培养箱,上海博迅仪器有限公司;SW-CJ-1CU洁净工作台,苏州安泰空气设备有限公司。
厌氧产气袋(规格350 mL和2.5 L)、培养袋(规格15 cm×30 cm和2.5 L)、氧气指示剂,日本三菱株式会社;DL-乳酸钠标准品,美国SIGMA公司;轻质碳酸钙,广西西陇化工有限公司;葡萄糖、酵母粉、蛋白胨、琼脂粉等试剂,生工生物工程(上海)股份有限公司;其他试剂均为分析纯或化学纯。
1.2 实验方法
1.2.1 培养基
MRS培养基(g/L):葡萄糖10、酵母粉10、蛋白胨5、KH2PO40.25、K2HPO40.25、MgSO4·7H2O 0.4、MnSO4·5H2O 0.02、FeSO4·7H2O 0.02、NaCl 0.02,pH 6.8。
产酸分离培养基(g/L):在MRS液体培养基中加入CaCO35,琼脂粉18。
种子培养基(g/L):在MRS液体培养基中加入CaCO35。
基础发酵培养基(g/L):葡萄糖120、酵母粉5、蛋白胨5、KH2PO40.25、K2HPO40.25、MgSO4·7H2O 0.4、MnSO4·5H2O 0.02、NaCl 0.02、CaCO355。
1.2.2 样品的分离与纯化
取0.25 g样品加入5 mL的MRS液体培养基中,置于放有厌氧产气袋和O2指示剂的培养袋中,密封后于37 ℃厌氧静置培养48 h,富集厌氧菌。定量量取15 mL产酸分离培养基倒入φ9 cm无菌平皿中,取0.1 mL富集后的菌液进行梯度稀释度,稀释液涂布于平皿中,稀释液菌浓度以每平皿中长10~100个菌落为宜,平皿置于放有厌氧产气袋的培养袋中,密封后于37 ℃厌氧静置培养48 h后进行观察,挑选透明圈大的单菌落进行划线纯化培养,连续纯化3次后,接种于MRS斜面培养基中,同样条件下厌氧培养48~72 h,置4 ℃冰箱保存。
1.2.3 高光学纯度产乳酸菌株的摇瓶筛选
保存的斜面菌株分别用2 mL的生理盐水洗脱,全部菌液接入装有30 mL种子培养液的三角瓶中,置于装有350 mL厌氧产气袋和O2指示剂的培养袋,密封后固定在摇床中,于37 ℃、150 r/min厌氧培养16 h。种子液按6%的接种量接种至100 mL发酵液中,摇瓶发酵厌氧培养方式同种子液,于37 ℃、180 r/min厌氧培养48 h,取发酵液按1.2.6节分析方法检测乳酸浓度及光学纯度。筛选产高光学纯度的L型或D型乳酸菌株进行菌种鉴定和进一步发酵试验。
1.2.4 高光学纯度产乳酸菌株的鉴定
1.2.4.1 形态学观察
将不同菌株分别涂布于产酸分离培养基中37 ℃、厌氧培养48 h后,观察菌落形态,同时进行革兰氏染色,于显微镜下观察菌体形态。
1.2.4.2 生理生化鉴定
将纯化的产酸菌分别接种于不同的生理生化培养基中,参照《伯杰氏细菌鉴定手册》[23]和《乳酸细菌分类鉴定及实验方法》[24]对菌株进行生理生化鉴定。
1.2.4.3 菌株16S rDNA序列扩增与分析
提取待测菌株的基因组DNA,以引物7F(5′-CAGAGTTTGATCCTGGCT-3′)和1540R(5′-AGGAGGTGATCCAGCCGRECA-3′)扩增16S rDNA。PCR反应条件:95 ℃、5 min预变性;94 ℃、30 s变性,57 ℃、30 s退火,72 ℃、90 s延伸,30个循环;72 ℃、10 min延伸,PCR产物经琼脂糖凝胶电泳,在生工生物工程(上海)股份有限公司完成测序及全基因序列分析。
系统进化树的构建和分析:将测序获得16S rDNA序列在NCBI核酸数据库中进行BLAST搜索比对,结果采用MEGA8.0中的邻接法(neihbor-joining tree)进行系统树的构建,并用Bootstrap对进化树进行1 000次可信度分析。
1.2.5 高光学纯度产乳酸菌株发酵性能研究
1.2.5.1 生长曲线的测定
将待测菌株按5%接种量接种于MRS培养液中,于37 ℃、150 r/min厌氧培养24 h,每隔2 h取样,用分光光度计测定波长600 nm处的OD值,获得生长曲线。
1.2.5.2 种子液培养和发酵产酸试验
菌株分别接种于种子培养液中,依据不同菌株的最佳种龄于37 ℃、150 r/min厌氧培养12~18 h,按6%的接种量接种于摇瓶发酵培养液中,于37 ℃、180 r/min厌氧培养72 h,每12 h取样测定乳酸含量和残糖,发酵结束时测定光学纯度。
1.2.6 检测方法
1.2.6.1 乳酸和葡萄糖含量测定
发酵液于10 000 r/min离心10 min,取上清液,稀释,用0.22 μm聚醚水性滤膜过滤,采用Waters e2695 Alliance高效液相色谱分离单元和Waters 2414示差检测器进行分析。色谱条件:色谱柱TOSOH Tskgel OApak-P+OApak-A(300 mm×7.8 mm,5 μm);柱温30 ℃;进样量10 μL;流速1.0 mL/min;流动相0.75 mmol/L H2SO4;根据标准校正曲线计算发酵液中乳酸和糖含量。
1.2.6.2 乳酸光学纯度测定
将发酵液中乳酸含量稀释至1 g/L左右,采用Waters e2695 Alliance高效液相色谱分离单元和Waters 2489UV/Vis紫外检测器进行分析。色谱条件:色谱柱 SUMICHIRAL OA-5000(4.6 mm×150 mm);柱温40 ℃;进样量5 μL;流速1.0 mL/min;流动相1 mmol/L CuSO4。根据面积归一法计算乳酸L体或D体含量,如公式(1)、公式(2)所示。
L体光学纯度/%(ee)=(SL-SD)/(SL+SD)×100
(1)
D体光学纯度/%(ee)=(SD-SL)/(SL+SD)×100
(2)
式中:SL,L体峰面积;SD,D体峰面积。
2 结果与分析
2.1 产乳酸菌株的初筛、产酸水平及光学纯度初步分析
将采集的100多份样品通过产酸平皿的筛选纯化,获得77株产酸菌株,通过摇瓶对产乳酸能力和光学纯度的初步分析,其中2株为产高光学纯度D-乳酸菌株,2株产高光学纯度L-乳酸菌株,其光学纯度均达99.80%(ee)以上;另外有58株产DL-乳酸菌株,有些菌株产乳酸较高。表1为具有工业应用潜力的4株产高光学纯度乳酸菌株和部分高产DL-乳酸菌株的初筛结果,图1为4株产高光学纯度乳酸菌株的光学纯度色谱图。
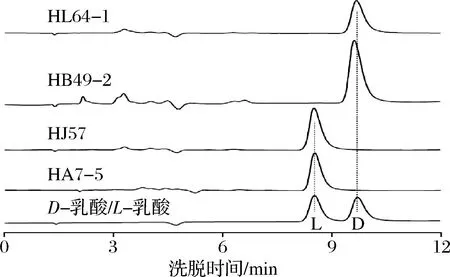
图1 四株高光学纯度乳酸菌株的光学纯度色谱图Fig.1 Optical purity chromatograms of four high optical purity lactic acid bacteria strains
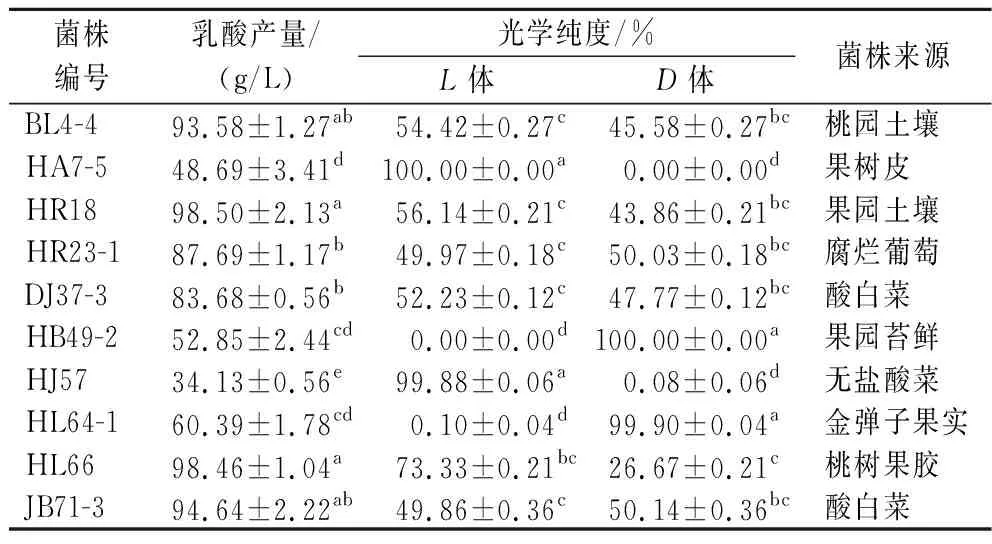
表1 有潜在应用价值的乳酸菌初筛结果Table 1 Preliminary screening results of potential lactic acid bacteria
菌株HA7-5和HJ57为高光学纯度L-乳酸生产菌,L-乳酸光学纯度分别达到100%和99.88%,菌株HB49-2和HL64-1为高光学纯度D-乳酸生产菌,D-乳酸光学纯度分别达到100%和99.90%,这4株菌株光学纯度均很高,但乳酸产量偏低,不及大部分DL-乳酸产生菌,可通过进一步优化发酵条件和培养基组成以及诱变技术和基因定向改造以提高产量。其他6株菌株均为DL-乳酸生产菌,它们在基础发酵培养基中乳酸产量很高,其中有4株菌株在发酵48 h产量均达到了90 g/L以上,具有潜在的工业化应用价值。
2.2 四株产高光学乳酸菌株的鉴定
2.2.1 菌株形态学观察
4株产高光学纯度乳酸菌株在固体平板培养基上培养48 h,观察各菌株菌落形态,以及菌体革兰氏染色后于100×显微镜观察下菌体形态,见表2及图2、图3。
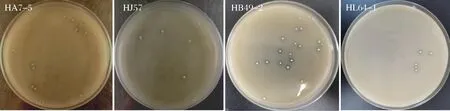
图2 四株高光学纯度乳酸菌株的菌落形态Fig.2 Colony morphology of four high optical purity lactic acid bacteria strains

图3 四株高光学纯度乳酸菌株的菌体细胞形态Fig.3 Cell morphology of four high optical purity lactic acid bacteria strains
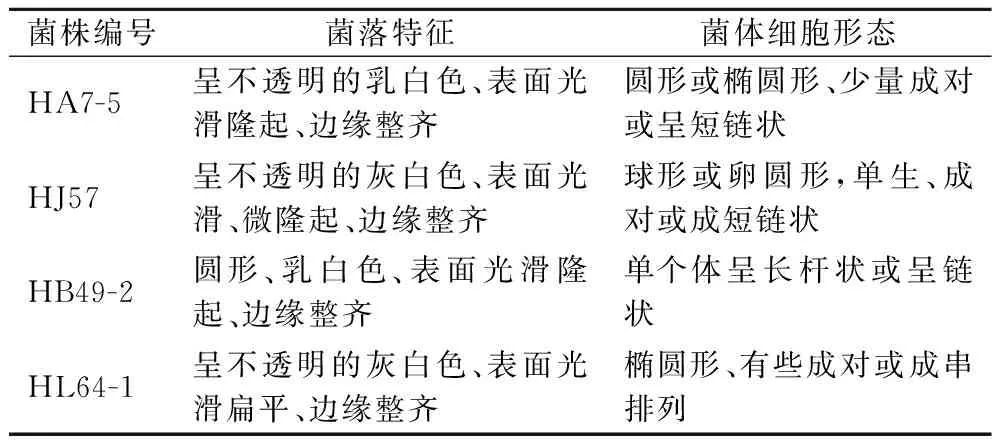
表2 菌落及菌体细胞的形态特征Table 2 Morphological characteristics of colonies and cells
2.2.2 菌株生理生化鉴定
将4株产高光学纯度乳酸的菌株分别接种于相应的生理生化培养基,与未接菌的空白组作对比,通过检测各菌株的生理生化特性,根据革兰氏染色及生理生化反应结果(表3),参照《伯杰氏细菌鉴定手册》和《乳酸细菌分类鉴定及实验方法》,菌株HA7-5、HJ57、HB49-2和HL64-1的主要生理生化特征分别与屎肠球菌、格氏乳球菌、德氏乳杆菌和假肠膜明串株菌的生理生化特征相符。

表3 四株高光学纯度乳酸菌株的主要生理生化特征Table 3 Main physiological and biochemical characteristics of four high optical purity lactic acid bacteria strains
2.2.3 菌株16S rDNA序列分析
为了进一步鉴定菌株HA7-5、HJ57、HB49-2及HL64-1,对其16S rDNA序列分别进行了测定。BLAST比对结果显示菌株HA7-5、HJ57、HB49-2及HL64-1分别属于屎肠球菌、格氏乳球菌、德氏乳杆菌及假肠膜明串珠菌,其中菌株HA7-5与E.faeciumVVEswe-R同源性为100%,菌株HJ57与L.garvieaeNBRC100934同源性为100%,菌株HB49-2与L.delbrueckiiATTC9649同源性为99.8%,菌株HL64-1与L.pseudomesenteroidesG29同源性为100%。此外,利用MEGA 8.0中的邻接法(NJ)构建了这些菌株的系统发育进化树(图4)。结合形态学、生理生化鉴定结果,推测菌株HA7-5、HJ57、HB49-2及HL64-1分别属于屎肠球菌亚种、格氏乳球菌亚种、德氏乳杆菌亚种及假肠膜明串珠菌亚种,分别命名为屎肠球菌HA7-5、格氏乳球菌HJ57、德氏乳杆菌HB49-2及假肠膜明串珠菌HL64-1。
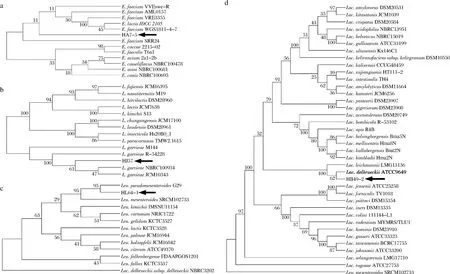
a-屎肠球菌HA7-5;b-格氏乳球菌HJ57;c-假肠膜明串株菌HL64-1;d-德氏乳杆菌HB49-2图4 基于16S rDNA序列BLAST结果4株高光学纯度乳酸菌株的系统发育树Fig.4 Phylogenetic trees of four high optical purity lactic acid bacteria strains based on 16S rDNA sequence BLAST results
自然界中能产乳酸的微生物很多,但大多数乳酸菌只产生DL-乳酸,产高光学纯度L-乳酸和D-乳酸的乳酸菌极少。相较于L-乳酸,无论在研发还是实际生产应用中,高光学纯度D-乳酸的发酵菌种属种多样性和发酵水平亦远低于L-乳酸。产L-乳酸的乳酸菌相对分布较广,产D-乳酸的菌株主要分布在4个菌属中:乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、芽孢乳杆菌属(Sporolactobacillus)和明串株菌属(Leuconostoc)[25]。通常野生菌株L-乳酸和D-乳酸产量和光学纯度均较低,通过菌株诱变可以大幅度提高产量,但光学纯度很难得到提高。如DEMRIC等[26]用甲基磺酸乙酯(ethyl methylsulfone,EMS)诱变D-乳酸产生菌L.delbrueckiiATCC 9649,D-乳酸产量从67 g/L增长到117 g/L,但光学纯度未有变化,均在97.5%左右。于培星[27]利用钴60γ-射线辐照凝结芽孢杆菌JD-063D,使得D-乳酸产量由出发菌株的61 g/L提高至145 g/L,光学纯度略有增加,达98.7%。本研究的目的是从自然界中获得光学纯度高于99.5%(ee)的D型和L型的野生菌株。共筛选获得了4株高光学菌株并进行了形态学、生理生化和16S rDNA鉴定,其中2株D-乳酸菌L.PseudomesenteroidesHL64-1和L.DelbrueckiiHB49-2的光学纯度(ee值)分别达到99.90%和100%,发酵48 h产量分别达60.39 g/L和52.85 g/L;2株L-乳酸菌E.faeciumHA7-5和L.garvieaeHJ57的光学纯度(ee值)分别达到100%和99.88%,发酵48 h产量分别达48.69 g/L和34.13 g/L。除德氏乳杆菌外,目前还未见到产高光学纯度和高产乳酸的假肠膜明串珠菌、屎肠球菌和格氏乳杆菌的报道,虽然所分离的高光学纯度乳酸菌乳酸的发酵水平较低,但光学纯度均非常高,通过基因突变育种、改良培养基组成和优化发酵条件等,有望在产量、发酵速率及原料多样性等方面得到较大的提升空间,不仅拓展了高光学纯度生产菌株的多样性,亦具有潜在工业应用价值。
2.3 产高光学纯度乳酸菌株发酵性能的初步研究
对4株产高光学纯度乳酸的菌株进行了生长曲线测定和发酵试验。图5-a为4株菌株的生长曲线,从中可看出,菌株HA7-5、HJ57和HL64-1在6 h左右进入对数生长期,10~12 h进入稳定生长期,而菌株HB49-2在12 h进入对数生长期,16 h进入稳定期,确定了菌株HA7-5、HJ57、HL64-1和HB49-2种子液种龄分别为12、10、12、16 h。

a-生长曲线;b-葡萄糖含量;c-乳酸含量图5 4株高光学纯度乳酸菌株发酵性能Fig.5 Fermentation properties of 4 high optical purity lactic acid bacteria strains
图5-b和图5-c为4株菌株在摇瓶发酵过程中的葡萄糖和乳酸分析结果。代谢曲线表明菌株HJ57和HL64-1前期产酸速率非常快,发酵24 h产酸分别达到30.56 g/L和62.03 g/L,随后产酸无明显增长,葡萄糖消耗亦非常缓慢,菌株HL64-1在24 h即可结束发酵,其平均产酸速率高达2.58 g/(L·h)。菌株HA7-5和HB49-2在发酵前48 h产酸速率和葡萄糖消耗均较快,随后产酸速率变缓,发酵72 h乳酸产量分别达到71.83 g/L和73.14 g/L。4株菌株的光学纯度分析和发酵结果见表4,光学纯度均在99.8%(ee)以上。

表4 四株高光学纯度菌株发酵结果Table 4 Fermentation results of 4 high optical purity lactic acid bacteria strains
对4株产高光纯度乳酸菌株进行的初步摇瓶试验表明,假肠膜明串珠菌HL64-1具有产酸速度快[2.58 g/(L· h)]、D-乳酸光学纯度高99.88%(ee)的优点,在初始葡萄糖为100 g/L的条件下,发酵周期仅为24 h,延长发酵时间和补加葡萄糖,乳酸产量提高不显著。德氏乳杆菌HB49-2产D-乳酸光学纯度更高,达到99.97%(ee),虽然在产酸速率上无明显优势,但其持续产酸能力较强,通过延长发酵周期,可获得较高的产量。屎肠球菌作为一种饲料中常用的益生菌,在畜牧生产中得到广泛的应用,目前有关屎肠球菌生产L-乳酸的报道很少,且产量和光学纯度均较低。屎肠球菌HA7-5的发酵特征与德氏乳杆菌HB49-2很相似,且具有光学纯度高99.93%(ee)、产量高和生长速率较快的特点,可作为替代的益生菌株应用于饲料中,亦可为乳酸生产提供具有潜在工业化应用价值的优良菌株。格氏乳杆菌产高光学纯度L-乳酸的研究亦鲜有报道。针对不同菌株的代谢特性,进一步改进发酵工艺条件,或通过诱变技术提高野生株的产量,为工业化生产提供高产量及高光学纯度的菌株。
3 结论
自然界中含有丰富的产乳酸菌株资源,鉴于国内外可用于生产高光学纯度L-乳酸和D-乳酸细菌较少,尤其是用于生产高光学纯度D-乳酸菌种资源的稀缺,从自然界获得目标菌株是一种有效途径。本研究依据乳酸菌的生长特性,探索了一条从不同地区土壤、不同腐烂果实和腌渍酸菜中快速筛选、分离具有产高光学纯度L体或D体乳酸菌株的方法,成功分离获得了4株产高光学纯度的乳酸菌株并进行了菌株鉴定。其中2株产L-乳酸菌株分别属于屎肠球菌(Enterococcusfaecium)HA7-5和格氏乳球菌(Lactococcusgarvieae)HJ57,所产L-乳酸光学纯度均达99.8%(ee)以上。另2株为产D-乳酸菌株,分别属于假肠膜明串株菌(Leuconostocpseudomesenteroides)HL64-1和德氏乳杆菌(Lactobacillusdelbrueckii)HB49-2,D-乳酸光学纯度亦达到99.8%(ee)以上。此外,假肠膜明串株菌HL64-1还具有产酸速率非常快的特点,其发酵周期仅24 h;德氏乳杆菌HB49-2菌株产酸较高,发酵72 h产酸达73.14 g/L。野生菌株通过培养基、发酵条件优化以及菌种改造或基因定向改造有望进一步提高产量,极具潜在的工业化应用价值。随着高光学纯度的L-乳酸、D-乳酸在PLA材料领域中的开发和应用,全球乳酸的需求量急剧增加。要满足工业上制备PLA所需高光学纯度的要求,筛选产高光学纯度L-乳酸、D-乳酸及提高产量至关重要。其中利用基因工程手段构建的基因工程菌是一种有效手段,基因工程菌大多具有光学纯度高的特点,但其培养营养条件较为苛刻,且底物利用范围比较窄,相对于野生菌株粗犷的发酵条件,目前还难以形成产业化的竞争优势。因此从自然界中筛选光学纯度高、产量高、发酵周期短及底物利用范围广的乳酸菌株,以期为工业化生产提供更多的优良菌株来源。