植物基咖啡起泡乳泡沫性质的研究
2024-04-22陈妍妍张彩猛孔祥珍李兴飞陈业明华欲飞
陈妍妍,张彩猛,孔祥珍,李兴飞,陈业明,华欲飞
(江南大学 食品学院,江苏 无锡,214122)
泡沫是很多常见食品和饮料的组成部分。气泡赋予了食品饮料诱人的质构和色泽,使产品富有新意并刺激消费欲望。食品泡沫有不同的形式,除了人们熟知的液态泡沫(例如啤酒、起泡酒、碳酸饮料、咖啡饮料等),还有半固体泡沫(例如冰淇淋、掼奶油、充气甜点等)和固体泡沫(例如面包、蛋糕、早餐谷物、充气巧克力棒等)[1]。
咖啡是世界三大饮料之一,其全球消费量逐年增长,呈现出良好的发展前景。与此同时,拿铁、卡布奇诺、摩卡等花式咖啡应运而生,吸引着更多消费者的关注[2]。卡布奇诺咖啡源自意大利,因在咖啡中加入了打发的牛奶泡沫而备受年轻消费者青睐。随着人们对健康饮食的追求和对环境问题的日益重视,植物蛋白乳顺应消费升级的需要,在消费量一直保持增长的同时,消费场景和消费方式也不断创新[3]。其中,以植物基咖啡起泡乳的增长最受瞩目。
咖啡专用起泡乳的起泡特性是制作卡布奇诺咖啡的关键环节之一。形成泡沫时,必要条件是存在蛋白质或其他表面活性剂以降低表面张力。此外,还需要以搅打的形式输入能量以克服表面自由能[4]。理想的泡沫应该具有均匀的尺寸、绵密的形态并能在饮用期间保持稳定。NEBERGROV等[5]研究了起泡酒的泡沫性质,发现泡沫的强度、数量与表面张力有关,特别是受蛋白质种类及含量的影响。此外,pH值、离子强度、热处理方式及发泡方法也对溶液的起泡性有较大影响[6]。泡沫属于典型的热力学不稳定体系,易发生排液、歧化和聚结等现象[7]。泡沫稳定性涉及3种不同的机制,分别是膜之间的分离压力(尤其是静电作用和空间排斥)、膜的弹性(马兰戈尼效应)和膜的流变特性[8]。虽然这些机制在物理方面有所不同,但在分子方面相互依存。陈玉峰等[9]基于气-液界面特性,探究了小分子表面活性剂以及蛋白质、多糖等大分子成分对泡沫稳定性的影响,同时发现合适的发泡技术能够得到尺寸形状理想且分散性好的泡沫,更有利于食品中泡沫的稳定。ZAKIDOU等[10]研究了牛奶、豆奶等5种市售产品的泡沫性质,并对相应的卡布奇诺咖啡进行了感官分析。研究表明,相比于牛奶,植物基咖啡起泡乳更适合在较高温度下饮用。
奶类咖啡起泡乳的研究已经有较多的报道,与此相比,对植物基咖啡起泡乳的研究则少得多,且主要集中在植物蛋白制品而不是植物基起泡乳本身的起泡性能[11]。从咖啡专用起泡乳的商品属性来说,植物蛋白乳的热稳定性以及与咖啡的风味相容性是需要首先考虑的因素。本研究通过预实验,在一系列植物蛋白原料中发现大豆、鹰嘴豆、燕麦3种原料具备开发咖啡专用起泡乳的潜力。在此基础上,制备了植物蛋白乳,考察了其泡沫性质及微观结构,探究了蛋白质、脂肪成分和泡沫膜析出液体动力学与泡沫稳定性的关系,为起泡性植物蛋白乳的进一步研发利用提供了理论依据。
1 材料与方法
1.1 材料与试剂
东北大豆、脱皮鹰嘴豆和燕麦米,市售;BAN 480 Lα-淀粉酶、AMG 300 L糖化酶,北京伊诺凯科技有限公司;高纯氮气(99%),无锡鑫锡仪气体有限公司;甲醇、正己烷、异丙醇为色谱纯,ThermoFisher 公司;其他常规试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
BLST4090B-073磨浆机,东莞汇勋电器制品有限公司;HHS恒温水浴锅,江苏省金坛市医疗仪器厂;Mongdio电动起泡器,湖州啡忆电子商务有限公司;K9840半自动凯氏定氮仪、手提式不锈钢压力蒸汽灭菌锅,济南海能仪器股份有限公司;ChemiDoc XRS+凝胶成像仪,美国Bio-Rad公司;MODELBE-210型垂直电泳仪,日本BIO CRAFT公司;Zetasizer nano ZS纳米粒度及Zeta电位仪,英国马尔文公司;HimacCR-21G型冷冻离心机,日本Hitachi公司;1525高效液相色谱仪,美国沃特世公司。
1.3 实验方法
1.3.1 豆乳的制备
大豆在25 ℃下浸泡12 h后磨浆,磨糊经过200目纱布过滤后,滤液在3 000×g离心10 min去除微渣,上清液在120 ℃加热20 min杀菌。
1.3.2 燕麦乳的制备
燕麦清洗后,在160 ℃下烘烤20 min,按料液比1∶3(g∶mL)加入去离子水,按0.35 mL/100 g燕麦加入α-淀粉酶,打浆。胶体磨处理10 min后,在80 ℃保温40 min。冷却至60 ℃,按0.35 mL/100 g燕麦加入糖化酶,60 ℃保温水解30 min。冷却后调节pH值至7.0,95 ℃加热15 min 灭酶。在3 000×g下离心10 min,上清液60 ℃、30 MPa 均质后,在120 ℃保温20 min杀菌。
1.3.3 鹰嘴豆乳的制备
称取脱皮鹰嘴豆,清洗后按料液比1∶5(g∶mL)加入去离子水,后续制备过程同燕麦乳。
1.3.4 起泡性与泡沫稳定性
准确量取一定体积调至pH 7.0的植物乳样品,加热至60 ℃,使用电动起泡器在12 000 r/min下搅打30 s,迅速将泡沫倒入500 mL量筒,记录泡沫总体积。室温下静置5 min和30 min时分别记录剩余泡沫总体积。起泡性和泡沫稳定性按照公式(1)~公式(3)计算:
起泡性/%=(V1-V0)/V0×100
(1)
泡沫稳定性5 min/%=V2/V1×100
(2)
泡沫稳定性30 min/%=V3/V1×100
(3)
式中:V0,液体体积,mL;V1,泡沫初始体积,mL;V2,静置5 min时泡沫体积,mL;V3,静置30 min时泡沫体积,mL。
1.3.5 流动性质
泡沫流动性是在参考ZOHEIDI等[12]实验方法基础上,根据实际情况设计的实验装置,包括漏斗、带循环水夹套的玻璃管(长度30 cm、内径1 cm)以及配备记录仪的电子天平。实验首先将玻璃管恒温至60 ℃,随后将等质量的植物蛋白乳按照1.3.4节的方法搅打起泡,通过漏斗倒入玻璃管,记录30 min内流出质量。
1.3.6 显微图像采集
使用光学显微镜对不同植物蛋白乳搅打后的泡沫进行观察。每个泡沫样品在室温下放置于载玻片上,在40×放大倍数下观察不同时间的微观结构,并使用IC capture 2.4软件捕获样品的泡沫图像。
1.3.7 图像分析
使用Cellpose软件对图像进行处理[13],识别泡沫中的气泡,将图像分割成气泡(空气相)和膜层(液相)。随后使用Image J中的“分析颗粒”工具对泡沫进行量化,得到泡沫平均直径。此外,通过膜层网络分析计算了泡沫液膜厚度(μm)。如图1所示,将泡沫液膜厚度定义为总液膜面积(μm2)(图1中的黑色面积)除以液膜网络的总长度(μm)(图1中的黄色线),以此量化泡沫液膜的平均厚度。

图1 泡沫液膜厚度计算示意图Fig.1 Schematic representation of mean lamella thickness calculation
1.3.8 基本成分测定
蛋白质含量测定:参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法。
脂肪含量测定:参考GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中的酸水解法。
灰分含量测定:参考GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》食品中总灰分的测定。
水分含量测定:参照GB 5009.3—2016《食品安全国家标准 食品中灰分的测定》中的直接干燥法。
1.3.9 粒径及ζ电位
样品的粒径及ζ电位采用纳米粒度及电位分析仪测定,将样品溶液稀释至固形物质量分数为0.02%,装入带有电极的DTS1070型比色皿中,测试温度为25 ℃,光散射角度为173°,每个样品测试3次。
1.3.10 SDS-PAGE
液体样品的SDS-PAGE分析采用LAEMMLI[14]的方法。分离胶质量分数为12.5%,浓缩胶质量分数为3%。将植物蛋白乳样品稀释至蛋白质质量浓度为2 mg/mL。取待测样品0.5 mL,加入等体积的样品溶解液,10 μL溴酚蓝指示剂以及20 μL二硫苏糖醇溶液,煮沸5 min。每个泳道上样10 μL,电泳条件为电压260 V,电流13 mA。电泳完成后,凝胶经固定、染色和脱色后,使用凝胶成像仪扫描图片并保存,采用Image Lab软件分析条带。
1.3.11 脂质成分及含量
脂质提取:称取20 g液体样品,加入100 mLV(氯仿)∶V(甲醇)=2∶1混合液,加入0.01%(质量分数)2,6-二叔丁基-4甲基苯酚溶液以防止提取过程中脂质的氧化。将混合物振荡后于4 ℃低温下搅拌提取2 h,然后8 500×g、4 ℃下离心20 min,收集氯仿层。重复提取1次,合并2次氯仿相,加入过量无水Na2SO4,N2干燥浓缩,得到脂质样品。
甘油三酯:参照晁红娟等[15]方法,使用Si-60色谱柱(250 nm×4.6 nm×5 μm),流动相:V(正己烷)∶V(异丙醇)∶V(乙酸)=15∶1∶0.003;柱温34 ℃;检测器示差折光检测器;流速1 mL/min;进样量20 μL。
磷脂酰胆碱和磷脂酰乙醇胺:参照2020年版《中国药典》中高效液相色谱测定方法,使用Si-60色谱柱,柱温40 ℃,流速1.0 mL/min;检测器为蒸发光检测器(漂移管温度72 ℃,载气流速2 L/min);进样量10 μL;流动相A为V(甲醇)∶V(水)∶V(冰醋酸)∶V(三乙胺)=85∶15∶0.45∶0.05,流动相B为V(正己烷)∶V(异丙醇)∶V(流动相A)=20∶48∶32。
1.3.12 数据处理
所有实验重复3次,使用Origin对数据进行绘图,通过SPSS 26软件对数据结果进行分析,结果用平均值±标准偏差表示。
2 结果与分析
2.1 不同植物蛋白乳的泡沫性质
2.1.1 植物蛋白乳的制备及成分
3种植物原料的组成各不相同,大豆中含有35%~40%的蛋白质,15%~20%的脂肪和25%~30%的碳水化合物,而鹰嘴豆和燕麦中含有60%左右的淀粉,蛋白质和脂肪含量均显著低于大豆。因此针对3种原料,采用不同的加工方式。大豆在磨浆、离心后进行加热,鹰嘴豆及燕麦打浆后,先使用淀粉酶和糖化酶进行2次酶解,再加热灭菌。料液比根据成品乳所需的2.5%(质量分数,下同)蛋白质含量确定,其余工艺条件通过预实验确定。
2.1.2 起泡性和泡沫稳定性
将豆乳、鹰嘴豆乳、燕麦乳的蛋白质含量均调整为2.5%后搅打起泡,测定起泡性及泡沫稳定性。如图2所示,豆乳具有最高的起泡性,鹰嘴豆乳次之,而燕麦乳起泡性明显低于前两者,三者分别为(245±2.88)%、(235±1.44)%和(215±2.88)%。泡沫稳定性的测定结果与起泡性规律正好相反,表现为燕麦乳泡沫稳定性最好,鹰嘴豆乳次之,豆乳泡沫稳定性最差。燕麦乳5 min时的泡沫稳定性高达99.0%,即打泡后在室温下静置5 min,燕麦乳泡沫几乎无液体析出。

图2 不同植物蛋白乳的起泡性及泡沫稳定性Fig.2 Foaming capacity and foaming stability of different plant protein milk
起泡性与泡沫稳定性产生差异的原因可能与3种植物乳的蛋白质种类、皂苷含量及固形物含量不同有关。大豆与鹰嘴豆均属豆类植物,两者的蛋白质主要为球蛋白,而燕麦中球蛋白含量仅有55%,还有20%左右的谷蛋白及其他蛋白。OSEMWOTA等[16]分离并比较了白蛋白、球蛋白和谷蛋白组分的结构及功能性质,发现中性pH值下球蛋白的起泡性显著高于谷蛋白。此外,豆类植物种子中皂苷含量一般在0.62%~6.16%(质量分数),而燕麦中皂苷含量仅有0.08%。皂苷中的苷元具有亲油性,而糖链具有亲水性,故皂苷是一种表面活性剂。由此推测,皂苷对豆乳和鹰嘴豆乳的起泡性起了一定作用,因为皂苷在气/液界面的吸附降低了表面张力,更容易产生气泡[17]。燕麦的蛋白质含量较低,仅有11.73%,而鹰嘴豆和大豆的蛋白质含量分别达到22.58%和35.98%。因此在蛋白质含量相同的情况下,豆乳中固形物含量仅有5.82%,燕麦乳的固形物含量则高达23.80%,有利于形成较稳定的泡沫。燕麦乳中除了蛋白质,还有大量淀粉酶解后产生的糖,能够提高层状流体的黏度,不利于起泡,但能减少泡沫中液体的排出从而提高其泡沫稳定性。另一方面,豆乳的脂肪含量较高,而脂肪不利于泡沫性能,可能是豆乳的泡沫稳定性较低的原因之一。
2.1.3 泡沫的流动性质
泡沫的流动性质对咖啡专用起泡乳的应用有重要影响。用于卡布奇诺咖啡的植物蛋白乳打泡后需具备良好的流动性,同时黏度适中,不易黏壁。本研究设计了由玻璃管、电子秤和计时器组成的装置以考察打泡后植物乳的流动性质。实验结果如图3所示。豆乳泡沫的初始流出速度最大,30%流出时间为0.13 min,鹰嘴豆乳泡沫次之,30%流出时间为0.37 min,而燕麦乳泡沫初始流出最慢,30%流出时间为0.61 min。另一方面,豆乳和鹰嘴豆乳泡沫的流速衰减较快,70%流出时间分别为1.92、1.88 min,而燕麦乳泡沫70%流出时间为1.22 min。实验同时反映了不同植物蛋白乳泡沫的黏壁情况。豆乳、鹰嘴豆乳和燕麦乳泡沫的流出曲线分别在15、12、2 min后趋于平坦。在30 min时,3种植物蛋白乳泡沫的流出质量百分比分别为82.75%、87.88%和94.50%,说明豆乳泡沫的黏壁情况最严重,而燕麦乳泡沫的黏壁最少。实验中可观察到,开始流出豆乳中液体较多,泡沫较少,因此能表现为较大的流出初速度,而剩余豆乳泡沫中液体较少,泡沫较轻薄,容易黏附在玻璃管壁上;反之,燕麦乳中液体不是单独流出,而是伴随泡沫均匀流下管壁。因此,在初始阶段燕麦乳泡沫流得相对较慢,但是由于泡沫较厚重,相对不容易黏附在玻璃管壁上,故达到平衡时的泡沫质量最大。

图3 不同植物蛋白乳泡沫的流动性质Fig.3 Rheological properties of different plant protein milk foam
2.1.4 泡沫结构
图4显示通过光学显微镜观察植物蛋白乳泡沫在5、15、30 min时的状态。总体而言,植物蛋白乳泡沫在5 min时最为规则和均匀,随着时间的推移,气泡平均尺寸逐渐变大,外观变得不规则。说明气泡随时间发生聚结和排液等不稳定现象,表现为气泡尺寸的增加和气泡数量的减少。具体来说,5 min时豆乳泡沫尺寸较为离散,而鹰嘴豆乳和燕麦乳的泡沫尺寸大小相对均匀。与此同时,豆乳泡沫尺寸从5 min到30 min的变化最为明显,而鹰嘴豆乳和燕麦乳泡沫在此时间段内尺寸变化相对较小。有研究表明均匀的气泡尺寸分布可以更好地稳定泡沫[18]。显微镜观察到的结果对应了前文测定的泡沫稳定性,验证了这一结论。

a-豆乳5 min泡沫;b-豆乳15 min泡沫;c-豆乳30 min泡沫;d-鹰嘴豆乳5 min泡沫;e-鹰嘴豆乳15 min泡沫;f-鹰嘴豆乳30 min泡沫;g-燕麦乳5 min泡沫;h-燕麦乳15 min泡沫;i-燕麦乳30 min泡沫图4 不同植物蛋白乳泡沫在不同时间的显微结构Fig.4 Microstructure of different plant protein milk foam at different times
2.1.5 泡沫尺寸及液膜厚度
理想的咖啡专用起泡乳泡沫应该具有均匀的尺寸和绵密的形态。此外,泡沫尺寸还与泡沫的聚结和排液等失稳过程有关。较大的气泡往往与较低的泡沫稳定性相关,泡沫尺寸越小,其稳定性越高。如图5-a所示,在任何时间,泡沫平均尺寸都按照豆乳>鹰嘴豆乳>燕麦乳规律排序,与3种植物蛋白乳泡沫稳定性排序正好相反。另一方面,随着时间的推移,所有植物蛋白乳泡沫的平均直径逐渐增大,导致不同样品间差距更大,不同植物蛋白乳泡沫尺寸随时间变化规律不相同。对于豆乳泡沫在5~15 min区间变化较小,而在15~30 min时间段内增加幅度更大,从106.75 μm增加至128.34 μm。反之,燕麦乳泡沫平均尺寸在5~15 min区间变化较明显而在15~30 min区间则基本保持恒定。鹰嘴豆乳泡沫尺寸则在整个时间段内大致以相同的速度变化。

a-泡沫平均直径;b-泡沫液膜厚度图5 不同植物蛋白乳泡沫的泡沫平均直径及液膜厚度Fig.5 Average foam diameters and foam film thicknesses of different plant protein milk
如图5-b所示,豆乳泡沫的液膜厚度最小,而鹰嘴豆乳和燕麦乳泡沫的液膜厚度依次增大。与此同时,豆乳泡沫的液膜厚度随时间变薄最明显,而鹰嘴豆乳和燕麦乳泡沫液膜厚度的变化相对较小。这一结果说明豆乳泡沫液膜的失水速率更大,导致其泡沫稳定性较低。燕麦乳具有较高的黏度和固形物含量,从而在搅打时产生液膜较厚的气泡,并且能够减缓液膜失水而变薄。
2.2 植物乳泡沫气液界面吸附组分
2.2.1 蛋白质组分
植物乳打泡并静置30 min,尽量排出液体后收集液膜。3种植物乳打泡前原液蛋白质含量均为2.50%,30 min后泡沫液膜上的蛋白质含量分别为(2.60±0.01)%、(2.67±0.02)%、(2.77±0.01)%,界面蛋白吸附率分别为104.00%、106.80%和110.80%,说明蛋白质在液膜上产生了富集。此外,鹰嘴豆和燕麦蛋白在液膜上的富集程度更大,这可能与这2种蛋白质的疏水性较高有关。通过电泳分析植物乳及其泡沫液膜的蛋白质成分,进一步了解不同蛋白质组分对起泡性的贡献(图6)。大豆蛋白的主要成分为分子质量为50~75 kDa 的7Sα′、α和β亚基以及分子质量为17~35 kDa的11S A肽链和B肽链。鹰嘴豆蛋白主要包括vicilin(30~50 kDa、~19 kDa)以及leguminα和β(20~35 kDa)。燕麦蛋白的主要成分包括分子质量为50~75 kDa的7S球蛋白以及分子质量为20~35 kDa的12S A肽链和B肽链。通过对比可以发现,植物乳原液和泡沫液膜上的蛋白质成分相似,说明不同蛋白质组分在起泡性方面不存在根本性的区别。进一步对比可以发现,豆乳原浆大分子质量蛋白质聚集体含量较高,而在泡沫液膜中,B肽链条带含量则更高。在豆乳加热过程中,大豆蛋白发生一系列亚基解离和聚集反应,其中11S大豆球蛋白将通过SH/S—S交换形成大分子聚集体和游离的A和B肽链[19]。YU等[20]报道大豆11S蛋白所形成的泡沫比7S泡沫有更好的流变性和保水性,并推测7S在气-液界面的吸附量较低,而11S有利于在气-液界面形成黏性多层蛋白质网络。在本研究中植物乳经过加热处理,而他们采用的是未加热处理的蛋白质可能是结果不同的原因。事实上,包括大豆蛋白在内的植物蛋白在加热过程中将发生剧烈的亚基解离-聚集(聚合)作用[21],生成产物包括游离的亚基或肽链以及高分子质量蛋白质聚集体。因此,加热处理后不同蛋白质组分已经结合在一起而无法单独参与起泡作用。进一步比较可以发现,豆乳泡沫中11S蛋白B肽链的含量高于豆乳原液。同样地,鹰嘴豆乳泡沫中的legumin蛋白β亚基和燕麦乳泡沫中的12S蛋白β亚基都高于相应原液。由于这3种蛋白质亚基具有相似的分子结构和性质,即较小的分子质量和相对较高的疏水性,因而更容易吸附于气-液界面。

1-豆乳原液;2-豆乳泡沫膜;3-鹰嘴豆乳原液;4-鹰嘴豆乳泡沫膜;5-燕麦乳原液;6-燕麦乳泡沫膜图6 还原SDS-PAGE图Fig.6 Reducing SDS-PAGE patterns
2.2.2 脂质组分
由于鹰嘴豆乳和燕麦乳脂质含量较低,因此本文只考察了豆乳及其泡沫的脂质组分分布情况。豆乳中脂质含量为(1.71±0.03)%,泡沫液膜的脂质含量只有(1.54±0.02)%,低于体系的平均脂质含量。此外,豆乳、鹰嘴豆乳、燕麦乳的界面吸附蛋白/脂肪比率分别为115.78%、121.59%、136.05%,由此可见,脂质与蛋白质表现出不同的气-液界面吸附特征。蛋白质在界面上的表面过剩量>0,为正吸附,而脂质在气-液界面的表面过剩量<0,为负吸附。根据Gibbs吸附理论,正吸附降低界面张力,有利于起泡,而负吸附则升高界面张力,不利于起泡[22]。为了进一步考察液膜吸附脂质的特征,采用薄层色谱法(thin-layer chromatography,TLC)对豆乳总脂质进行分离并分别定量,结果如表1所示。可以发现甘油三酯(triglyceride,TG)是总脂质的主要成分,其余为磷脂酰胆碱(phosphatidylcholine,PC)和磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)。在豆乳原液中,TG占总脂质的82.35%,PC、PE的占比分别为7.50%和5.17%,而泡沫液膜中,TG占比下降为80.56%,PC、PE的占比则分别上升至8.91%和6.59%。这一结果说明,豆乳打发起泡时,极性较大的磷脂优先于中性的甘油三酯吸附到气-液界面上。从分子结构来看,磷脂具有一定的表面活性,因此比中性的TG具有更强的表面亲和性,从而导致表面吸附脂质中磷脂的比例更大。另外,极性脂质更容易与蛋白质结合,因此有可能随着蛋白质一同吸附到气-液界面上[23]。

表1 豆乳原液及泡沫液膜上不同脂质成分含量 单位:%Table 1 Contents of different lipid components on soy milk and its foam film
2.2.3 液膜粒径及ζ电位
比较原液和泡沫液膜的平均粒径及电位,如表2所示。不同植物乳泡沫液膜的粒径均小于原液,可能是因为液膜上小分子蛋白质含量相对较高,整体粒径较小。另外,3种植物乳泡沫液膜的电位绝对值均高于原液的电位绝对值,猜测与液膜上吸附的磷脂比例较大有关,因此泡沫稳定后液膜所带的净电荷高于原液。

表2 不同植物乳原液及泡沫液膜的粒径及ζ电位Table 2 Particle size and Zeta potential of different plant milk and foam liquid films
2.3 植物乳泡沫排液的动力学
2.3.1 泡沫液体排出曲线
液态泡沫是大量气体被相对少量液膜所包裹的气液分散体系,其失稳机理包括泡沫排液、泡沫歧化和泡沫聚结[7]。3种机制相互关联,使得液态泡沫表现出随时间不断变化的不稳定特性。其中,由重力驱使的泡沫排液无法避免,是影响泡沫稳定性的主导机制。
图7显示植物乳泡沫液体排出质量随时间变化。可以发现前期豆乳泡沫排液速率最快,燕麦乳泡沫排液速率最慢。豆乳泡沫排液集中在前5 min内,随后排液速率降低,但是即使在30 min仍有液体排出。这说明初始泡沫液膜中水分含量较高,而保持水分的能力较差,在重力作用下快速流出。燕麦乳泡沫的排液速率低得多,但是在前10 min内流出速度基本不变,随后排液速率缓慢降低,但后期燕麦乳泡沫排液速率高于豆乳排液速率。鹰嘴豆乳泡沫的排液特性介于豆乳和燕麦乳泡沫之间。泡沫排液初期重力作为主导因素,后期由于多个泡沫包围的三角区域处压力小于液膜压力,液体会从液膜向三角区域流失,液膜逐渐变薄直至两气泡相触破裂或歧化[24]。这种来自三角区域的吸力与气泡的曲率半径呈反比,燕麦乳泡沫平均尺寸最小,曲率半径小,则三角区域吸力大,排液速度快。因此后期燕麦乳泡沫排液速率高于另两者。
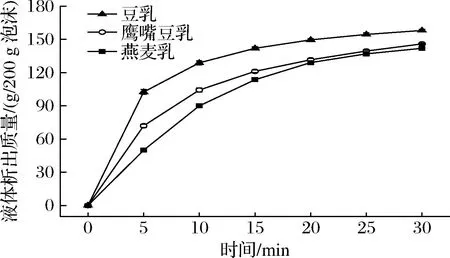
图7 不同植物乳泡沫液体排出曲线Fig.7 Foaming liquid discharge curves of different plant protein milk
2.3.2 固形物、蛋白质、脂质排出曲线
泡沫排液不仅导致液膜中水分的流失,其他成分也一同损失。由图8-a可知,燕麦乳泡沫的固形物流失质量最大,豆乳最小。在最初5 min,不同植物乳泡沫的固形物流失速率相差不大,说明燕麦乳泡沫排出液体的固形物含量远远高于豆乳和鹰嘴豆乳泡沫,与3种植物乳原液的固形物含量相对应。在排液后期,随着豆乳和鹰嘴豆乳泡沫排液速率明显降低,两者与燕麦乳泡沫在固形物排出质量方面的差距更加明显。30 min时,3种植物乳泡沫的固形物析出质量占原液中总固形物质量的79.57%、77.58%和74.62%。表明虽然燕麦乳泡沫的固形物排出质量显著多于豆乳和鹰嘴豆乳,但最终燕麦乳液膜依旧保留了较多的固形物,因此液膜厚度最大。

a-固形物;b-蛋白质;c-脂肪图8 不同植物乳泡沫固形物、蛋白质、脂肪排出曲线Fig.8 Different plant protein milk foam solids, protein and fat excretion curves
由图8-b可知,植物乳泡沫的蛋白质排出曲线与泡沫排液规律相似。豆乳泡沫的蛋白质流失质量最大,燕麦乳最小。不同植物乳原液蛋白质含量相同,初期豆乳泡沫的蛋白质流失速率最高,鹰嘴豆乳次之,燕麦乳最低,5 min内三者分别排出原液50.86%、36.69%和18.14%的蛋白质。这是因为初期豆乳泡沫排液速率高于鹰嘴豆乳和燕麦乳,蛋白质成分随液体一同析出液膜。随着植物乳泡沫排液速率的降低,蛋白质排出曲线趋于平缓。由于后期燕麦乳泡沫排液速率高于另两者,故30 min时不同植物乳泡沫的蛋白质排出质量逐渐接近,均占原液蛋白质质量的75%左右。
豆乳原液中脂肪含量相对较高,为(1.71±0.03)%,鹰嘴豆乳和燕麦乳仅有0.60%左右,如图8-c所示,豆乳脂肪排出质量显著高于另两者。初期豆乳脂肪流失速率较高,前5 min便已排出原液52.76%的脂肪。鹰嘴豆乳和燕麦乳泡沫的脂肪排出曲线相近,但相比燕麦乳,鹰嘴豆乳泡沫更早达到平衡。最终不同植物乳泡沫的脂肪排出质量占原液脂肪质量的差距不大,为75%~79%。
3 结论
研究发现不同植物乳的起泡性为豆乳>鹰嘴豆乳>燕麦乳;泡沫稳定性为燕麦乳>鹰嘴豆乳>豆乳;泡沫的初始流动速度及黏壁性为豆乳>鹰嘴豆乳>燕麦乳;泡沫平均直径为豆乳>鹰嘴豆乳>燕麦乳;泡沫液膜厚度为燕麦乳>鹰嘴豆乳>豆乳。不同植物乳的蛋白质均在液膜上产生了富集,豆乳泡沫中11S蛋白B肽链、鹰嘴豆乳泡沫中的legumin蛋白β亚基和燕麦乳泡沫中的12S蛋白β亚基含量均高于相应原液。豆乳泡沫液膜的脂肪含量低于原液,磷脂比甘油三酯更易吸附到气-液界面上。不同植物乳的液膜粒径均低于原液,ζ电位绝对值均高于原液。泡沫初期排液速率为豆乳>鹰嘴豆乳>燕麦乳;泡沫的固形物排出质量为燕麦乳>鹰嘴豆乳>豆乳;蛋白质及脂肪排出质量为豆乳>鹰嘴豆乳>燕麦乳。这些发现为起泡性植物蛋白乳作为卡布奇诺咖啡专用起泡乳的进一步研发利用提供了理论依据。