电针对高脂诱导肥胖小鼠肠道菌群的影响
2024-04-22秦鸿宇杨添淞孙忠人冯楚文王玉琳
秦鸿宇,杨添淞,巴 特,孙忠人,冯楚文,张 淼,王玉琳△
1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;3.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001
肥胖(Obesity)是现代常见的慢性代谢性疾病,其为一种由多种原因引起的疾病,特征是体内脂肪含量高,能并发多种疾病。2020年发布的《中国居民营养与慢性病状况报告》指出,中国18岁以上的成年人的超重率和肥胖率分别达到34.3%、16.4%[1]。肥胖与众多慢性疾病有因果关系,其潜在的健康威胁很难估计,甚至被列为仅次于烟草和艾滋病的第三大健康杀手。肥胖已经严重影响人体的身心健康和生活质量。因此,预防和控制肥胖是21世纪世界各国共同面临的重大公共卫生问题。
肥胖发病机制尚未完全明确,随着人们对肠道菌群的认识加深,多种证据表明肠道微生态失调在肥胖和其他代谢性综合征中起到关键作用。肠道菌群是一个复杂且多样的肠道微生物系统。肠道菌群在人们出生后立刻达到一定较高的数量[2],并且随着时间不断的发展变化[3]。肠道菌群与宿主始终保持着互惠共生的关系[4-5]。有研究发现,肥胖之人肠道微生物的组成较正常人发生了巨大的改变。肠道微生物的种类和物种的比例与肥胖的发生密切相关。肠道菌群可以通过宿主与饮食之间的相互作用来调节免疫防御和能量代谢。本研究利用16S rRNA高通量测序技术,探究电针对肥胖小鼠的治疗作用及肠道菌群机制的影响。为电针治疗肥胖提供可靠的科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 50只SPF级8周龄雄性C57BL/6J小鼠,购自辽宁长生生物技术有限公司,许可证号:SCXK(辽)2015-0001。本实验经黑龙江中医药大学实验动物使用与管理委员会批准(审批号:2019071502)。
1.1.2 主要试剂 4%多聚甲醛(武汉卡诺斯科技有限公司);苏木精-伊红(HE)染色试剂盒(北京索莱宝生物科技有限公司);E.Z.N.A. Stool DNA Kit(Omega);Premix Taq(EX Taq Version 2.0 plus dye,TaKaRa);Phusion超保真DNA聚合酶(NEB公司);琼脂糖(浩玛生物);DL2000 DNA Marker(TaKaRa);DNA凝胶回收试剂盒(AxyPrepDNA)(AXYGEN公司);Tris HCl(南京翼飞雪生物科技有限公司)。
1.1.3 主要仪器 一次性无菌针灸针(0.25 mm×13 mm,苏州环球针灸医疗器械有限公司);G6805-2型电针仪(上海华谊医用仪器有限公司);电子天平(德国Eppendorf公司);-80 ℃冰箱(MDF-382E,Panasonic);全自动生化分析仪(日立高科技贸易上海有限公司);超薄切片仪(德国LEICA公司);Leica显微镜(德国LEICA公司);超速冷冻离心机(H-2050R,湖南湘仪);微型离心机(北京六一),Baygene;电泳仪(北京六一);凝胶成像系统(北京六一);PCR仪(9700型,美国ABI公司);测序仪(美国Illumina公司)。
1.2 方法
1.2.1 模型制备与分组 50只C57BL/6J小鼠饲养于黑龙江中医药大学药物安全性评价中心,适应性喂养1周,自由进食饮水,12 h明暗周期、室温20~24 ℃,相对湿度40%~60%。1周后,随机筛选12只为空白组,饲以正常饮食,剩余38只饲以高脂饮食(高脂饲料购于派克生物技术有限公司)。高脂饲料配方详见表1。饲养16周后,以高脂饮食小鼠体质量超过空白组平均体质量20%视为造模成功。造模成功率为63.2%,将造模成功的小鼠按随机数字表法随机分为模型组12只和电针组12只。

表1 高脂饲料配方 (%)
1.2.2 实验干预方法 空白组:12只小鼠予正常饮食饲养,每天均要抓取并固定10 min,确保和电针组的小鼠饲养条件相同;模型组:12只小鼠予高脂饮食饲养,每天均要抓取并固定10 min,确保和电针组的小鼠饲养条件相同;电针组:12只小鼠予高脂饮食饲养,操作方法:将电针组小鼠进行捆绑并呈仰卧位固定在实验板面上,用75%的消毒酒精对针刺穴位进行严格的消毒后,用0.22 mm×5 mm的毫针进行针刺治疗,中脘穴:斜刺2 mm;天枢穴:直刺2 mm;足三里穴:直刺3 mm;三阴交穴:直刺1.5 mm。双侧天枢穴连接G6805-2型电针仪,频率设置为30 Hz,强度调节为2~3 mA,采用疏密波,以针刺局部轻微抖动为度,每次留针10 min。1次/d,连续治疗4周。
1.2.3 实验样本采集 实验期间每周相同的时间用电子称量并记录每只小鼠的体质量。实验结束后,所有小鼠禁食12 h,称体质量。腹腔注射4%水合氯醛水溶液(10 mL/kg)麻醉小鼠。待小鼠完全麻醉用镊子摘取小鼠眼球取血,取血后静置1 h,用离心机离心,取血清。处死小鼠解剖后,剥离小鼠附睾脂肪组织,用生理盐水进行冲洗,使用滤纸吸干水分后,进行称重并记录。并用4%多聚甲醛将组织进行固定。小鼠治疗结束后用无菌棉签轻轻按摩小鼠腹部促进其排便,用2 mL进口无菌冻存管收集粪便,每只小鼠接取约8粒粪便,暂时放入液氮中,等收集完样本后放入-80 ℃冰箱保存,等待肠道菌群测序,1只小鼠未收集到粪便,故肠道测序共收集到35个样本。
1.2.4 检测血清脂质水平 取各组血清样本,采用全自动生化分析仪测定各组小鼠血清中总胆固醇(Total cholesterol,TC)、甘油三酯(Triglycerides,TG)以及低密度脂蛋白(Low density lipoprotein cholesterol,LDL)的含量。
1.2.5 HE染色 将固定好附睾脂肪组织,在50%、75%和95%的乙醇中进行梯度脱水;脱水后浸泡在二甲苯中,直至变得透明,然后进行石蜡包埋并切5 μm厚的片段;切片后的样本进行脱蜡;脱蜡后将切片放入苏木素染液中浸泡10 min,然后洗掉多余染料,于1%盐酸酒精溶液中泡5 s,冲洗10 min后,去离子水洗2 min,最后把切片浸泡在伊红染液中2 min;标本再进行梯度脱水并用二甲苯浸泡至透明;用中性树胶封片;在光学显微镜镜下观察小鼠肝脏和附睾脂肪组织的形态变化。
1.2.6 16S rRNA高通量测序 经基因组DNA抽提、PCR扩增、荧光定量、文库构建和Illumina PE250测序,通过Illumina PE250测序,能够按照overlap关系对PE reads加以拼接,并对序列质量加以质控和筛选,以确保样品的准确性。同时,通过对样本开展OTU聚类分析以及物种分类分析,以获得多种多样性指数和测序深度检测结果,而且能够在不同分类水平上对群落结构开展统计分析。本研究使用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析。

2 结果
2.1 电针对各组小鼠体质量的影响
观察各组小鼠治疗前后的体质量。治疗前,与空白组比较,模型组和电针组小鼠体质量均显著升高(P<0.01)。治疗结束后,空白组小鼠的体质量无明显变化;与空白组比较,模型组小鼠体质量上升明显(P<0.01);电针组小鼠体质量呈下降趋势,且与模型组相比较,治疗后电针组小鼠体质量明显低于模型组,差异具有统计学意义(P<0.01),但电针组仍高于空白组。结果表明:电针能降低高脂饮食诱导的肥胖小鼠的体质量。见表2。
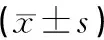
表2 电针治疗前后各组小鼠体质量比较
2.2 电针对各组小鼠附睾脂肪重量的影响
治疗结束后,称取3组小鼠的附睾脂肪重量发现,与空白组比较,模型组小鼠附睾脂肪量明显升高,差异具有统计学意义(P<0.01);与模型组比较,电针组小鼠附睾脂肪量显著降低,差异具有统计学意义(P<0.01)。该研究结果表明,电针可以明显降低高脂饮食诱导的肥胖小鼠体内的脂肪含量。见表3。
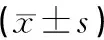
表3 电针治疗后各组小鼠附睾脂肪重量比较
2.3 电针对各组小鼠血脂的影响
检测小鼠血清TC、TG及LDL水平,严格按照试剂盒说明进行检测。结果显示:与空白组比较,模型组的总胆固醇、甘油三酯和低密度脂蛋白水平的血清浓度增高(P<0.01);与模型组比较,电针组总胆固醇、甘油三酯和低密度脂蛋白水平明显降低(P<0.01)。见表4。
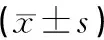
表4 电针治疗前后各组小鼠血脂的比较
2.4 HE染色观察附睾白色脂肪
通过HE染色观察3组小鼠的附睾脂肪组织形态的变化,与空白组比较,模型组肥胖小鼠的脂肪细胞体积明显增大,脂肪细胞壁较薄,细胞间隙变大。与模型组比较,电针组小鼠的脂肪细胞体积明显缩小,与空白组更加接近,细胞间隙变小。该研究结果说明电针可以明显减少高脂饮食诱导的肥胖小鼠脂肪的含量。见图1。
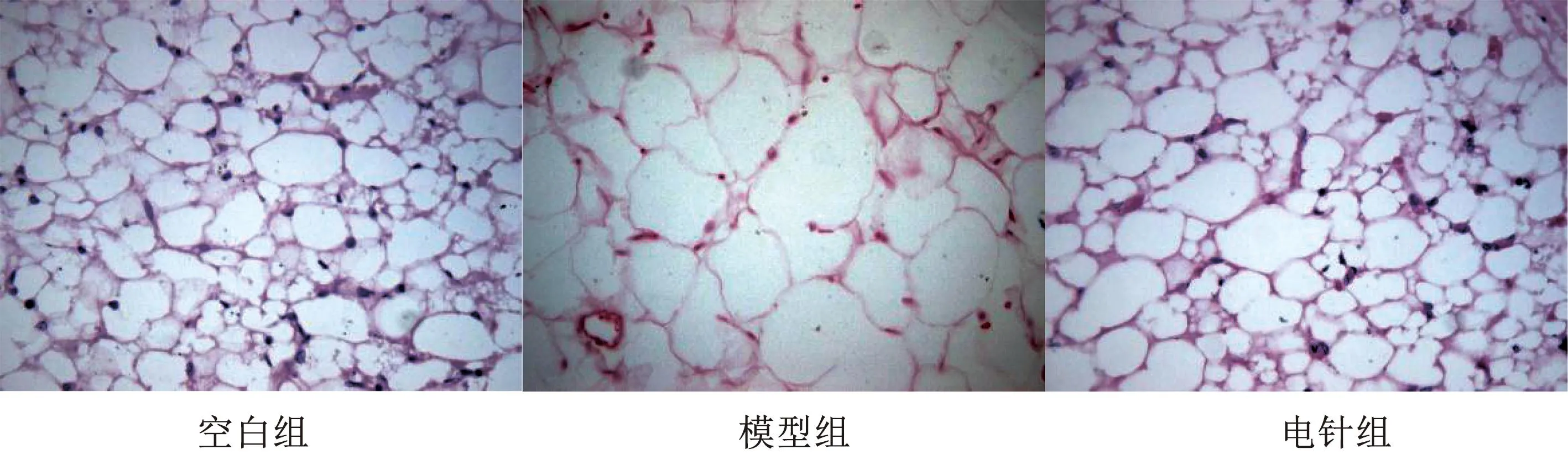
图1 各组小鼠附睾白色脂肪组织形态(HE 染色,200×)
2.5 测序深度和样本多样性分析
如图2-A所示,随着测序数据量的增加,观测到的OTU数量也呈现出上升趋势,但3组曲线逐渐变得平缓,这表明测序数据量合理,如图2-B所示,Shannon-Wiener指数随着测序数据量的增加而迅速达到稳定,表明测序数据量充足,能够显示出样本中大部分的微生物信息。Rank-abundance曲线用来解释物种丰度和物种均匀度。如图2-C所示,曲线的宽度能够显示出物种的丰度,丰度越高代表水平轴上的曲线范围也就越大;曲线的平滑程度显示了样本中物种的均匀度,曲线越平滑代表物种的分布也就越均匀。Specaccum物种累积曲线能够用来判断样本量是否充足,也能够用来估计物种的丰度。如图2-D所示,随着样本量增加,可测到的OTU数量也会显著上升,但当样本量超过20时,曲线已变得平缓。说明该实验的样本量足够大,能够满足持续抽样的要求,从而可以进行数据分析。

注:A.各组小鼠肠道菌群样品的稀释性曲线;B.Shannon-Wiener曲线;C.Rank-abundance曲线;D.Specaccum物种累积曲线。图2 测序深度和样本多样性分析
2.6 OTU分布Venn图
根据物种注释结果绘制Venn图,利用不同的颜色和数字表示3组样本间共有的和独有的OTU数量。空白组、模型组与电针组的OTU数量分别为3 055个、1 790个和2 478个。结果中可以明显地看出空白组的OTU数量远远超过模型组,说明高脂饮食显著改变了小鼠的肠道菌群,降低了小鼠肠道菌群的物种多样性。电针治疗后,小鼠的肠道菌群多样性明显提高,但仍低于空白组。由此说明,电针治疗可以有效改善肥胖小鼠的肠道微环境。见图3。
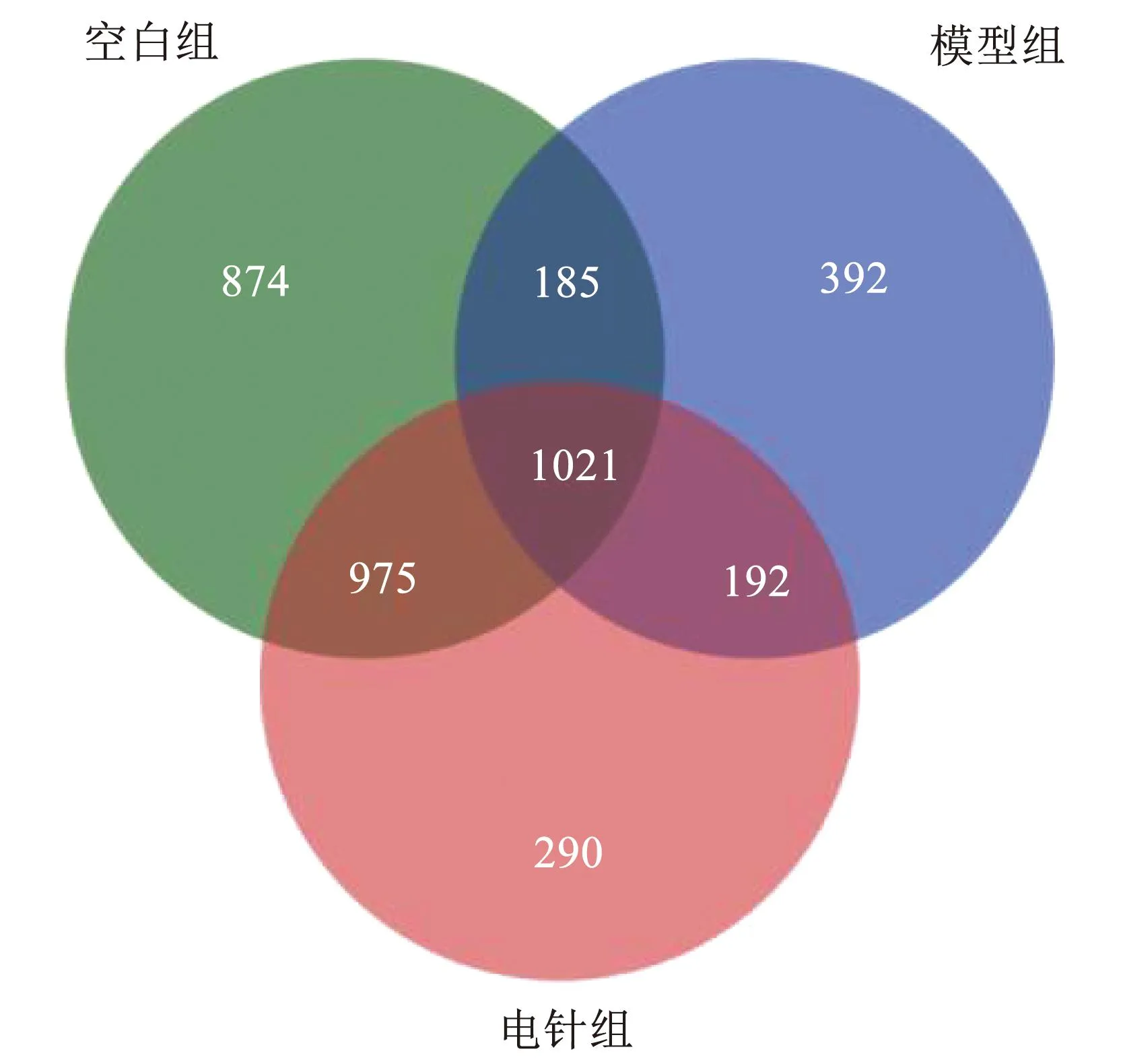
图3 各组OUT分布的Venn图
2.7 群落结构组分图
如图4所示,在门分类水平上,3组小鼠主要由拟杆菌门(Bacteriodetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、弯曲杆菌门(Epsilonbacteraeota)、脱铁杆菌门(Deferribacteres)、髌骨细菌门(Patescibacteria)与疣微菌门(Verrucomicrobia)等组成,其中拟杆菌门和厚壁菌门的相对丰度比较高。
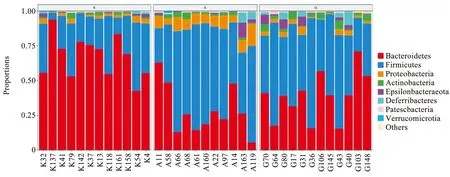
注:K代表空白对照组,A代表模型组,G代表电针组。图4 门水平多样本柱状图
研究结果显示,空白组小鼠肠道菌群以拟杆菌门为主(占比为67.33%),厚壁菌门次之(占比为27.43%)。模型组小鼠肠道菌群则以厚壁菌门为主(占比为57.30%),而拟杆菌门丰度减少(占比为28.60%)。与模型组比较,电针组小鼠肠道菌群的拟杆菌门丰度增加(占比为38.73%),而厚壁菌门丰度减少(占比为50.20%)。在这3组中,空白组小鼠厚壁菌门丰度最低,模型组比空白组小鼠的厚壁菌门丰度显著升高,电针组比模型组降低。空白组小鼠拟杆菌门是丰度最高,模型组与空白组比较,拟杆菌门丰度显著下降,电针组比模型组上升。为了评估厚壁菌门和拟杆菌门在治疗肥胖中的作用,本研究计算了两者的比值。厚壁菌门/拟杆菌门(F/B)这一比值因高脂饮食而升高,空白组F/B比值为0.41,模型组F/B比值为2,电针组F/B比值为1.3。说明电针对降低厚壁菌门比例及提高拟杆菌门比例有显著的效果。
如图5所示,在属分类水平上,空白组中Muriba-culaceae_norank占比最高(54.04%),其次为乳酸杆菌属(Lactobacillus)(6.96%)、毛螺菌科NK4A136(Lachnospiraceae NK4A136 group)(5.71%)、拟普雷沃氏菌属(Alloprevotella)(5.57%)、毛螺菌科未培养属(Lachnospiraceae_uncultured)(3.27%)、普雷沃菌科UCG-001(Prevotellaceae UCG-001)(1.72%)、瘤胃球菌未培养属(Ruminococcaceae_uncultured)(1.65%)、拟杆菌属(Bacteroides)(1.23%)、另枝菌属(Alistipes)(1.05%)与脱硫弧菌科未培养属(Desulfovibrionaceae_uncultured)(0.97%)等。在模型组中,属水平上丰度最高的菌为Muribaculaceae_norank(12.65%)。其次为乳酸杆菌属(8.59%)、罗氏菌属(Roseburia)(8.16%)、毛螺菌科未培养属(7.54%)、脱硫弧菌科未培养属(7.20%)、Odoribacter(6.06%)、毛螺菌科NK4A136(4.57%)、瘤胃梭菌9(Ruminiclostridium 9)(4.41%)、瘤胃梭菌(4.12%)与瘤胃球菌未培养属(3.89%)等。在电针组中,属水平上丰度最高的菌为Muribaculaceae_norank(30.74%)。其次为乳酸杆菌属(27.03%)、毛螺菌科NK4A136(4.18%)、粪杆菌(3.84%)、瘤胃球菌 UCG-014(2.71%)、拟普雷沃氏菌属(2.47%)、螺杆菌属(2.46%)、双歧杆菌属(1.92%)、Mucispirillum(1.91%)与瘤胃球菌未培养属(1.60%)等。

注:K代表空白对照组,A代表模型组,G代表电针组。图5 属水平多样本柱状图
由上述结果从属水平来看,空白组中主要菌群为拟杆菌门的Muribaculaceae_norank,占比达到54.04%,而模型组中Muribaculaceae _norank占比显著下降(12.65%),电针干预后,Muribaculaceae_norank占比明显上升(30.74%)。结果说明电针干预后肠道菌群发生了明显的变化。
3 讨论
根据中医理论,肥胖属于“脏腑病”的范畴,病位多责之于脾胃,故而肥胖的辨证多为脾胃相关的证候。人的生命活动深受气机升降转化的影响,脾胃直接参与了气的生成和气化的过程。脾主运化,位居中焦,为后天之本,是津液输布的枢纽,脾胃功能正常,机体才能得到后天的水谷精气充养而正常劳作生息,若脾气虚弱,就会失去其“游溢精气”“散精”功能,不能运输和布散水谷精微及运化水湿,导致湿浊内生形成痰,痰湿积聚在机体内,进而形成肥胖。《河间六书·湿类》也论述了胖人多湿,进一步说明了脾虚生湿与肥胖之间的关系。故而针灸减肥多以脾胃经腧穴为主。
本研究选取天枢穴(双侧)、足三里(双侧)与三阴交(双侧)。天枢穴是足阳明胃经腧穴,是大肠募穴,主通调肠腑、理气行滞。可调节胃肠道功能,调畅气机,有促进新陈代谢等作用。针刺天枢穴亦能够促进肠道的运动,帮助分解腹部的脂肪。有研究表明,天枢穴进行埋线治疗能够有效的减轻体质量与体脂,增强胰岛素的生理效应,改善肥胖患者胰岛素抵抗,具有显著的降脂、减脂的作用,对于防治肥胖及其并发症有较好的临床效果[6]。足三里属于胃经腧穴,胃经合穴、胃经下合穴,治疗脾胃疾病常选用足三里穴。肥胖之人的脾胃功能紊乱,足三里有健脾和胃、利湿化痰的功效。针刺该穴能够调节脾胃的功能,使饥饿中枢兴奋性大大降低,从而降低患者的食欲并促进肠道运动,达到减肥的目的。三阴交穴属于足太阴脾经,也是脾经、肾经与肝经的交会穴,一穴通三经,三经连三脏。脾的升清功能与肝主疏泄的关系密切相关,肾主封藏、司二便,与新陈代谢密切相关。因此,针刺天枢、足三里与三阴交穴,共同作用,起到了调理气血、调畅气机、健脾和胃与祛湿化痰等减肥的作用。
尽管之前的研究结果已经证实电针可以改善单纯性肥胖[7-8]。但确切的作用机制尚未完全清楚。随着研究的深入,越来越多的证据指出肠道菌群在肥胖、胰岛素抵抗等代谢性疾患的发生和发展中起到至关重要的作用[9-10]。肠道微生物群的组成与肥胖发生之间的密切相关。人类肠道中拥有1 000多种细菌,细胞总数达1013~1014[11]。人体的肠道中蕴含着丰富的微生物,其中拟杆菌门、厚壁菌门和放线菌门数量最为丰富,它们共占肠道微生物群落的约90%。其中,主要门类的厚壁菌门(Firmicutes)/拟杆菌门(Bacteroidetes)的增加比率和变化可以促进肥胖小鼠膳食和遗传模型的肥胖发展[12-13]。Ley等[14]首先证实了肥胖与肠道菌群相联系,肥胖小鼠与瘦小鼠比较,肥胖小鼠肠道菌群中的拟杆菌门少、厚壁菌门多。Turnbaugh 等[12]计算了肥胖小鼠和非肥胖小鼠中的9个细菌门类的相对丰度,结果发现与正常小鼠相比较,肥胖小鼠的拟杆菌门/厚壁菌门比例较低。同时,还对多形拟杆菌和直肠真杆菌的基因组进行了对比,进一步证明了肥胖小鼠的肠道菌群中厚壁菌门的丰度较高。拟杆菌和真杆菌分别代表了拟杆菌门和厚壁菌门。正常小鼠盲肠中真杆菌与拟杆菌的同源染色体序列的比值为1.5,而肥胖小鼠中二者的比值高达7.3,更能够证明厚壁菌门与拟杆菌门的比例与肥胖的关系。肠道菌群通过增加小肠绒毛毛细血管的密度,影响肠道生理和运动,从而影响肠上皮的发育,进而促进饮食中的热量摄取[15]。针灸可以改变肠道微生物的种类和数量,并且具有良性调节肠道微生态平衡的作用,研究发现[16],针灸可以增加肠道菌群的多样性和有益菌的数量,减少有害菌的数量,维持肠道微生物的平衡,针刺可以通过脑-肠轴来调节肠道菌群。脑-肠轴是大脑通过中枢神经系统、肠神经系统等与肠道形成的双向交通的神经-内分泌-免疫网络系统。肠道菌群通过脑-肠轴介导的神经递质与免疫信息等,参与肠道功能的调节。针刺可以通过介导脑-肠轴的各个环节实现调节肠道菌群的作用。脑肠肽存在于脑肠中,是一种神经活性肽,广泛参与肠道运动、神经递质与免疫因子的分泌和调节。针刺可以激活和释放脑肠肽,从而达到调控胃肠运动和肠道菌群的目的,起到减肥的作用。
本实验研究利用16S rDNA测序技术对空白组、模型组与电针组小鼠粪便样本进行了分析。发现由于高脂饮食的摄入,引起小鼠肠道菌群结构和功能改变,通过电针进行干预后,肥胖小鼠肠道菌群紊乱得到一定程度的恢复。因此,可以推测,电针可以通过调节肠道菌群的结构和功能从而减少肥胖小鼠体质量。但本研究样本量较小,电针治疗的时间有限,仍需进一步大样本量的实验研究,完善实验方案的相关观察指标,更好地为临床治疗肥胖提供依据。
