基于外泌体miRNA探讨针刺“内迎香”穴治疗变应性鼻炎的作用机制
2024-04-22丁然,刘真,王金,夏彤,李蕾
丁 然,刘 真,王 金,夏 彤,李 蕾
中国中医科学院西苑医院,北京 100091
变应性鼻炎(Allergic rhinitis,AR)是一种鼻黏膜慢性炎症反应性疾病,以阵发性喷嚏、鼻塞、鼻痒与流清涕为主要症状,易诱发支气管哮喘、变应性结膜炎、鼻窦炎及睡眠呼吸障碍综合征等疾病[1],影响着全世界10%~40%的人口[2],已成为全球性健康问题。鼻内针刺内迎香穴作为临床应用的特色治疗,相较于传统针刺方式,可直接作用于鼻黏膜,有效缓解AR的相关症状[3],但鼻内针刺内迎香穴治疗AR的效应机制尚不明确,仍需进一步研究。近年来的研究显示[4],外泌体miRNA参与AR的发病进程并可能成为AR潜在的生物标志物,对深入阐释AR的发病机制及探索AR的诊断治疗具有重要意义。同时,有研究发现,针刺可能通过外泌体miRNA发挥治疗作用[5]。基于此,推测针刺内迎香穴可能通过影响外泌体miRNA的传递和释放,以促进细胞间的物质交换与信息传递,从而起到治疗AR的作用。因此,本研究以针刺内迎香穴影响外泌体miRNA的角度探讨针刺治疗AR的免疫调节机制,以期进一步丰富针刺作用的机理,为AR的诊治提供新的思路。
1 材料与方法
1.1 实验动物与分组
SPF级SD健康雄性大白鼠30只,鼠龄为8~10周,体质量(200±20)g,购于北京斯贝福生物技术有限公司[动物生产许可证号:SCXK(京)2019-0010]。于中国中医科学院西苑医院SPF级动物房分笼饲养,温度(20±2)℃,相对湿度(40~60)%,12 h/12 h明暗周期,自由饮食饮水。适应性饲养 1 周后,将大鼠随机分为空白组(Ko)、模型组(Mu)和针刺组(Zh),每组各10只。实验过程严格遵循《关于善待实验动物的指导性意见》中对动物处理的相关规定,并得到中国中医科学院西苑医院动物实验伦理委员会的批准(批准号:2022XLC007-3)。
1.2 主要试剂与仪器
1.2.1 试剂 卵清蛋白(美国Sigma);Al(OH)3(上海麦克林);Harris苏木素(广东BASO);伊红染液(广东BASO)。
1.2.2 仪器 一次性针灸针(0.18 mm×13 mm,苏州华成);全自动轮转切片工作站(德国Leica);全自动多功能染色盖片一体机(德国Leica);正置显微镜(德国Zeiss),超速离心机(日本Hitachi);透射电镜(日本Hitachi);粒径分析仪(厦门NanoFCM);miRNeasy Mini kit(德国Qiagen);纳米光度计分光光度计®(美国加利福尼亚州因普伦);Qubit®RNA检测试剂盒(美国加利福尼亚州生命科技公司);RNA纳米6000检测试剂盒(美国加利福尼亚州安捷伦科技公司)。
1.3 模型制备
模型组和针刺组采用卵清蛋白腹腔注射及鼻黏膜刺激法建立变应性鼻炎大鼠模型[6]。基础致敏:以卵清蛋白(OVA)0.3 mg、Al(OH)330 mg为佐剂及生理盐水1 mL混合后制成混悬液腹腔注射,1次/2 d,共7次。激发致敏:基础致敏结束后当天予5% 0VA生理盐水滴鼻,每侧鼻腔各10 vL,1次/d,连续7次。维持致敏:干预期间每天激发致敏,连续3周。空白组予等量生理盐水腹腔注射及滴鼻。末次滴鼻结束30 min后观察大鼠搔鼻、喷嚏和鼻溢等行为,各项指标均采用叠加量化记分法,症状积分总分>5分表示造模成功。鼻部症状评分标准[7]:①鼻痒:轻度搔痒1~2次为1分,剧烈瘙痒抓鼻四周2分;②喷嚏:1~3个为1分,4~10个为2分,10个以上为3分;③清涕:流至鼻孔为1分,超出前鼻孔为2分,涕流满面为3分。
1.4 干预方法及取材
针刺组于激发致敏结束后予鼻内针刺双侧内迎香穴。参考文献所述方法取穴[8],将大鼠俯卧位固定,针刺两侧鼻腔内迎香穴(位于大鼠下鼻甲前端附着区距鼻阈0.5 cm处),向鼻翼方向约15°进针,深度约黏膜下5 mm;针具采用塑柄针,0.18 mm×13 mm,不采用特殊手法,留针15 min,每周2次,连续3周。
末次干预结束后第4天,所有大鼠采用0.3%戊巴比妥钠(1 mL/100 g)腹腔注射麻醉,麻醉起效后使用抗凝管采集腹主动脉血2 mL,分离血浆于-80℃冰箱保存。迅速剥除大鼠上颌骨皮肤,游离出上颌骨,沿大鼠鼻中线剪开双侧鼻腔,使鼻中隔充分暴露,剥离鼻中隔黏膜,放入4%多聚甲醛中固定24 h后常规脱水、石蜡包埋制作切片(厚度为5 μm)。
1.5 HE染色观察大鼠鼻黏膜组织形态变化
制备好的石蜡切片脱蜡至水,Harris苏木素染色,5 min后入自来水洗数遍,盐酸酒精分化1 s,温水中返蓝数秒,后经室温蒸馏水清洗1 s,醇溶性伊红染液中40 s,水洗2 s,梯度乙醇脱水,二甲苯透明,中性树胶封片。100倍光学显微镜下观察大鼠鼻黏膜组织学形态。
1.6 外泌体分离提取及鉴定
采用超速离心法提取外泌体,37 ℃中速溶样本,将样本移动至一个新的离心管内,2 000×g,4 ℃,30 min离心,将上清液移至新的离心管中,10 000×g,4 ℃,45 min离心,以去除较大的囊泡。再取上清,经0.45 μm滤膜过滤,收集过滤液移至新的离心管中,超速转子,4 ℃,100 000×g离心70 min,去除上清。用10 mL预冷的1×PBS重悬后,超速转子,4 ℃,100 000×g离心70 min,去除上清。用100/150 μL预冷的1×PBS重悬,取10 μL电镜,10 μL粒径分析,40/60 μL加700 μL RNA裂解液,剩余外泌体于-80 ℃保存。吸取外泌体10 μL滴加于铜网上沉淀1 min,并用滤纸吸去浮液,将醋酸双氧铀10 μL滴加于铜网上沉淀1 min,滤纸吸去浮液,常温干燥数分钟,100 kv进行电镜检测成像,通过透射电镜观察外泌体的形态。将外泌体取出10 μL稀释到30 μL。通过粒径分析仪检测外泌体的粒径和浓度信息。
1.7 外泌体miRNA筛选
将总RNA裂解液解冻后,室温下放置5 min,加入140 μL氯仿,涡旋混匀15 s。室温下孵育3 min后4 ℃、12 000 g、离心15 min。上层水相转移至一新的EP管中,加入1.5倍体积的无水乙醇,枪吸混匀。吸取700 μL混合液,转移至RNeasy吸附柱中,室温下8 000 g离心15 s,弃滤液,剩余混合液重复该步骤。添加700 μL Buffer RWT洗涤吸附柱,室温下8 000 g离心15 s,弃滤液。添加500 μL Buffer RPE洗涤吸附柱,室温下8 000 g离心15 s,弃滤液。添加500 μL Buffer RPE洗涤吸附柱,室温下8 000 g离心2 min,弃滤液和收集管。将吸附柱转移至新的2 mL新离心管中,12 000 g离心1 min进行干燥,弃滤液和收集管。将吸附柱转移至1.5 mL新离心管,添加30 μL RNase-free water到吸附膜中间,8 000 g离心1 min,洗脱RNA。在1%琼脂糖凝胶上监测RNA降解和污染。纳米光度计分光光度计检查RNA纯度,Qubit®RNA检测试剂盒测量RNA浓度,Agilent Bioanalyzer 2100系统的RNA Nano 6000检测试剂盒评估RNA完整性。样品检测合格后,使用Small RNA Sample Pre Kit构建文库,利用Small RNA的3′及5′端特殊结构(5′端有完整的磷酸基团,3′端有羟基),以total RNA为起始样品,将Small RNA两端加上接头,反转录合成cDNA。随后经过PCR扩增,PAGE胶电泳分离目标DNA片段,切胶回收得到cDNA文库。文库构建完成后,使用Qubit2.0进行初步定量,稀释文库至1 ng/μL,Agilent 2100对文库的insert size进行检测,insert size符合预期后,Q-PCR对文库的有效浓度进行准确定量(文库有效浓度>2 nM),以保证文库质量。库检合格后,把不同文库按照有效浓度及目标下机数据量的需求pooling,在Illumina Hiseq 2500/2000平台上进行高通量测序。FastQ格式的原始数据首先通过自定义perl和python脚本进行处理,通过删除包含 ploy-N、5′适配器污染物、无3′适配器或插入标签、包含ploy A或T或G或C的读取以及来自原始数据的低质量读取来获得干净的数据。同时计算原始数据的Q20、Q30和GC含量,然后从干净读数中选择21~22 nt长度进行所有下游分析。
1.8 miRNA表达水平及差异分析
使用TPM计算各样品miRNA的表达量,pearson相关系数的平方表示样品间基因表达水平相关性,检验实验可靠性及合理性。使用基于负二项分布的DESeq2软件进行分析,以显著水平P<0.05为差异miRNA的筛选条件,其中|log2(Fold Change)|>1。
1.9 靶基因预测及富集分析
采取miRanda和Targetscan两个数据库预测的交集作为针刺作用关键miRNA的靶基因。GO分析采用Gene Ontology(GO,http://www.geneontology.org/)数据库和GOseq分析软件以揭示其生物学功能。KEGG(Kyoto encyclopedia of genes and genomes)富集分析以KEGG Pathway为单位,应用超几何检验,找出针刺作用关键miRNA的靶基因中显著富集的Pathway,从而确定其参与的最主要信号转导途径和生化代谢途径。
1.10 统计学处理
2 结果
2.1 各组大鼠鼻部症状评分
各组大鼠鼻部症状评分显示,模型组大鼠的鼻部症状评分显著高于空白组,差异有统计学意义(P<0.05),表示造模成功。与模型组比较,针刺组的鼻部症状评分显著降低,差异有统计学意义(P<0.05),说明鼻内针刺内迎香穴能显著减轻变应性鼻炎大鼠的鼻部症状。见表1。

表1 各组大鼠鼻部症状评分
2.2 各组大鼠鼻黏膜组织形态学变化比较
HE染色结果显示,空白组鼻黏膜结构良好,排列整齐,形态正常,无明显炎性细胞浸润;模型组出现慢性炎症,黏膜上皮细胞排列紊乱,可见黏膜水肿,部分区域有变性脱落,且炎性细胞明显浸润,证明变应性鼻炎大鼠造模成功;针刺组鼻黏膜可见黏膜上皮细胞轻度变性脱落,少量炎性细胞聚集, 无明显水肿、血管扩张的改变。见图1。
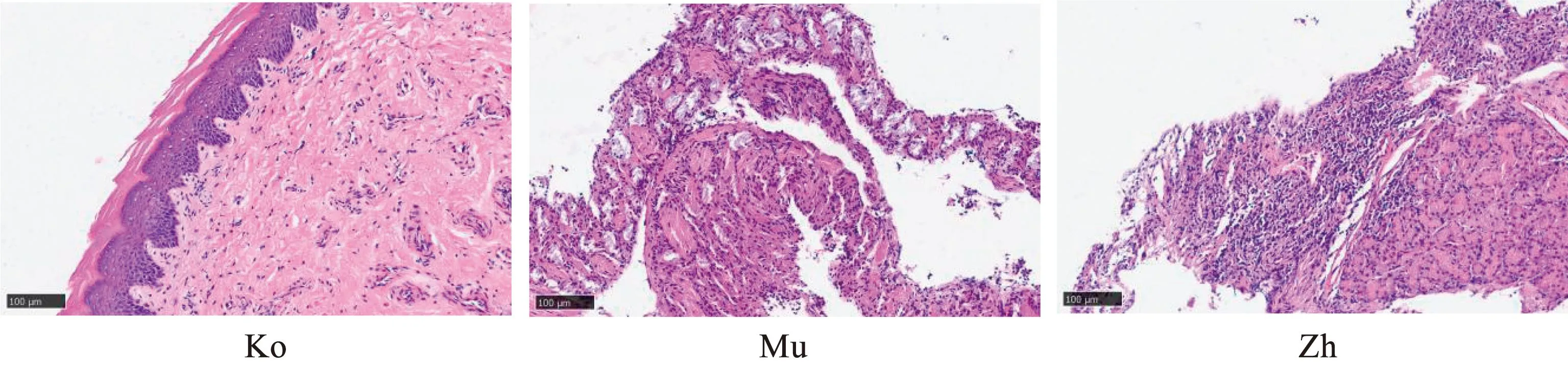
图1 各组大鼠鼻黏膜组织形态学比较(HE染色,100 μm)
2.3 血浆外泌体的鉴定
透射电镜观察显示各组大鼠血浆中均有外泌体存在,呈茶托状连续双层膜囊泡结构。见图2。纳米粒径分析结果显示,样品由直径正态分布的异质性囊泡组成。见图3。

图2 各组大鼠血浆外泌体形态结构比较(标尺:100 nm)

图3 各组大鼠血浆外泌体粒径分布图
2.4 空白组与模型组差异表达的miRNA
将空白组与模型组进行分析,共有16个差异表达的miRNA[P<0.05,|log2(Fold Change)|>1],其中模型组相对于空白组有6个上调、10个下调。见表2。空白组与模型组差异miRNA表达火山图。见图4。

图4 空白组与模型组差异表达miRNA火山图
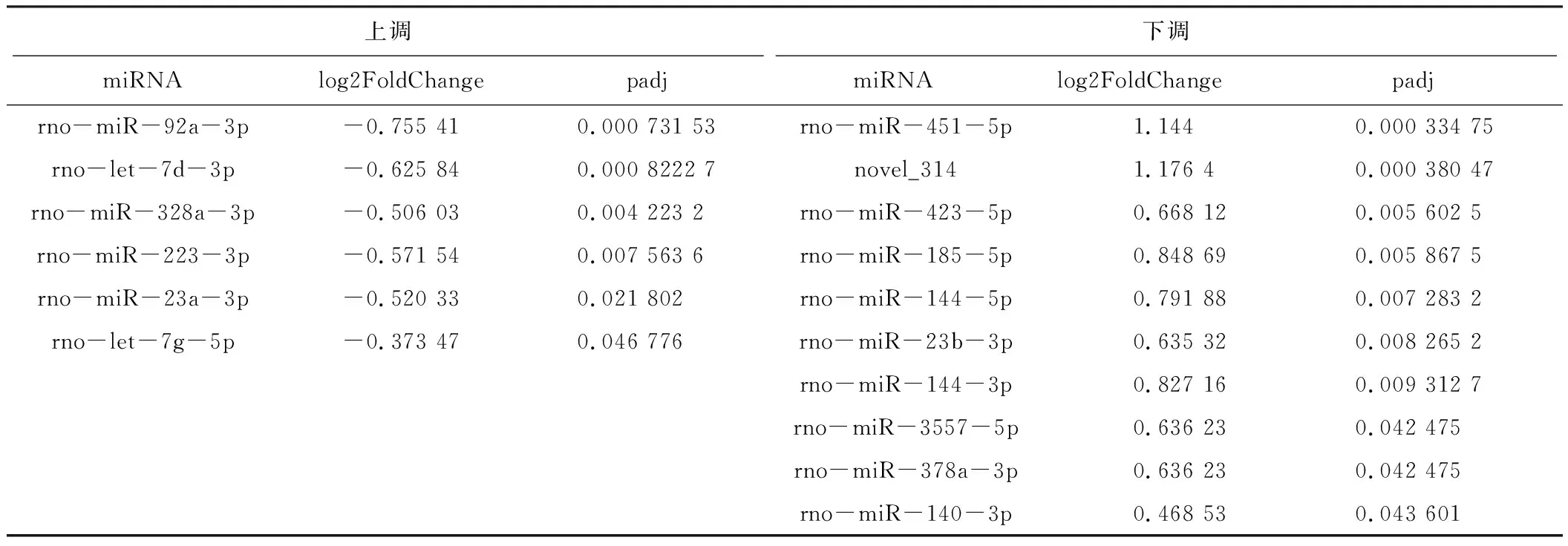
表2 空白组与模型组差异表达的外泌体miRNA
2.5 针刺组与模型组差异表达的miRNA
将针刺组与模型组进行分析,共有52个差异表达的miRNA[P<0.05,|log2(Fold Change)|>1],其中针刺组相对于模型组有32个上调、20个下调。见表3。针刺组与模型组差异miRNA表达火山图。见图5。
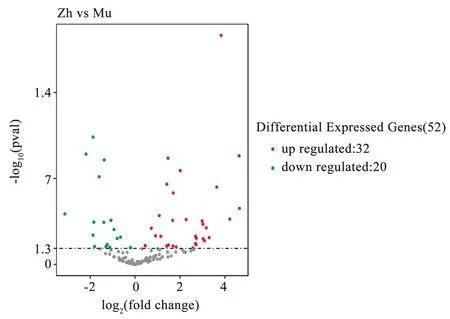
图5 针刺组与模型组差异表达miRNA火山图
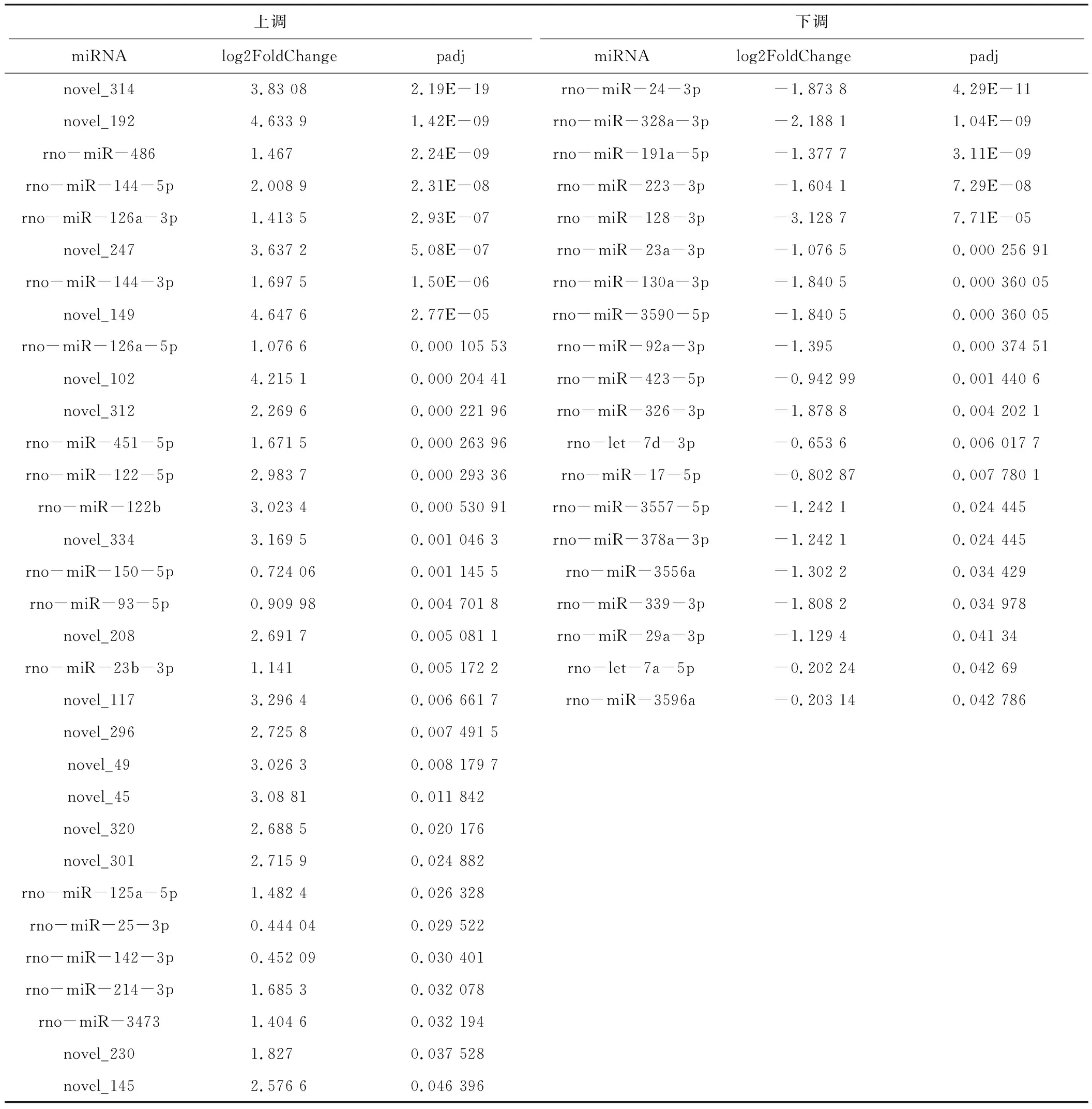
表3 针刺组与模型组差异表达的外泌体miRNA
2.6 针刺作用关键 miRNA 筛选及靶基因预测
为进一步筛选出针刺作用的关键 miRNA,将模型组相对于空白组上调的miRNA与针刺组较模型组下调的miRNA作韦恩图取交集,得到5个miRNA:rno-miR-92a-3p、rno-let-7d-3p、rno-miR-328a-3p、rno-miR-223-3p及rno-miR-23a-3p;同时,将模型组相对于空白组下调的miRNA与针刺组较模型组上调的miRNA作韦恩图取交集,得到5个miRNA:rno-miR-451-5p、novel_314、rno-miR-144-5p、rno-miR-23b-3p及rno-miR-144-3p。综上,共筛选10个针刺作用关键miRNA:rno-miR-92a-3p、rno-let-7d-3p、rno-miR-328a-3p、rno-miR-223-3p、rno-miR-23a-3p、rno-miR-451-5p、novel_314、rno-miR-144-5p、rno-miR-23b-3p及rno-miR-144-3p。见图6。采取miRanda和Targetscan两个数据库的交集来预测针刺作用关键miRNA的靶基因,建立miRNA-靶基因的联系。10个差异miRNA共预测出7408个靶基因,针刺作用关键miRNA及靶基因个数见表4。
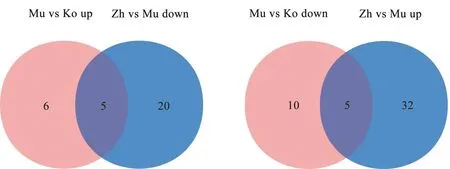
图6 针刺作用关键miRNA的筛选韦恩图

表4 针刺作用关键miRNA及其靶基因个数
2.7 靶基因生物信息学分析
对预测靶基因进行GO分析,其中涉及1 130个生物过程、158个细胞组分和166个分子功能。根据富集度进行排序,统计被显著富集的各个GO term中的基因数,以柱状图的形式展示。见图7。预测出的 miRNA 靶基因的生物学过程(Biological process,BP)分类显示,其可能参与代谢过程的调节、发展过程和细胞代谢过程的调节等。细胞组分(Cellular component,CC)分类分析,发现其具有细胞内、细胞器、膜结合细胞器、细胞质和细胞核等细胞成分。分子功能(Molecu-lar function,MF)分类分析,发现其具有蛋白质结合等分子功能。
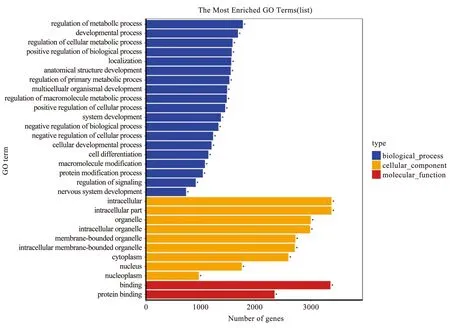
图7 针刺作用关键miRNA靶基因GO功能分析
靶基因KEGG富集分析以P<0.05作为显著富集通路的筛选标准,共筛出31条通路,根据P值排名前20的通路以Q-value、差异表达(rich factor)和涉及的靶基因数目作散点图。见图8。主要涉及胰腺癌、非小细胞肺癌等癌症相关的信号通路,轴突引导、黏着连接、肌动蛋白细胞骨架的调节和细胞内吞作用等生物学过程,MAPK、Hippo、AMPK、FoxO、Rap1、神经营养因子、胰岛素和Wnt等信号通路。

图8 针刺作用关键miRNA靶基因KEGG通路富集分析
3 讨论
鼻内针刺内迎香穴是临床治疗AR的特色疗法,内迎香穴属经外奇穴,最早记载见于《肘后备急方》。按《玉龙经》所载其穴“在鼻孔内上端”, 即鼻孔的内上端,与迎香穴隔鼻翼相对,在鼻翼软骨与鼻甲交界处的黏膜上[9]。内迎香穴近鼻根,外应目内眦,足太阳膀胱经始于目内眦,与各脏腑背俞穴密切相连,针刺内迎香穴可调理脏腑气机,具有行气活血、散瘀泻热和宣通鼻窍之功效[10]。现代医学研究发现内迎香穴处分布有面动、静脉的鼻背支和筛前神经的鼻外支,所处位置下鼻甲是AR发病的重要靶器官,也是变应原进入机体最先接触的部位[11]。通过针刺内迎香穴,可使下鼻甲前端海绵组织中富含的周围容量血管收缩,从而改善鼻的局部血液和淋巴循环, 使肿胀的下鼻甲收缩, 进而扩大鼻腔容积,改善鼻腔通气,缓解患者的鼻塞症状,也可一定程度上降低鼻部敏感性,缓解鼻痒、喷嚏等过敏症状[12]。
随着AR发病机制的深入研究,近年来外泌体miRNA在AR发病中的作用受到广泛关注。外泌体是细胞外囊泡的一种,直径约为30~150 nm,是细胞质膜向内出芽形成的多囊体与细胞膜融合后释放到细胞外形成的双层囊泡状结构[13-14]。其表面稳定的磷脂双分子层结构可保护其内的蛋白质、核酸(如miRNA、mRNA)等免受酶的分解,从而介导细胞间的物质运输与信息传递,将细胞内容物运输入靶细胞,特异性调控靶细胞的生理和病理活动,参与疾病的进程[15-16]。作为细胞间的通讯工具,外泌体可以通过抗原呈递以及促炎和抗炎介质的转移参与免疫调控和炎症的发展[17-18],减轻或加剧过敏反应[19]。MicroRNA(miRNA)作为外泌体携带的长度约为22 nt的内源性非编码RNA,通过特异性结合靶mRNA的3′端非翻译区(3′UTR)来调控转录后的基因表达,从而诱导靶mRNA降解或抑制蛋白质的翻译[20-21],并参与细胞的增殖、分化、凋亡[22]和免疫反应[23]。近年来,miRNA被认为是变应性鼻炎的生物标志物和治疗靶点[24],为变应性鼻炎的早期诊断和治疗预后提供了可能。有研究显示幼稚骨髓衍生的巨噬细胞的外泌体可通过携带miRNA靶向调节NF-kB和TNF-α信号传导来抑制炎症的产生[25]。人间充质干细胞的外泌体通过调节miR-146a-5p/SERPINB2途径抑制Th2细胞分化,从而抑制变应性鼻炎的发展[26]。
本研究基于miRNA组学技术,目的为探讨针刺内迎香穴治疗AR大鼠的作用机制,通过对比发现,针刺作用关键miRNA有10个。本研究为探讨针刺作用关键miRNA对AR模型大鼠的影响,对预测出的针刺作用关键miRNA靶基因进行KEGG通路富集分析,共得到31条通路。其中可能与AR相关的通路有MAPK信号通路(P=0.002<0.05)、Hippo信号通路(P=0.003<0.05)、AMPK信号通路(P=0.004<0.05)、FoxO信号通路(P=0.006<0.05)、Rap1信号通路(P=0.007<0.05)和Wnt信号通路(P=0.02<0.05)。而根据P值对所富集的通路排序后,除了肿瘤以外,MAPK是排在最前面的信号通路。因此推测,针刺关键作用外泌体miRNA分子可能通过影响MAPK信号通路进而影响AR疾病进展,发挥治疗作用。
丝裂原活化蛋白激酶(MAPK)是一组真核生物中高度保守的能被不同的细胞外刺激激活的丝氨酸/苏氨酸蛋白激酶[27]。MAPK通路主要由三级激酶级联方式起效,包括MAPK激酶激酶(MKKK)、MAPK激酶(MKK)和MAPK。这3种激酶能依次激活将细胞表面的信号传导到细胞核内部引起细胞应答,再通过以下4条通路进行下游因子的激活:经典 MAPK(ERK)、C-Jun N 端激酶(JNK)、p38 MAPK和细胞外调节激酶5(ERK5),从而参与细胞的增殖、分化、凋亡及炎症反应,是变应性鼻炎中重要的信号转导通路[28]。其中,p38 MAPK 信号通路的激活可促进各种细胞因子和炎性介质的释放,在免疫系统的调节中起着关键作用[29]。研究表明,p38 MAPK信号通路可调节MUC5AC的表达增高,从而导致AR中黏液过度分泌[30]。而p38 MAPK抑制剂均能减少黏膜下炎性细胞的浸润以及减轻鼻黏膜过敏反应[31]。MAPK家族中的JNK信号通路与AR的发生及鼻黏膜组织的重塑密切相关[32]。
综上,针刺内迎香穴可能通过调节外泌体miRNA介导MAPK信号通路从而抑制机体炎性反应,对AR起到治疗作用。
