壳寡糖上调SRBI核心岩藻糖基化修饰水平减弱小鼠动脉粥样硬化斑块形成
2024-04-18陈林木黄云秀
陈林木,黄云秀
中山市人民医院 1.药学部;2.检验医学中心,广东 中山 528403
壳寡糖(chitosan oligosaccharides,COS)由壳聚糖降解得到,分子量较小,克服了壳聚糖在人体中溶解度小的缺点[1]。前期研究发现COS能减少动脉粥样硬化(atherosclerosis,AS)斑块的形成。例如下调人肝癌细胞系HepG2的前蛋白转化酶枯草杆菌蛋白酶基因表达来增强脂滴形成[2],增强肝脏低密度脂蛋白受体、清道夫受体B类成员1(scavenger receptor class B type Ⅰ protein,SRBI)及巨噬细胞三磷酸腺苷结合盒转运体A1表达[3]等。
糖基转移酶在AS形成的多个阶段发生变化。既往研究表明AS形成的中后期,转录因子HNF1α进入细胞核的减少导致岩藻糖基转移酶8(fucosyltransferase 8,Fut8)翻译水平降低[4],Fut8表达下调时抑制黏着斑激酶磷酸化,导致下游的F-肌动蛋白的聚合被抑制,使得泡沫细胞迁移出斑块能力下降[5]。SRBI含有11个潜在的N链糖基化位点,其中两个位点(Asn-108和Asn-173)的突变改变了其表达和功能[6]。这表明N-链糖基化可以影响SRBI在细胞内的脂质转运活性。先前的研究已经证实COS通过影响SRBI的表达而减弱AS的形成,那么SRBI的糖基化修饰水平的改变是否是COS作用的靶点之一呢?
本研究拟利用动物和细胞实验观察SRBI糖基化修饰位点在COS影响泡沫细胞脂质外排中的作用。
1 材料与方法
1.1 材料
1.1.1 动物和细胞:SPF级ApoE-/-小鼠40只,约6周龄,体质量18~25 g(北京华富康生物科技有限公司)。小鼠巨噬细胞系Raw264.7(中科院上海细胞库)。
1.1.2 主要试剂:壳寡糖(中国科学院大连化学物理研究所提供,聚合度2~8,脱乙酰度>88%,平均分子量<1 000 Da);高脂饲料(江苏美迪森生物医药有限公司);裂解液(北京康为世纪生物科技有限公司);油红O染色液(北京索莱宝科技有限公司);ELISA试剂盒(上海江莱生物科技有限公司);RNA提取试剂盒(北京康为世纪生物科技有限公司);SYBR Premix Ex TaqTMⅠ PCR定量试剂盒(北京康为世纪生物科技有限公司);反转录试剂盒(北京康为世纪生物科技有限公司);胆固醇酯外流试剂盒(Abcam公司);游离胆固醇酯测定试剂盒(北京普利莱基因技术有限公司)。
1.2 方法
1.2.1 动脉粥样硬化模型的建立:小鼠饲养在昼夜交替的照明条件下,进食和饮水不受限制。随机分为对照组(n=20, control group)和壳寡糖组(n=20, COS group)。对照组饲喂高脂饲料12周,COS组饲喂高脂饲料和壳寡糖(每天灌胃,500 mg/kg)12周[7]。记录实验期间的两组小鼠体质量、摄食量等基本信息。实验结束后,处死小鼠,采集小鼠血清和脏器。样品保存在-80 ℃冰箱中或用4%多聚甲醛溶液固定。本方案经中山市人民医院伦理委员会批准(批准号:K2020-19)。
1.2.2 器官功能指标和血清脂质水平的检测:采用戊巴比妥腹腔注射麻醉ApoE-/-小鼠。经眼眶采血后离心分离血清。两组小鼠的总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C),甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、载脂蛋白A-Ⅰ(apolipoprotein A-I,ApoA1)、载脂蛋白B100(apolipoprotein B100,ApoB100)、血糖(glucose,Glu)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)、尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)、肌酸激酶(creatine kinase,CK)和乳酸脱氢酶(lactate dehydrogenase,LDH)均采用实验室全自动生化分析仪检测。
1.2.3 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血清蛋白表达:ELISA的操作步骤按照试剂供应商的说明书进行。
1.2.4 Western blot检测蛋白质表达:各组随机选取3只小鼠的主动脉组织(约30 mg),用裂解液300 mL提取总蛋白质。用BCA蛋白质测定试剂盒测定样品的蛋白质浓度。后续步骤参考文献[8]。
1.2.5 RT-qPCR检测mRNA表达水平:采用超纯RNA试剂盒提取组织总RNA。PrimeScriptTMRT试剂盒反转录总RNA(1 μg)。iCycleriQ用于SYBR Premix Ex TaqTMⅡ实时PCR检测系统。详细的RT-qPCR程序参考论文[8]。使用以下引物扩增目的基因:SRBI: 5′-GGCTGCTGTTTG CTGCG-3′(F)和5′-GCTGCTTGATGAGGGAGGG-3′(R); β-actin:5′-AAGACCTCTATGCCAAC AC-3′(F)和5′-CTGCTTGCTGATCCACAT -3′(R)。
1.2.6 荧光法测定胆固醇含量:使用胆固醇外排试剂盒评估胆固醇外排情况,参考制造商的方案和先前研究[9]。胆固醇流出率(%)=[上清液荧光强度/(上清液荧光强度+细胞沉淀荧光强度]×100%。
1.2.7 酶法检测血清总胆固醇和游离胆固醇:胆固醇酯测定详细的实验程序按照已发表文章[10]。胆固醇酯(cholesteryl ester,CE)=总胆固醇(total cholesterol,TC)-游离胆固醇(free cholesterol, FC)。
1.2.8 凝集素芯片检测凝集素水平:小鼠主动脉样品送到上海华盈生物有限公司进行实验。根据Raybiotech的标准操作程序,使用Raybiotech试剂盒进行实验。
1.2.9 液相色谱-串联质谱技术检测两组血清糖蛋白变化:小鼠血清样品送到北京百派泰克生物科技有限公司进行实验。主要实验步骤如下:BCA蛋白提取和蛋白浓缩;琼脂糖结合小扁豆凝集素(lens culinaris agglutinin,LCA)下拉试验;胰蛋白酶消化蛋白质;纳米液相色谱-串联质谱联用技术分析。
1.3 统计学分析
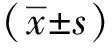
2 结果
2.1 COS对小鼠基础数据的影响
COS可以显著降低小鼠体质量和食物摄入量(P<0.05)。给药后,COS组小鼠肝脏质量明显低于对照组(P<0.01)(表1)。COS对脏器功能指标(AST、ALT、ALP、BUN、Cr、Glu、CK、LDH)无明显影响。

表1 COS对小鼠基础数据的影响Table 1 Effects of COS on basic data in n=20)
2.2 COS减弱AS斑块的形成
COS治疗后, TC(图1A)、LDL-C(图1C)水平明显降低(P<0.05),TG(图1B)、HDL-C(图1D)、ApoA1(图1E)、ApoB100(图1F)水平变化不明显。COS组内膜厚度比对照组明显变薄(P<0.05)(图1G),油红O染色结果显示,COS组主动脉瓣脂质沉积明显减少(P<0.05)(图1H)。

A-F.comparison of serum TC, TG, LDL-C, HDL-C, ApoA1 and ApoB100 levels between two groups of mice; G.comparison of aortic intima thickness between the two groups(×40); H.comparison of aortic fat deposition between two groups of mice(×40); TC.total cholesterol; TG.triglyceride; LDL-C.low density lipoprotein-cholesterol; HDL-C.high density lipoprotein-cholesterol; ApoA1.apolipoprotein A-I; ApoB100.apolipoprotein B100;*P<0.05 compared with control group.
2.3 COS促进核心岩藻糖基化的表达
采用凝集素芯片法检测COS处理后主动脉组织中凝集素的变化(图2A)。多种凝集素发生显著变化,如橙黄网胞盘菌凝集素(aleuria aurantia lectin,AAL)、大蒜凝集素(allium sativum lectin,ASA)(图2B)。ELISA结果显示,AAL(示总岩藻糖基化)和LCA (示核心岩藻糖基化)的表达明显上调(图2C和D)(P<0.05),而翅荚百脉根凝集素(lotus tetragonolobus lectin,LTL)(示α1,3/4-岩藻糖基化)的表达无明显变化(图2E)。怀槐凝集素Ⅰ(maa-ckia amurensis lectin Ⅰ,MAL Ⅰ)(示α 2,3 -唾液酰化)的表达明显下调(图2F)(P<0.05),而黑松凝集素(sambucus nigra lectin,SNA)(示α 2,6 -唾液酰化)的表达没有明显变化(图2G)。ELISA结果也显示Fut8蛋白含量明显上调(P<0.05)(图2H)。

A.schematic diagram of lectin chip; B.heat map results of lectin chip; C-H.the expression of AAL, LCA, LTL,MAL Ⅰ, SNA and Fut8 were detected by ELISA in the two groups; AAL.aleuria aurantia lectin; LCA.lens culinaris agglutinin; LTL.lotus tetragonolobus lectin; MAL Ⅰ.maackia amurensis lectin I; SNA.sambucus nigra lectin; *P<0.05 compared with control group.
2.4 SRBI作为LCA结合蛋白在COS组的表达显著降低
在高尔基网或内质网中,糖基转移酶将糖链添加到下游靶蛋白上从而影响其功能。从COS组和对照组中各随机抽取4个样本行LCA pull-down和Western blot实验。结果显示,分子量位于80~90 ku之间的蛋白在两组间有明显差异。对该部分条带进行质谱分析,共鉴定出389个蛋白和4 556个多肽。在相互作用蛋白的筛选过程中,以P<0.05和fold changes ≥ 5为筛选标准。筛选到beta-2-glycoprotein 1(图3A)、serum amyloid A-2 protein(图3B)、sathepsin G (图3C)、scavenger receptor class B member 1(SRB1)(图3D)共4个相互作用蛋白。已有研究证实,清道夫受体B类成员1(SRBI)是一种重要的脂质外排受体,与泡沫细胞的形成密切相关。COS组主动脉SRBI蛋白(图3E)和mRNA表达量(图3F)显著上调(P<0.05)。

A-D.relative expression levels of serum beta-2-glycoprotein, serum amyloid A-2 protein,serum cathepsin G, scavenger receptor class B member 1 in two groups; E.protein expression of scavenger receptor class B member 1 in aorta in two groups; F.mRNA expression in aorta of scavenger receptor class B member 1 in two groups; *P<0.05 compared with control group.
2.5 SRBI糖基化修饰减弱了COS促进胆固醇外排的作用
SRBI是一种重要的胆固醇外排受体,因此,从脂质外排角度探讨COS的作用。300 μg/mL COS处理RAW264.7细胞24 h,细胞活力明显下降(P<0.05)(图4A)。200 μg/mL COS处理RAW264.7细胞48 h,细胞活力明显下降(P<0.05)(图4B)。因此,200 μg/mL COS处理细胞 24 h为后续处理条件。胆固醇酯流出实验表明,50 μg/mL ox-LDL处理RAW264.7细胞24 h导致胆固醇酯外流明显减少(P<0.05)。同步添加COS后升高了胆固醇流出比例,且随浓度的增加而增加(图4C)。细胞内游离胆固醇酯测定结果显示,50 μg/mL ox-LDL处理RAW264.7细胞24 h 后,细胞内CE/TC明显升高。200 μg/mL COS可使CE/TC降低至50%以下(图4D)。为验证SRBI作用, 通过siRNA敲低SRBI的表达(图4E)。SRBI表达降低会抑制COS的促胆固醇外排作用(图4F),导致细胞内游离胆固醇酯(cholesterol ester,CE)的比例显著增加(P<0.05)(图4G)。进一步探讨SRBI糖基化对其功能的影响,构建了SRBI N108糖基化突变载体并转染细胞。通过IP实验沉淀SRBI后,Western blot实验显示LCA和AAL的表达水平明显降低(P<0.05)(图4H)。当突变的SRBI和COS共同处理细胞时,胆固醇流出减弱(图4I),细胞内游离胆固醇酯的比例显著增加(P<0.05)(图4J)。

A.effects of different concentrations of COS on cell viability; B.effects of different COS treat-time on cell viability; C.effect of COS on cholesterol efflux of RAW264.7 cells; D.effects of COS on CE/TC of RAW264.7 cells; E.expression of SRBI after siRNA interference was verified by Western blot; F.effect of SRBI interference on cholesterol efflux of RAW264.7 cells; G.effects of SRBI interference on CE/TC of RAW264.7 cells; H.glycosylation level of mutant SRBI was detected by Western blot;I.effect of mutated SRBI on cholesterol efflux in RAW264.7 cells; J.effect of mutated SRBI on CE/TC in RAW264.7 cells;*P<0.05 compared with control group; #P<0.05 compared with ox-LDL group.
3 讨论
壳寡糖是壳聚糖的部分水解产物,它保留了壳聚糖的可生物降解性、相容性和无毒性等特点。由于分子量小,其水溶性和抗氧化性能优于壳聚糖[1]。许多研究表明,COS可以显著缓解动脉粥样硬化的发生和发展。本文实验结果显示COS能显著降低TC和LDL-C,说明COS主要通过降低胆固醇抑制ApoE-/-小鼠动脉粥样硬化的形成。然而没有观察到两组小鼠间HDL-C的变化,这与以往报道壳寡糖能够升高大鼠血浆中HDL-C的实验结果不同[11]。这种差异可能与脂蛋白组成和代谢的复杂性以及物种不同有关。
糖基化修饰是蛋白质翻译后修饰的重要方法之一[12]。在AS早期,当血液中的单核细胞粘附在内皮细胞上并进一步穿透TNF-α诱导的内皮损伤时,COS可通过O-氨基葡萄糖转移酶与n-乙酰基连接,调节EA hy926细胞中白介素-6和白介素-8的表达[13]。在AS形成的中后期,形成的泡沫细胞的运动能力明显减弱,停留在斑块内,引起炎性反应扩大[14]。本文实验表明COS处理后血清中几种凝集素发生了变化,包括AAL、LCA和MAL I等。基于前期实验基础,本研究重点关注Fut8和对应凝集素LCA的在COS影响斑块形成中的重要作用。结合以往文献,后续实验将进一步探讨其他凝集素和相应的糖基转移酶在该过程中的作用。
SRBI是一种重要的脂质外排受体,与三磷酸腺苷结合盒转运体 A1、三磷酸腺苷结合盒转运蛋白G1共同介导细胞内脂质平衡。实验表明,SRBI在COS处理后显著上调,是一种LCA凝集素结合蛋白。虽然COS处理后SRBI的表达大幅增加,但胆固醇流出水平和细胞内胆固醇酯水平仍未恢复到空白对照组水平,这可能与白细胞分化抗原36表达部分增加有关。另外,siRNA降低SRBI表达后,COS的作用明显减弱,说明SRBI是COS发挥抗AS作用的必要因素之一。通过构建SRBI糖基化位点突变载体,本研究发现SRBI糖基化修饰单位点突变对胆固醇流出的影响低于SRBI表达的变化。由于存在多个可能的糖基化修饰位点,虽然选择了对其功能影响最大的位点,但其他位点仍然发挥了作用。后续的实验将进行多位点突变实验,观察糖基化修饰对SRBI功能的完整机制。
综上所述,本研究结果表明,用中等浓度的COS治疗ApoE-/-小鼠,可以显著减弱AS斑块的形成。SRBI表达和糖基化水平的升高可能是脂质外排的重要机制之一。
