羧胺三唑乳清酸盐对人胰腺癌细胞系增殖及脂肪酸合成代谢的影响
2024-04-18郭泓江徐也婷张迪雅仇佳星王钰铖
郭泓江,徐也婷,张迪雅,仇佳星,王钰铖,鞠 瑞,郭 磊
中国医学科学院基础医学研究所 北京协和医学院基础学院 药理学系,北京 100005
胰腺癌(pancreatic cancer, PC)是全球癌死亡的主要原因,根据美国癌协会发布数据,胰腺癌5年生存率仅有12%,并且其发病率仍以每年1%的速度增加,预计2040年将成为美国癌死亡的第2大原因[1-2]。中国国家癌中心2023年报告显示,胰腺癌位居中国癌致死率第6位,其中胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)是最常见的胰腺癌类型。手术切除是胰腺癌最有效的治疗手段,但由于起病隐匿,缺乏早期筛查方法,多数患者被诊断为晚期或转移性疾病,无法进行手术切除,因此几乎所有患者都需接受辅助化学治疗[3]。然而耐药性的出现严重限制了化学治疗有效性。快速增殖的癌细胞需要足够的脂肪酸来支持膜和信号分子的生物合成,脂质代谢功能对于PDAC进展及耐药表型产生尤为重要。因此,探索干预脂质代谢的新方法对突破胰腺癌治疗有重要意义。
羧胺三唑(carboxyamidotriazole,CAI)是一种非细胞毒类小分子化合物,通过抑制肿瘤细胞线粒体电子传递链复合物Ⅰ阻断氧化呼吸,在多种癌模型中具有显著的抗肿瘤活性[4]。近年来,不断有证据发现CAI具有代谢调节剂的作用,通过激发肿瘤细胞谷氨酰胺代谢依赖性,使得CAI联合谷氨酰胺代谢抑制剂策略在肿瘤治疗中取得显著疗效[5]。其乳清酸盐形式羧胺三唑乳清酸盐(carboxyamidotriazole-orotate, CTO)可进一步降低口服毒性并提高生物利用度。在缺氧或营养匮乏的微环境中,肿瘤细胞将改变其代谢模式以维持增殖,其中谷氨酰胺可以作为替代碳源,通过还原羧化作用优先供应脂肪酸的生成[6]。然而,CTO对胰腺癌细胞脂肪酸代谢的影响尚不明确。本研究旨在探索CTO对不同化疗敏感性胰腺癌细胞增殖的影响,并初步探究CTO诱导胰腺癌细胞脂质合成代谢重编程的机制。
1 材料与方法
1.1 材料
1.1.1 细胞系:人胰腺癌细胞系AsPC-1、PANC-1、MiaPaCa-2(国家生物医学实验细胞资源库)、人胰腺癌细胞吉西他滨(gemcitabine, GEM)耐药株AsPC-1/GEM(武汉普诺赛生命科技有限公司,以下简称AR细胞)。
1.1.2 药品与试剂:羧胺三唑乳清酸盐(MCE公司);DMEM高糖培养基、0.25%胰蛋白酶(国家生物医学实验细胞资源库);XF Long Chain Fatty Acid Oxidation Stress Test Kit(Agilent 公司);DMSO(JiSiEnBei公司);甲醇(国药集团化学试剂有限公司);青霉素-链霉素混合液,胎牛血清、磺酰罗丹明B(sulfoehodamine,SRB)细胞增殖和毒性检测试剂盒、BCA蛋白质定量检测试剂盒(翌圣生物科技有限公司);RIPA裂解液、PMSF(北京索莱宝科技有限公司);总RNA提取试剂、Evo M-MLV 反转录试剂预混液(湖南艾科瑞生物工程有限公司);PowerUpTMSYBRTMGreen Master Mix(Thermo Fisher公司);兔抗ACC、p-ACC、AMPK、p-AMPK抗体(CST公司);兔抗c-Myc抗体(Proteintech公司)。
1.2 方法
1.2.1 细胞的分组及处理:AsPC-1、PANC-1、MiaPaCa-2、AR细胞在含有10%FBS的DMEM高糖培养基中培养。取对数增殖期的细胞,分组为:对照组(control组);给药组(CTO组),用DMSO将CTO配置为20 mmol/L母液,后用DMEM培养基稀释为20 μmol/L工作液处理细胞。
1.2.2 细胞增殖实验:使用sulforhodamine B (SRB)法检测细胞存活情况。SRB实验按照标准程序进行,将细胞以每孔1×104个细胞接种于96孔板中,分组,给药组以20 μmol/L CTO培养48及72 h,每孔加入200 μL DMEM培养。随后按SRB检测试剂盒说明书进行固定及染色。在515 nm波长处测量吸光度,并依据吸光度计算细胞活率。计算公式为细胞活率=(Asample-Ablk)/(Acon-Ablk)×100%。
1.2.3 RT-qPCR检测胰腺癌细胞系中脂肪酸合成关键基因mRNA转录水平:取对数生长期的各株胰腺癌细胞按照每皿1×106个细胞接种于6 cm培养皿中,过夜贴壁后给药,48 h后使用Trizol提取总RNA,反转录为cDNA后使用SYBR Green Master Mix在CFX96 Touch Real Time PCR系统进行检测。所有样品均单独归一化为β-actin。引物序列如表1所示。

表1 RT-qPCR引物序列Table 1 Primer sequences for RT-qPCR
1.2.4 Western blot检测细胞AMPK/ACC通路相关蛋白表达:取对数增殖期的各株胰腺癌细胞按照每皿5×105个细胞接种于6 cm培养皿中,过夜贴壁后给药,48 h后提取蛋白,BCA法测定蛋白浓度后取30 μg蛋白进行上样、电泳、转膜反应,加入一抗AMPK、p-AMPK、ACC、p-ACC、c-Myc抗体及内参抗体β-actin(1∶1 000),4 ℃孵育过夜,然后与HRP标记的山羊抗兔IgG二抗(1∶5 000)室温孵育2 h。使用增强型化学发光液显影,用Image J软件分析吸光度值。
1.2.5 靶向代谢组学分析:接种4×106个AsPC-1/GEM细胞于10 cm培养皿中。给药培养48 h后收样,样品置干冰上,按照每1×106个细胞加入40 μL预冷的80%(v/v)甲醇水直接萃取代谢物,并用细胞刮刀刮下,转至离心管,然后在15 000 r/min,4 ℃下离心30 min。重复上述离心过程2次后,将50 μL上清液转移至新的洁净液相小瓶中,用于后续的液相-质谱分析。对对照组和CTO组进行差异代谢物分析[log2(fold change)≥1]。
1.3 统计学分析
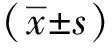
2 结果
2.1 CTO显著降低胰腺癌细胞系的生存率
与对照组相比,AsPC-1、AR、PANC-1、MiaPaCa-2四株人胰腺癌细胞在20 μmol/L CTO作用48 h及72 h后,细胞生存率显著降低(P<0.05,P<0.01,P<0.001)(图1)。

A.survival rate of AsPC-1,AR,PANC-1 and MiaPaCa-2 cells after being treated with CTO for 48 hours; B.survival rate of AsPC-1,AR,PANC-1 and MiaPaCa-2 cells after being treated with CTO for 72 hours; *P<0.05, **P<0.01, ***P<0.001 compared with control.
2.2 CTO降低AR细胞中脂肪酸代谢物的含量
与对照组相比,AR细胞CTO给药组有26个脂肪酸代谢物产生显著变化,其中22个代谢物质的含量显著减少(P<0.05)。各组AR细胞脂肪酸代谢组学聚类热图见图2。

The bottom showed the numbers of the samples in the control group and the CTO group, from left to right, there were 4 control groups and 4 CTO groups; the right side represented the name of 26 lipid metabolites with significant differences(P<0.05), the color of the thermal aggregation graph indicated the amount of metabolites in the sample, where the expression level from red to blue gradually decreased; the cluster tree was located on the left side of the picture, and 26 lipid metabolites were clustered.
2.3 CTO对AMPK/ACC通路的影响
与对照组相比,4株胰腺癌细胞在CTO作用后腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)、乙酰辅酶A羧化酶(acetyl-CoA carboxy-lase, ACC)蛋白表达均显著降低,而p-AMPK、p-ACC蛋白表达显著增加(P<0.05,P<0.01,P<0.001)(图3)。

*P<0.05, **P<0.01, ***P<0.001 compared with control.
2.4 CTO下调胰腺癌细胞中脂肪酸合成关键基因的转录水平
与对照组相比,CTO给药组的4株胰腺癌细胞内脂肪酸合成关键基因SREBF1、FASN、ACACA、ACLY的mRNA水平均显著降低(P<0.05,P<0.01,P<0.001)(图4)。

*P<0.05, **P<0.01, ***P<0.001 compared with control.
2.5 CTO抑制胰腺癌细胞中c-Myc的表达
与对照组相比,CTO给药组4株胰腺癌细胞中c-Myc蛋白表达均显著降低(P<0.05,P<0.01)(图5)。

*P<0.05, **P<0.01 compared with control.
3 讨论
“代谢重编程”是肿瘤的标志之一,在肿瘤微环境中,肿瘤细胞会启动特定的能量代谢途径,以满足增殖的需求[7]。胰腺癌具有广泛的代谢异质性,改善代谢不仅影响胰腺癌细胞的存活,靶向代谢特征进行干预可能是一种行之有效的治疗耐药的方式[8]。 脂质代谢是肿瘤代谢重编程的重要途径, 脂肪酸是细胞能量储存、信号分子生成和膜增殖所必需的物质[9]。肿瘤的高脂肪酸氧化水平可以代偿性增加细胞ATP和NADPH,与化疗耐药密切相关[10]。因此,脂肪酸代谢从多个方面影响癌细胞的生物学性质。
肿瘤细胞倾向于增加内源性脂质的从头合成,这种异常的脂肪酸和胆固醇的生物合成为肿瘤细胞高度增殖和不断适应不利微环境(如缺氧和营养匮乏)提供了持续的养料。乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)是脂肪酸合成途径的限速酶,主要由ACACA基因编码,同时是 AMPK 的下游调控因子。AMPK 可通过将 ACC磷酸化而使得ACC 活性丧失,进而控制脂肪酸的生成,对下游脂肪酸代谢产生重要影响[11]。在三羧酸循环过程中,细胞通过ATP柠檬酸裂解酶(ATP-citrate lyase, ACLY)催化柠檬酸产生乙酰辅酶A,后者经由ACC催化生成丙二酰辅酶A,然后通过脂肪酸合成酶(fatty acid synthase, FASN)进一步合成细胞增殖所需的各种脂肪酸。FASN也是脂肪酸合成的关键酶之一,其过表达通常与癌进展紧密相关[12]。
前期研究证明,羧胺三唑可通过抑制细胞线粒体呼吸,减少细胞ATP的产生,影响能量感应分子AMPK的活性和表达,进而诱发肿瘤细胞的代谢重编程[4]。本研究旨在进一步探索CTO对多株胰腺癌的抗肿瘤作用,并探究其调控肿瘤细胞脂肪酸合成的机制,为寻找新的靶向代谢疗法及联合用药策略提供理论基础。
本研究证实,无论是否为化疗药敏感或耐药的胰腺癌细胞,CTO均发挥显著抑制其增殖的作用;CTO作为代谢调节剂,通过抑制癌基因c-Myc蛋白表达,调控AMPK/ACC通路,下调脂肪酸合成路径的基因表达,进而抑制细胞脂肪酸合成能力。这种作用可能是CTO抑制PDAC细胞增殖的重要机制之一。胆固醇调节元件结合蛋白(sterol regulatory element-binding proteins,SREBPs)是脂类代谢物合成的主要转录调控因子,通过调控FASN以及ACC等基因表达调节脂肪酸的合成。癌基因c-Myc可SREBPs协同调节脂质生成,从而影响肿瘤细胞的增殖[13-14]。本研究初步证实CTO可以下调4株人胰腺癌细胞中c-Myc的蛋白表达,同时证明CTO显著下调细胞内SREBF1等脂肪酸合成相关基因的转录水平,但是对于CTO调控c-Myc表达的机制以及c-Myc下游调控位点的探讨仍然较浅,将在日后进一步完善CTO对胰腺癌细胞c-Myc调控与脂肪酸代谢之间关联的机制探索。
