咪达唑仑减轻氧糖剥夺/复糖复氧诱导的小鼠神经元损伤
2024-04-18陈凌君
陈 涛,陈凌君*,李 媛
1.永州市中心医院冷水滩院区 麻醉科,湖南 永州 425000;2.海南医学院第一附属医院 麻醉科,海南 海口 570105
缺血性脑血管病主要指脑组织供血中断或不足引起神经系统疾病[1]。目前,尚无有效治疗措施,因此开发有效的药物用于神经保护具有重要意义。咪达唑仑(midazolam)是γ氨基丁酸受体激动剂,具有抗焦虑、抗惊厥等作用[2]。研究表明咪达唑仑可以促进缺氧复氧诱导的大鼠海马神经元增殖并降低细胞凋亡,实现对海马神经元的保护作用[3]。研究表明,CREB/PGC-1α信号通路在细胞代谢过程中扮演着重要角色[4]。研究显示激活CREB/PGC-1α信号通路减少脑组织线粒体损伤导致的氧化应激,减少氧自由基对机体的进一步损伤[5]。咪达唑仑是否可以调控CREB/PGC-1α信号通路来降低氧糖剥夺/复糖复氧(oxygen glucose deprivation/restoration,OGD/R)诱的神经损伤还不清楚。因此本研究以HT22细胞为研究对象,探究咪达唑仑对OGD/R诱导的HT22细胞的影响。
1 材料与方法
1.1 细胞与试剂
小鼠神经元细胞系HT22(智立中特生物科技有限公司)。
DMEM培养基(上海圻明生物科技有限公司);咪达唑仑(恒瑞医药有限公司);CREB抑制剂KG-501(Med Chem Express公司);MTT试剂盒(上海海方生物技术有限公司);Edu试剂(深圳海思安生物技术有限公司);Trizol试剂(广州威佳科技有限公司);总RNA提取试剂盒(上海卡迈舒生物科技有限公司);蛋白提取试剂盒(郑州隆之鼎商贸有限公司);TNF-α、IL-6 ELISA试剂盒(上海瑞楚生物科技有限公司);RT-qPCR试剂盒(北京博迈德生物科技有限公司);胰蛋白酶(北京缘生化科技有限公司);Ki-67、Bcl-2、Bax、CREB、PGC-1α一抗及二抗(Abcam公司)。
1.2 方法
1.2.1 细胞的分组与处理:将细胞分为对照组,氧糖剥夺4 h后复糖复氧培养24 h为OGD/R组[6],3、6、12 μmol/mL咪达唑仑[3]、12 μmol/mL咪达唑仑+25 μmol/L的KG-501[7]干预OGD/R细胞为咪达唑仑低、中、高剂量组和咪达唑仑高剂量+KG-501组。对照组和OGD/R组不添加药物处理。
1.2.2 MTT法检测细胞增殖:收集各处理组HT22细胞接种于96孔板中培养。在培养24 h和48 h时,向每孔中加入MTT溶液,继续培养4 h,再加入二甲基亚砜,避光震荡溶解后,用酶标仪检测各孔吸光值(A490)。
1.2.3 Edu染色检测细胞增殖:将上述各组HT22细胞以5×104个/孔接种到24孔板中。无菌培养36 h,然后向每孔中加入适量Edu孵育2 h,按照Edu-555细胞增殖检测试剂盒说明书进行Edu及DAPI染色,随后以荧光显微镜采集各组细胞图像,采用Image J软件定量各组Edu阳性细胞数及总细胞数,计算各组细胞增殖率,公式为:增殖率=Edu阳性细胞数/总细胞数×100%。
1.2.4 流式细胞术检测细胞凋亡:取各组HT22细胞,用PBS清洗,加入500 μL结合缓冲液沉淀细胞并收集,然后加入annexin V-FITC与PI试剂,室温避光反应15 min,上样用流式细胞仪检测各组细胞凋亡情况。
1.2.5 ELISA检测TNF-α、IL-6含量:离心收集各组细胞培养基上清液,按照ELISA试剂盒说明书进行操作检测相关指标。
1.2.6 试剂盒检测SOD、CAT、MDA:用裂解液裂解各分组HT22细胞,按照试剂盒说明书检测相关指标。
1.2.7 RT-qPCR检测CREBmRNA和PGC-1αmRNA表达水平:收集各分组HT22细胞,提取细胞总RNA,将RNA反转录为cDNA,荧光定量PCR扩增cDNA。以GAPDH为内参,使用2-ΔΔCt方法计算CREBmRNA和PGC-1αmRNA的相对表达量。引物:CREBmRNA:正向5′-ATGTGCCCATGTCGGAT TATC-3′;反向:5′-GAGGAAGCGACAAGTGTG-3′;PGC-1αmRNA:正向:5′-CGGCAACCTCTTCAGAA CG-3′;反向:5′-CTCAGTTGGAAGGTACCGCG-3′;GAPDH:正向:5′-CCGCACAGCGACTCGCCTTT-3′;反向:5′-AGACAAGACGACGCCGGTT-3′。
1.2.8 Western blot检测Ki-67、Bcl-2、Bax、CREB、PGC-1α的蛋白表达量:用蛋白裂解液裂解各处理组HT22细胞并提取细胞总蛋白,检测细胞中蛋白含量,电泳进行蛋白分离,转膜,于5%的脱脂奶粉封闭液中封闭;加入Ki-67、Bcl-2、Bax、CREB、PGC-1α(稀释1∶1 500)一抗4 ℃摇床过夜,洗膜后再分别加入二抗(稀释1∶5 000)常温下孵育2 h,加入ECL发光液显影,用Image-Pro Plus进行定量分析。
1.3 统计学分析
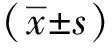
2 结果
2.1 咪达唑仑对HT22细胞增殖能力的影响
与对照组相比,OGD/R组细胞A490值(24、48 h),细胞增殖率显著性降低(P<0.05);与OGD/R组相比,咪达唑仑低、中、高剂量组细胞A490值(24、48 h),细胞增殖率显著性升高,呈剂量依赖性(P<0.05);与咪达唑仑高剂量组相比,咪达唑仑高剂量+KG-501组A490值(24、48 h),细胞增殖率显著性降低(P<0.05)(图1)。
*P<0.05 compared with the control group; #P<0.05 compared with the OGD/R; △P<0.05 compared with the midazolam high dose group.
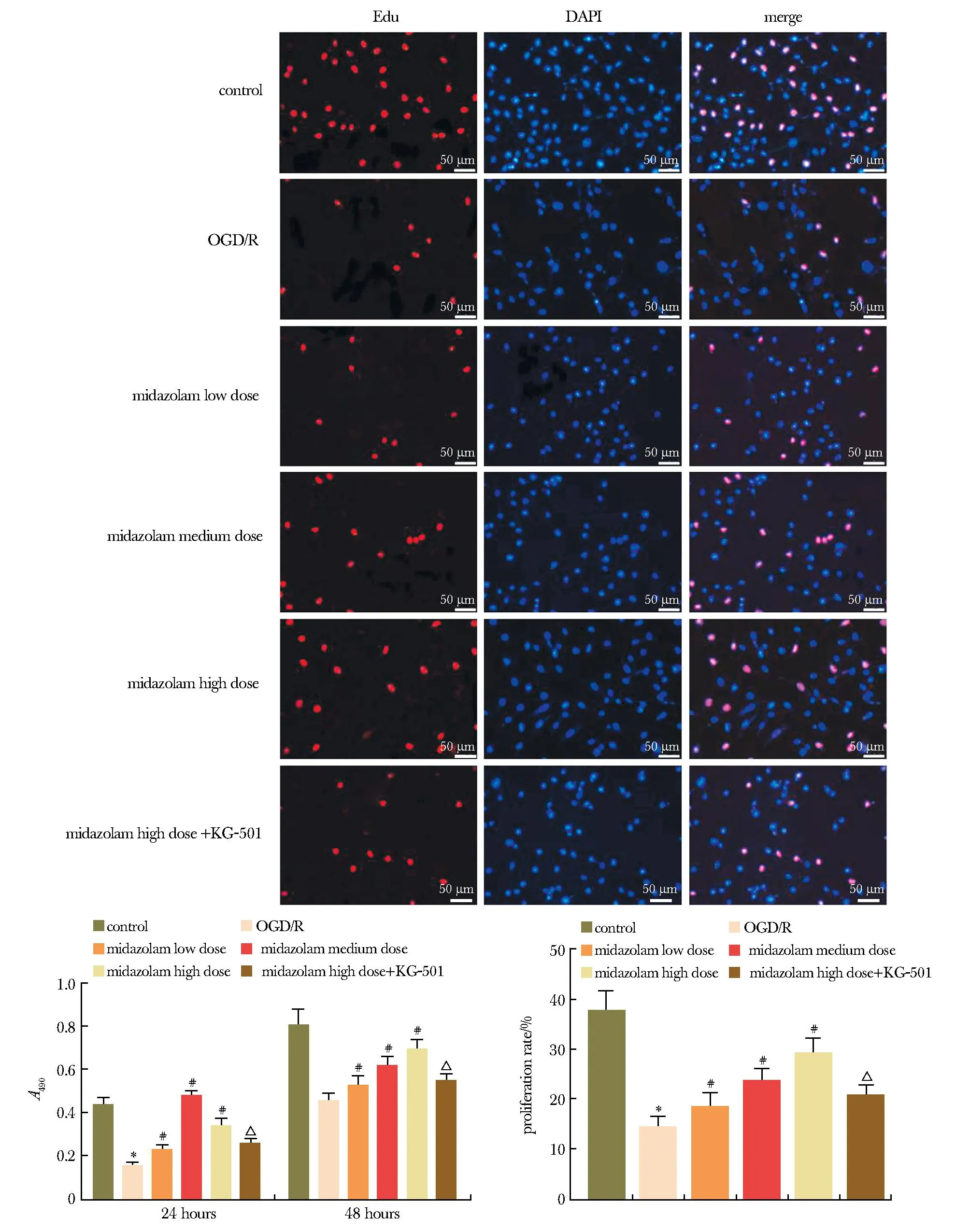
2.2 各分组HT22细胞凋亡率比较
与对照组相比,OGD/R组细胞凋亡率显著性升高(P<0.05);与OGD/R组相比,咪达唑仑低、中、高剂量组细胞凋亡率显著性降低,呈剂量依赖性(P<0.05);与咪达唑仑高剂量组相比,咪达唑仑高剂量+KG-501组凋亡率显著性升高(P<0.05)(图2)。
*P<0.05 compared with the control group; #P<0.05 compared with the OGD/R; △P<0.05 compared with the midazolam high dose group.
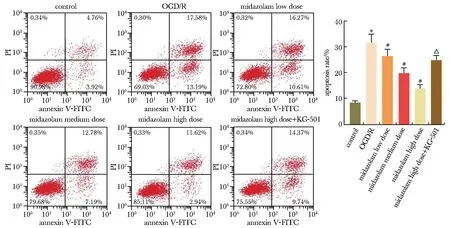
2.3 各分组细胞炎性因子TNF-α、IL-6水平比较
与对照组相比,OGD/R组细胞炎性因子TNF-α、IL-6水平显著性升高(P<0.05);与OGD/R组相比,咪达唑仑低、中、高剂量组细胞炎性因子TNF-α、IL-6水平显著性降低,呈剂量依赖性(P<0.05);与咪达唑仑高剂量组相比,咪达唑仑高剂量+KG-501组细胞炎性因子TNF-α、IL-6水平显著性升高(P<0.05)(图3)。
*P<0.05 compared with the control group; #P<0.05 compared with the OGD/R; △P<0.05 compared with the midazolam high dose group.
2.4 各分组HT22细胞SOD、CAT、MDA水平比较
与对照组相比,OGD/R组细胞SOD、CAT活性显著性降低,MDA含量显著性升高(P<0.05);与OGD/R组相比,咪达唑仑低、中、高剂量组细胞SOD、CAT活性显著性升高,MDA含量显著性降低,呈剂量依赖性(P<0.05);与咪达唑仑高剂量组相比,咪达唑仑高剂量+KG-501组细胞SOD、CAT活性显著性降低,MDA含量显著性升高(P<0.05)(图4)。
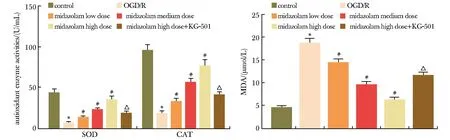
*P<0.05 compared with the control group; #P<0.05 compared with the OGD/R; △P<0.05 compared with the Midazolam high dose group.
2.5 各分组HT22细胞CREB mRNA和PGC-1α mRNA表达水平比较
与对照组相比,OGD/R组细胞CREB mRNA和PGC-1α mRNA表达水平显著性降低(P<0.05);与OGD/R组相比,咪达唑仑低、中、高剂量组细胞CREB mRNA和PGC-1α mRNA表达水平显著性升高,呈剂量依赖性(P<0.05);与咪达唑仑高剂量组相比,咪达唑仑高剂量+KG-501组细胞CREB mRNA和PGC-1α mRNA表达水平显著性降低(P<0.05)(图5)。
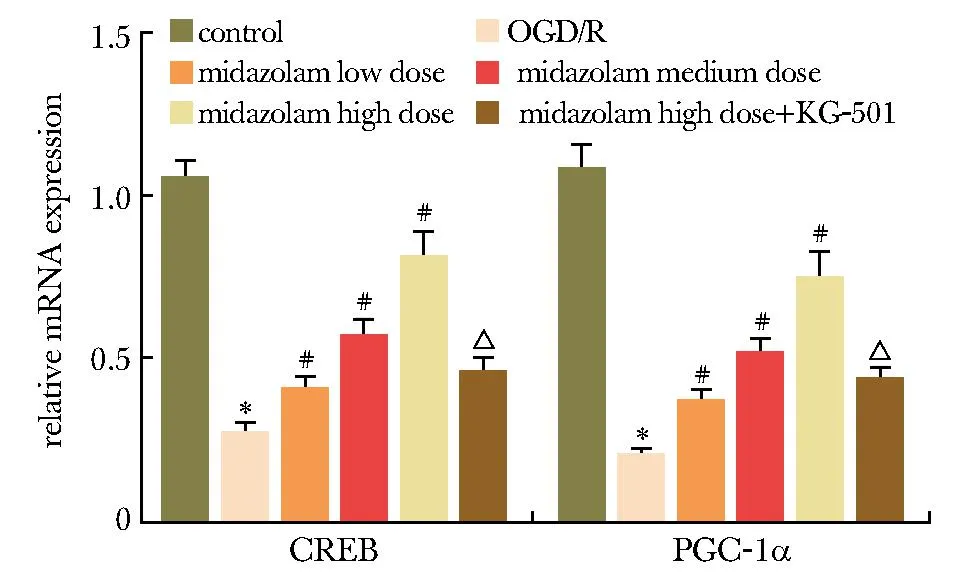
*P<0.05 compared with the control group; #P<0.05 compared with the OGD/R; △P<0.05 compared with the Midazolam high dose group.
2.6 各分组HT22细胞Ki-67、Bcl-2、Bax、CREB、PGC-1α蛋白表达比较
与对照组相比,OGD/R组细胞Ki-67、Bcl-2、CREB、PGC-1α蛋白表达水平显著性降低,Bax蛋白表达显著性升高(P<0.05);与OGD/R组相比,咪达唑仑低、中、高剂量组细胞Ki-67、Bcl-2、CREB、PGC-1α蛋白表达水平显著性升高,Bax蛋白表达显著性降低,(P<0.05);与咪达唑仑高剂量组相比,咪达唑仑高剂量+KG-501组细胞Ki-67、Bcl-2、CREB、PGC-1α蛋白表达水平显著性降低,Bax蛋白表达显著性升高(P<0.05)(图6,7)。
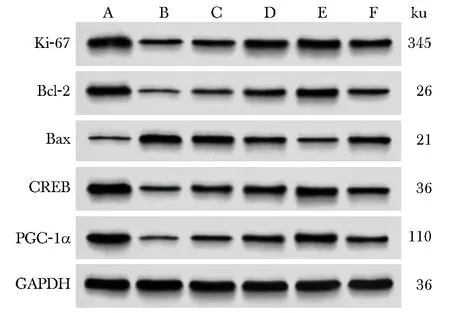
A.control; B.OGD/R; C.midazolam low dose group; D.midazolam medium dose group; E.midazolam high-dose group; F.midazolam high dose +KG-501 group.
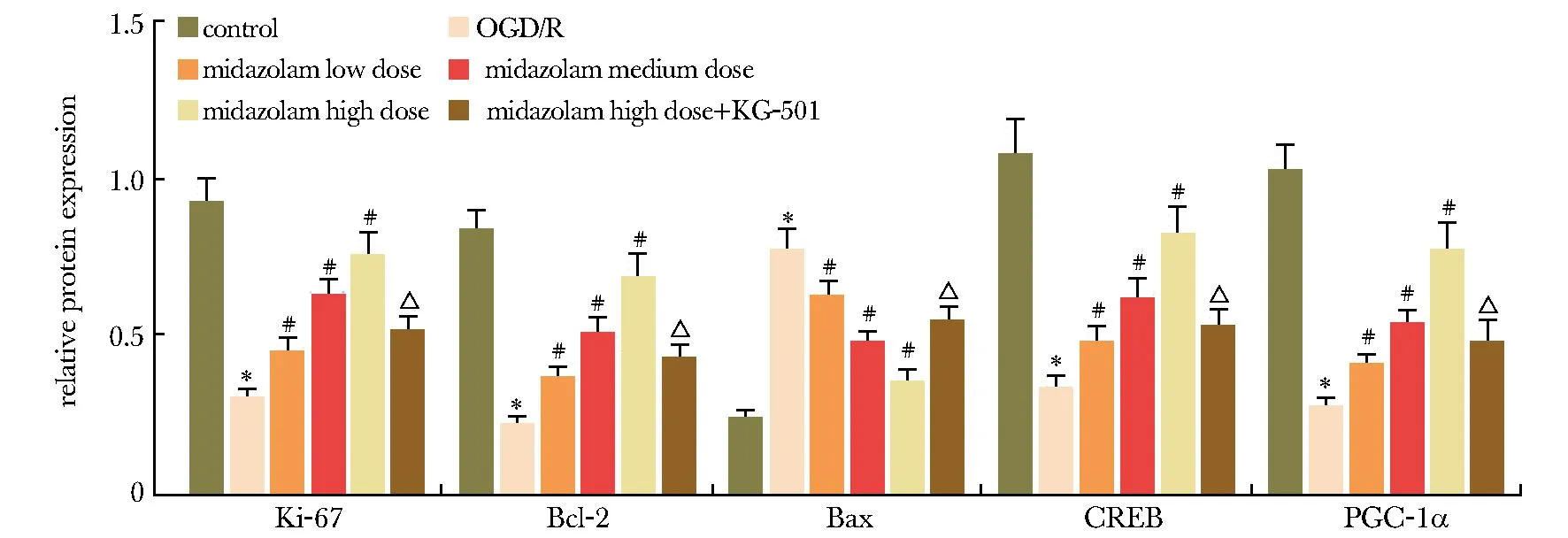
图7 不同剂量咪达唑仑处理的HT22细胞Ki-67、Bcl-2、Bax、CREB、PGC-1α蛋白表达比较
3 讨论
当大脑缺血缺氧时,脑组织出现代谢功能障碍,诱发神经细胞坏死和凋亡,最后导致神经功能障碍,严重者引起死亡,称之为缺血性卒中,其死亡率约占所有卒中87%[8]。该疾病是由多种病理过程共同作用的结果,研究表明,氧化应激和细胞凋亡在脑组织损伤中发挥重要作用,减小氧化应激和脑组织细胞凋亡成为研究重点[9]。本研究显示,OGD/R对HT22细胞造成一定损伤。
CREB是一种转录因子,参与许多生理过程,如增殖、分化、调节炎症等。CREB是调节PGC-1α表达的重要转录因子,而PGC-1α是一种转录共激活剂,可募集核受体或转录因子,并调节细胞核和线粒体中下游基因的转录。还可独立对抗ROS的产生,抑制NF-κB的途径,从而减少炎性的发生[14]。有研究表明脑活素可以激活CREB/PGC-1α信号通路减少神经炎来改善脑缺血损伤[14]。罗氟酞普兰通过激活CREB/PGC-1α信号通路来降低PD模型中神经细胞的炎性反应和细胞凋亡,从而改善神经细胞功能[15]。本实验研究结果显示,OGD/R可抑制HT22细胞中CREB和PGC-1α基因和蛋白表达。咪达唑仑干预可提高CREB和PGC-1α基因和蛋白表达。为验证该结论,在咪达唑仑干预基础上,添加KG-501处理,结果发现,KG-501可部分逆转咪达唑仑对OGD/R诱导HT22细胞的治疗作用。提示KG-501可减弱咪达唑仑对神经细胞的保护作用,加重细胞凋亡和损伤。
综上所述,咪达唑仑可减轻细胞炎性反应和氧化应激,降低细胞凋亡,促进细胞增殖,从而减轻OGD/R诱导的神经细胞损伤。本研究仅在细胞水平进行探究,后续还需进行动物实验验证。
