陆地棉FAX 家族的全基因组鉴定及GhFAX1 的功能分析
2024-04-17杨伟成孙岩杨倩王壮琳马菊花薛金爱李润植
杨伟成 孙岩 杨倩 王壮琳 马菊花 薛金爱 李润植
(山西农业大学分子农业与生物能源研究所,太谷 030801)
陆地棉是我国重要的经济纤维作物,也是世界上继大豆、油棕、油菜和向日葵之后的第五大油料作物,作为棉花重要副产物的棉籽,油含量可达25%-39%,是我国重要的植物油来源。棉籽油不仅为人体提供必需的脂肪酸营养,还可用于食品加工等。在工业上,棉籽油可用于生产肥皂、润滑油等溶剂,也是制备生物柴油的重要来源[1-2]。因此,研究棉籽脂肪酸代谢及其调控机制,对于提高种子含油量以及陆地棉生长发育调控等具有重要意义。
植物脂质不仅是人类食物和营养的主要来源,还是一种重要的工业原材料[3]。脂肪酸是植物脂质的重要组成部分,它们既是重要的储能物质,还是维持细胞膜结构完整和功能稳定的关键成分,参与植物对逆境胁迫应答等生物学过程[4]。
高等植物中脂肪酸的从头合成途径主要在质体中进行,这一过程是由脂肪酸合酶复合体催化的多次循环过程。其中新合成的部分脂肪酸会通过原核途径整合到质体内膜上,而大部分脂肪酸则会经过真核途径被运输至内质网中进行进一步的加工与修饰。尽管科学家们很早之前就已证实了游离脂肪酸可以跨过质体膜并向外运输,但却没有确切证实生物体内是否存在有效的负责脂肪酸跨过质体膜向外运输的蛋白。
2015 年,Li 等[5]首 次 从 拟 南 芥 中 克 隆 了Tmemb_14 蛋白亚家族成员(AtFAX1),亚细胞定位显示,该基因定位于质体内膜。研究发现拟南芥fax1 突变株内质网中脂质含量显著降低,而质体内的脂质含量却有明显增加,过表达AtFAX1 则表现出相反的结果,同时,过表达AtFAX1 可使酵母脂肪酸转运突变株的表型恢复至野生株的水平,证实了AtFAX1 具有介导质体内脂肪酸向外输出的功能。金龙飞等[6]发现,在油棕中过表达EgFAX1,油棕花和果实的油脂含量也呈现上升趋势。Li 等[7]在衣藻中过表达CrFAX1 和CrFAX2 可以显著提高藻细胞的油脂含量,并主要转运C16:0、C18:0 和C18:3,从而为TAG 和MGDG 的合成提供底物。同样,在红藻中过表达CmFAX1 也得到类似结果[8]。表明脂肪酸转运蛋白(fatty acid export, FAX)可通过脂肪酸转运途径来影响植物油脂的积累量。此外,研究还证明,不饱和脂肪酸及其衍生物参与调控植物对多种非生物胁迫的响应[9]。如多不饱和脂肪酸在质体膜中的含量影响膜脂的流动性,并影响植物对环境温度的适应性[10-11]。过表达水稻脂肪酸去饱和酶基因2(FAD2),能显著提高转基因水稻的抗寒性[12]。植物在热胁迫条件下,亚麻酸(C18:3)过氧化反应产生的丙二酸能够对光合作用相关蛋白进行修饰[13],而FAX 通过行使脂肪酸转运的功能在一定程度上能改变植物脂肪酸组分[14],因此,FAX 与植物胁迫反应密切相关。
本研究基于陆地棉全基因组和转录组数据,运用生物信息学分析方法,对陆地棉FAX 家族基因进行挖掘和功能分析,为分析陆地棉油脂积累的分子机制和油脂代谢工程提供了新的思路。
1 材料与方法
1.1 材料
本氏烟草(Nicotiana benthamiana)、大肠杆菌(Escherichia coli)DH5α 菌 株、 根 癌 农 杆 菌(Agrobacterium tumefactions)GV3101 菌种、植物表达载体pCAMBIA1300 和pCAMBIA1303,以及供试材料陆地棉品种翼丰1271 均由山西农业大学分子农业与生物能源研究所提供。
1.2 方法
1.2.1 陆地棉GhFAX 蛋白家族基因的鉴定及生理生化性质分析 根据已报道的拟南芥AtFAX1 蛋白序列,利用BLAST 搜索棉花基因组数据库CottonFGD(https://cottonfgd.org/),去除冗余后筛选得到GhFAXs基因,分别下载其编码蛋白序列、基因组序列及CDS 序 列, 利 用Pfam(http://pfam.xfam.org/) 及SMART(http://smart.embl‑heidelberg.de/)数 据 库 进行保守结构域鉴定,剔除不含Tmemb_14 结构域的蛋白序列。利用ExPASy‑ProtParam 网站(https://web.expasy.org/protparam/)在线分析棉花FAX 基因理化性质;TBtools 进行GhFAX 基因染色体定位;WoLF PSORT 在线工具(https://wolfpsort.hgc.jp/)进行亚细胞定位预测。
利用MEGA7 软件对棉花FAX 基因家族蛋白序列进行比对,采用邻接法构建系统发育进化树,通过在线软件iTOL(https://itol.embl.de/)进行绘图。使用在线工具GSDS(http://gsds.gao‑lab.org/index.php)对陆地棉FAX 基因家族进行结构分析,MEME(http://meme‑suite.org/)预 测 棉 花FAX蛋白保守基序。通过Plant CARE(https://ngdc.cncb.ac.cn/databasecommons/database/id/5261)在线网站对PRX 基因上游2 000 bp 序列进行顺式作用元件分析,采用TBtools 软件进行整合绘图。
1.2.2 转录组表达分析 在BRAD 数据库中下载转录组数据,对陆地棉FAX 基因在根、茎、叶、果实、花,以及前中后3 个时期胚珠中的表达情况进行分析,用TBtools 软件绘制表达热图。
1.2.3 GhFAXs 表达分析 提取棉花根、茎、叶,以及前中后3 个时期胚珠的RNA,并反转录合成cDNA。根据GhFAX 基因的CDS 序列,设计qPCR引物,以棉花histone 为内参基因,进行荧光定量分析。采用2-ΔΔCT法计算基因的相对表达量。
1.2.4 GhFAX1 的亚细胞定位 构建35S∷GhFAX‑1∷GFP 亚细胞定位载体,将正确的重组载体农杆菌接种于含卡那霉素和利福平的LB 液体培养基中,以35S∷GFP 空载农杆菌为对照,28℃ 100 r/min 过夜培养至OD600为0.4-0.6。4℃ 5 000 r/min 离心8-10 min,收集菌体沉淀。用现配的侵染液重悬菌体沉淀,将菌液浓度调至OD600约为0.2,室温避光孵育2-4 h 后侵染烟草叶片。选取长势一致且生长健壮、颜色鲜绿的烟草幼苗(6 周龄)为试验材料,用现配的侵染液注射侵染,浸染2 d 的烟草撕取其表皮细胞,在激光共聚焦显微镜下观察并拍照。
1.2.5 GhFAX1 表达载体的构建 试验所用的植物表达载体pCAMBIA1303 由CaMV35S 启动子驱动,含有卡那霉素抗性。选择Xba I 和Kpn I 为酶切位点设计同源臂引物,使用同源臂引物扩增GhFAX1,同时对pCAMBIA1303 用Xba I 和Kpn I 进行双酶切反应,酶切产物经回收纯化后,用DNA 连接酶连接,得到重组表达载体pCAMBIA1303‑GhFAX1。然后,将其转入大肠杆菌,经PCR 和双酶切试验鉴定阳性克隆。酵母表达载体为pYES2.0,含URA3 位点和氨苄青霉素抗性。选择Xba I 和BamH I 为酶切位点设计同源臂引物,使用同源臂引物扩增GhFAX1,连入pYES2.0 中形成重组酵母表达载体pYES2.0‑GhFAX1,转到大肠杆菌DH5α 并验证成功。
1.2.6 转基因酵母鉴定与底物偏好性试验 酿酒酵母菌株INVSc1 在YPD 培养基中于28℃、220 r/min振荡培养,当OD600为0.5 左右时,离心收集细胞,用无菌水洗涤。将上述构建成功的酵母表达载体pYES2.0‑GhFAX1 转入酵母中,经过缺尿嘧啶(SC‑URA)培养基筛选和PCR 鉴定出阳性转基因酵母。选取阳性转基因酵母菌液,接种到已经外源添加C16:0、C18:0、C18:1、C18:2 的SC‑URA 液体培养基中,30℃振荡培养96 h,在0、4、8、12、24、36、48、72 和96 h 时,使用分光光度计在OD600下检测转基因酵母生长情况,收集菌体沉淀物置于‑80℃保存,使用真空冷冻干燥机对其进行冷冻干燥,研磨成粉末,常温保存备用。
1.2.7 转基因烟草的获取 构建pCAMBIA1303‑GhFAX1 植物表达载体,将目的基因片段与双酶切且纯化后的pCAMBIA1303 载体相连接。采用农杆菌介导的叶盘法进行烟草遗传转化,把含有外源基因GhFAX1 的农杆菌扩繁,以潮霉素作为筛选标记,将植物表达pCAMBIA1303‑GhFAX1 重组质粒转入烟草中,以获得转基因植株。
2 结果
2.1 GhFAX基因家族鉴定及理化性质分析
以拟南芥数据库中的FAX 家族蛋白序列为基础,通过序列比对,在陆地棉全基因组一共发现12 条FAX 同源序列;基因主要分布在A、D 两个亚组中,根据基因在染色体的分布位置,将处于scaffold_93 的基因命名为GhFAX1,分布于A 亚组FAX 基因从A01 染色体开始,分别命名为GhFAX2-GhFAX6;分布D 亚组的从D01 染色体开始,分别命名为GhFAX7-GhFAX12。
GhFAX 家族基因编码蛋白序列长度差距较大,蛋白序列最长的为GhFAX3,由325 个氨基酸构成;最短蛋白序列为GhFAX2,只含有92 个氨基酸。对GhFAX 家族蛋白的等电点进行预测,除GhFAX10的等电点小于7 外,其余GhFAX 蛋白等电点均高于7。根据不稳定系数结果表明,GhFAX1、GhFAX10、GhFAX8、GhFAX3 的不稳定系数大于40,为不稳定蛋白;其余8 个GhFAX 蛋白均表现为稳定蛋白。GhFAX10、GhFAX8、GhFAX3 的亲水指数为负数,表明这3 个蛋白为亲水性蛋白;其余9 个GhFAX蛋白均表现为疏水性蛋白(表1)。使用TargetP 软件对GhFAX 家族蛋白进行亚细胞定位预测发现,GhFAX 家族蛋白都定位于质体中。对GhFAX 家族蛋白进行信号肽预测发现,GhFAX 家族蛋白不含信号肽。
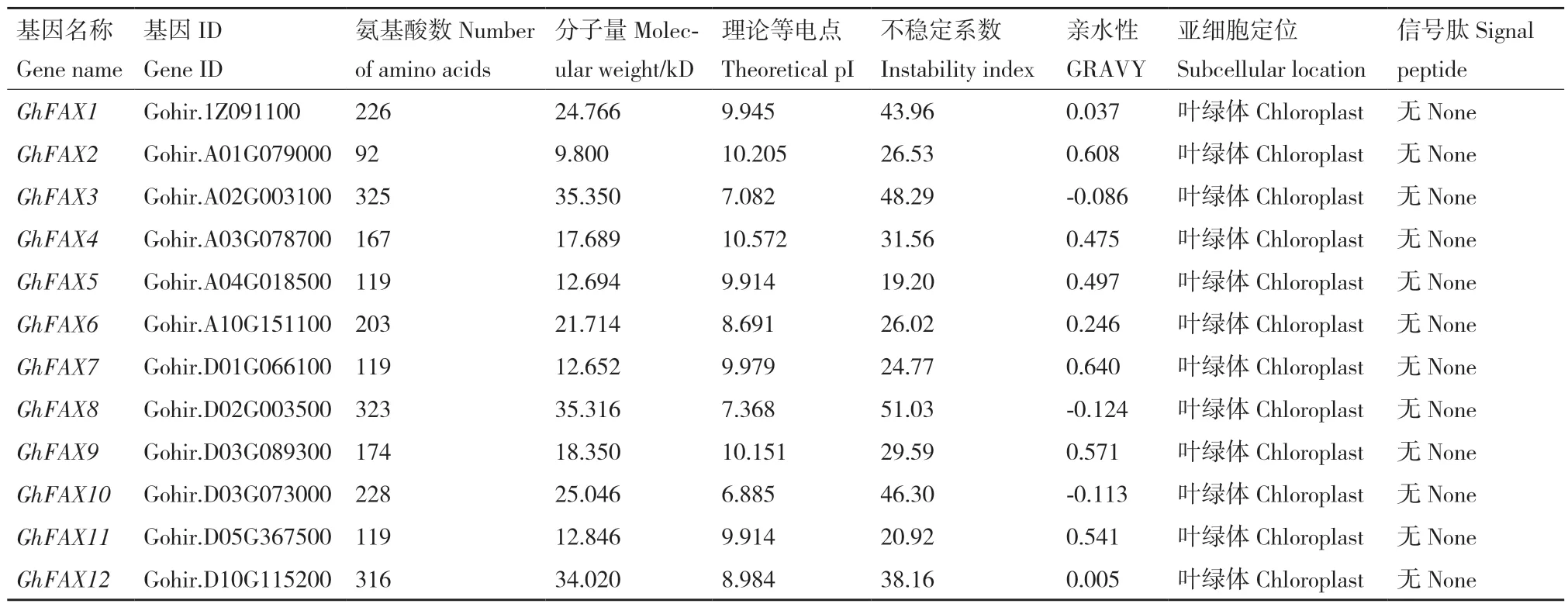
表1 棉花FAX 家族蛋白性质分析Table 1 Analysis of the properties of the FAX family proteins in G.hirsutum
2.2 陆地棉FAX家族蛋白序列对比与进化树分析
通过对陆地棉FAX 家族蛋白与拟南芥FAX 家族蛋白的氨基酸序列进行比对,结果(图1)表明,FAX 家族蛋白的氨基酸序列相似度较低,只有少数位置的氨基酸具有保守性。其中保守性强的氨基酸为G、S、V、L、I、Y、K、F,这些保守的氨基酸可能对于FAX 家族蛋白的功能较为重要。
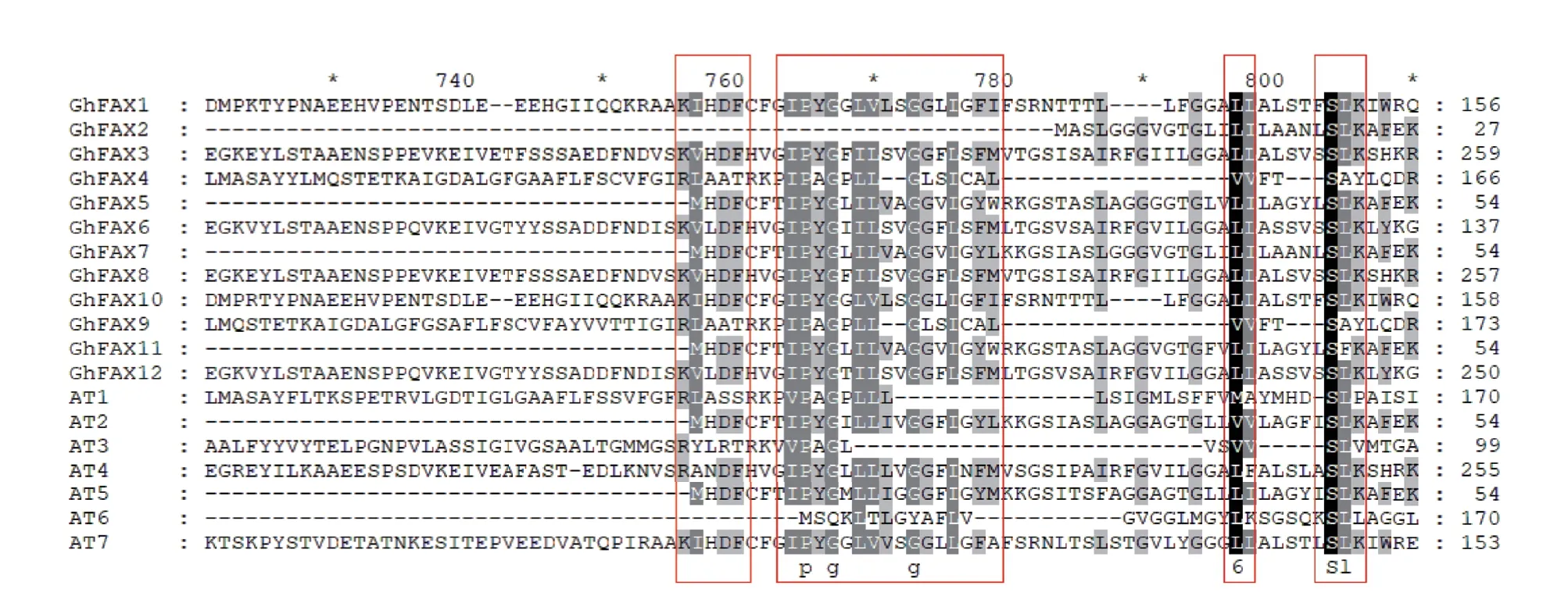
图1 陆地棉FAX 家族蛋白氨基酸序列比对Fig.1 Multiple sequence alignment of FAX family protein in G.hirsutum
为确定棉花种内FAX 蛋白的进化关系,对陆地棉(Gossypium hirsutum)、海岛棉(G.barbadense)、亚洲棉(G.arboreum)、雷蒙德氏棉(G.raimondii)的FAX 的氨基酸序列进行系统进化树分析(图2), 共 分 为3 个 类 群, 陆 地 棉 中 的GhFAX4、GhFAX9 与海岛棉中的GbFAX4 和GbFAX11、亚洲棉GaFAX2、雷蒙德氏棉GrFAX3 为第一组;陆地 棉 中 的4 个FAX 家 族 蛋 白GhFAX2、GhFAX5、GhFAX7、GhFAX11,与 海 岛 棉 中 的7 个FAX 家族 蛋 白GbFAX1、GbFAX5、GbFAX6、GbFAX8、GbFAX12、GbFAX13、GbFAX15, 亚 洲 棉 中 的3个FAX 家族蛋白GaFAX1、GaFAX5、GaFAX6,以及雷蒙德氏棉中的3 个FAX 家族蛋白GrFAX1、GrFAX2、GrFAX6,共计17 个FAX 蛋白为第二组;陆地棉中的6 个FAX 家族蛋白GhFAX1、GhFAX3、GhFAX6、GhFAX8、GhFAX10、GhFAX12, 海 岛棉 中 的6 个FAX 家 族 蛋 白GbFAX2、GbFAX3、GbFAX7、GbFAX9、GbFAX10、GbFAX14, 亚洲 棉 中 的3 个FAX 家 族 蛋 白GaFAX3、GaFAX4、GaFAX7,以及雷蒙德氏棉中的3 个FAX 家族蛋白GrFAX4、GrFAX5、GrFAX7, 共 计18 个FAX 蛋白为第三组。第三组中FAX 蛋白最多,含有18 个FAX 蛋白,占4 种棉花FAX 家族蛋白的43.9%;对第三组蛋白序列具体分析发现,这组蛋白序列基本以3 种FAX 蛋白为1 小组,共有6 小组,每小组蛋白基本处于1 个陆地棉FAX 家族蛋白+1 个海岛棉FAX 家族蛋白+1 个亚洲棉FAX 家族蛋白或者1 个雷蒙德氏棉FAX 家族蛋白。
2.3 GhFAXs基因的染色体定位与共线性分析
GhFAXs 基因较为均匀地分布在10 条染色体上(图3),其中,GhFAX9 和GhFAX10 分布在D03 染色体。为了挖掘GhFAX 基因家族的进化扩张与棉花全基因组复制事件的关系,利用TBtools 中的One Step MCScanX分析了GhFAX基因家族内的复制基因,共有10 个GhFAXs 基因参与了基因复制,占GhFAXs基因总数量的83.33%。如图3 所示,GhFAXs 基因只存在片段复制,共有13 对片段复制基因分布在10 条染色体上。表明片段复制是陆地棉FAX 进化扩张的驱动力。
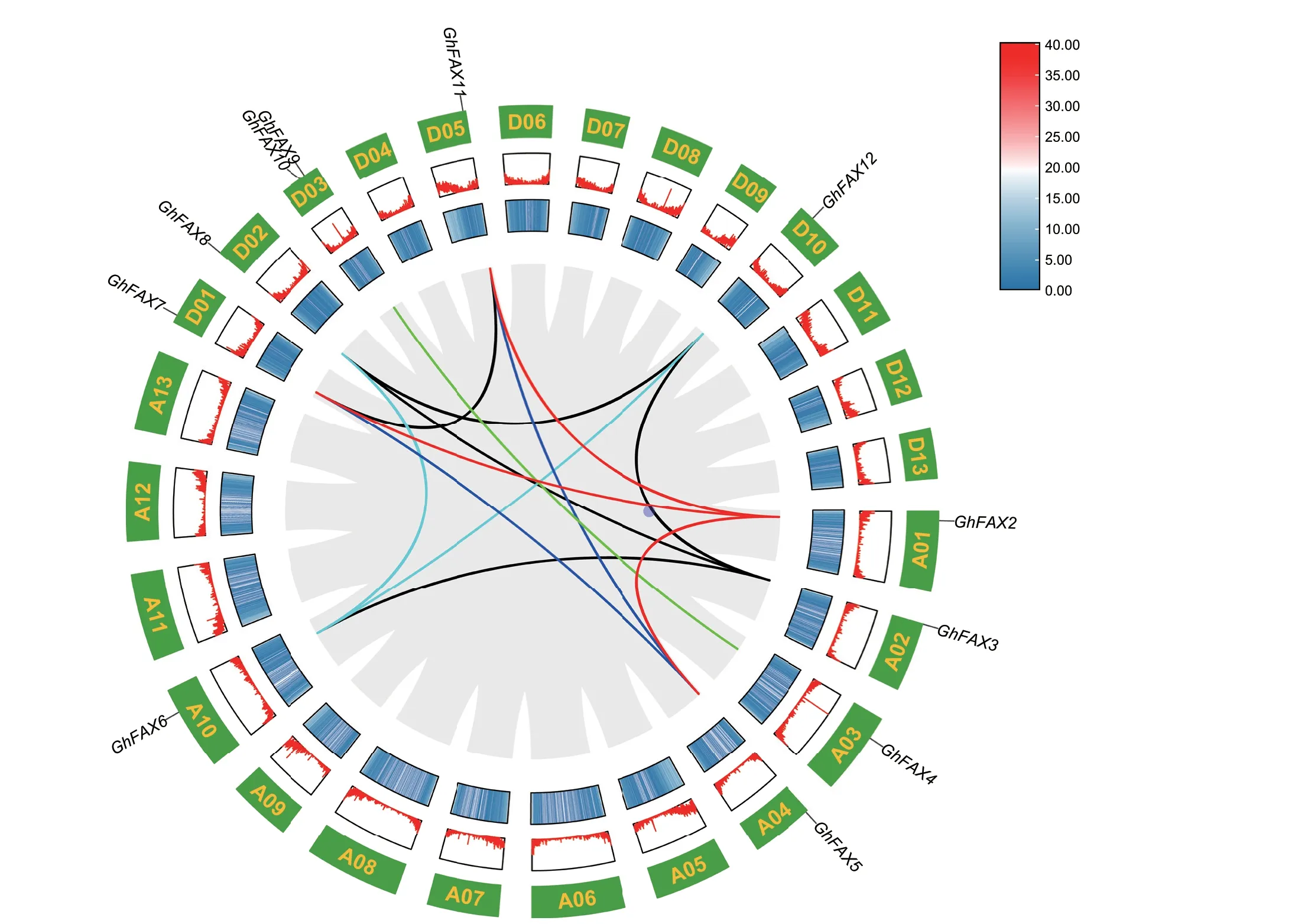
图3 陆地棉GhFAXs 基因在染色体上的分布Fig.3 Distribution of GhFAXs genes on the chromosomes of G.hirsutum
2.4 GhFAXs基因结构及基因保守基序分析
在陆地棉FAX 基因家族蛋白序列的进化树基础上进行保守基序分析,结果(图4‑A)显示,GhFAXs 基因可分为4 个类群,GhFAX4、GhFAX9 为类群一;GhFAX3、GhFAX6、GhFAX8、GhFAX12 为类 群 二;GhFAX1、GhFAX10 为 类 群 三;GhFAX2、GhFAX5、GhFAX7、GhFAX11 为类群四。亲缘关系越近的成员其基序结构越相似,整个GhFAX 共有3种Motif,且除个别蛋白外,都相对不保守(图4‑B)。其 中GhFAX2 只 含 有Motif 2;GhFAX4、GhFAX9只 含 有Motif 1;GhFAX5、GhFAX7、GhFAX11 含有Motif1、Motif2;GhFAX1、GhFAX3、GhFAX6、GhFAX8、GhFAX10、GhFAX12 包含3 种Motif。
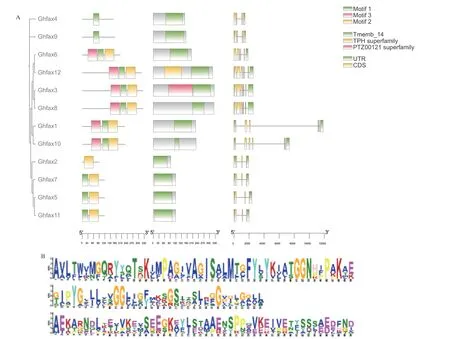
图4 陆地棉FAX 家族基因结构(A)与氨基酸构成分析(B)Fig.4 Analysis of FAX family gene structure(A)and amino acid composition(B)in G.hirsutum
对陆地棉FAX 基因家族蛋白进行结构域分析,结果(图4‑A)表明,GhFAX 家族均含有Tmemb_14功能结构域;除此之外,GhFAX12 还含有TPH superfamily,GhFAX3 含有PTZ00121 superfamily。
基因结构分析结果表明(图4‑A),类群四中GhFAX 家族基因均含有3 个外显子;类群一中,GhFAX 家族基因均含有4 个外显子;在类群二中,仅GhFAX6 含 有5 个 外 显 子,GhFAX3、GhFAX8、GhFAX12 含有6 个外显子;类群三中,GhFAX 家族基因均含有6 个外显子。结合蛋白序列进化树和基因结构结果发现,陆地棉基因结构差异与蛋白序列之间的进化关系基本保持一致。
2.5 GhFAXs基因启动子顺式作用元件分析
通过对GhFAX 家族启动子区域的顺式作用元件进行预测,进一步解析GhFAXs 基因的生物学功能(图5)。根据功能不同,这些顺式作用元件主要分为3 类,第一类主要包括生长发育相关作用元件,包括分生组织表达元件、胚乳表达元件、玉米醇溶蛋白代谢调节元件;第二类为激素应答元件,例如水杨酸响应元件、脱落酸响应元件、生长素响应元件、茉莉酸甲酯响应元件、赤霉素响应元件等;第三类为环境或胁迫应答元件,包括光响应元件、参与干旱诱导、参与低温反应、昼夜调控、防御与应激、厌氧诱导元件。在这3 类顺式作用元件中,参与环境或胁迫应答元件最多,共有142 个元件,其中参与光响应元件最多,共有36 个。在GhFAX 家族中,GhFAX12 含有最多的顺式作用元件,共有48个,其中茉莉酸甲酯响应元件最多,共有16 个,除此外GhFAX12 启动子中含有最多响应胁迫的顺式作用元件,推测GhFAX12 可能会参与陆地棉胁迫响应。
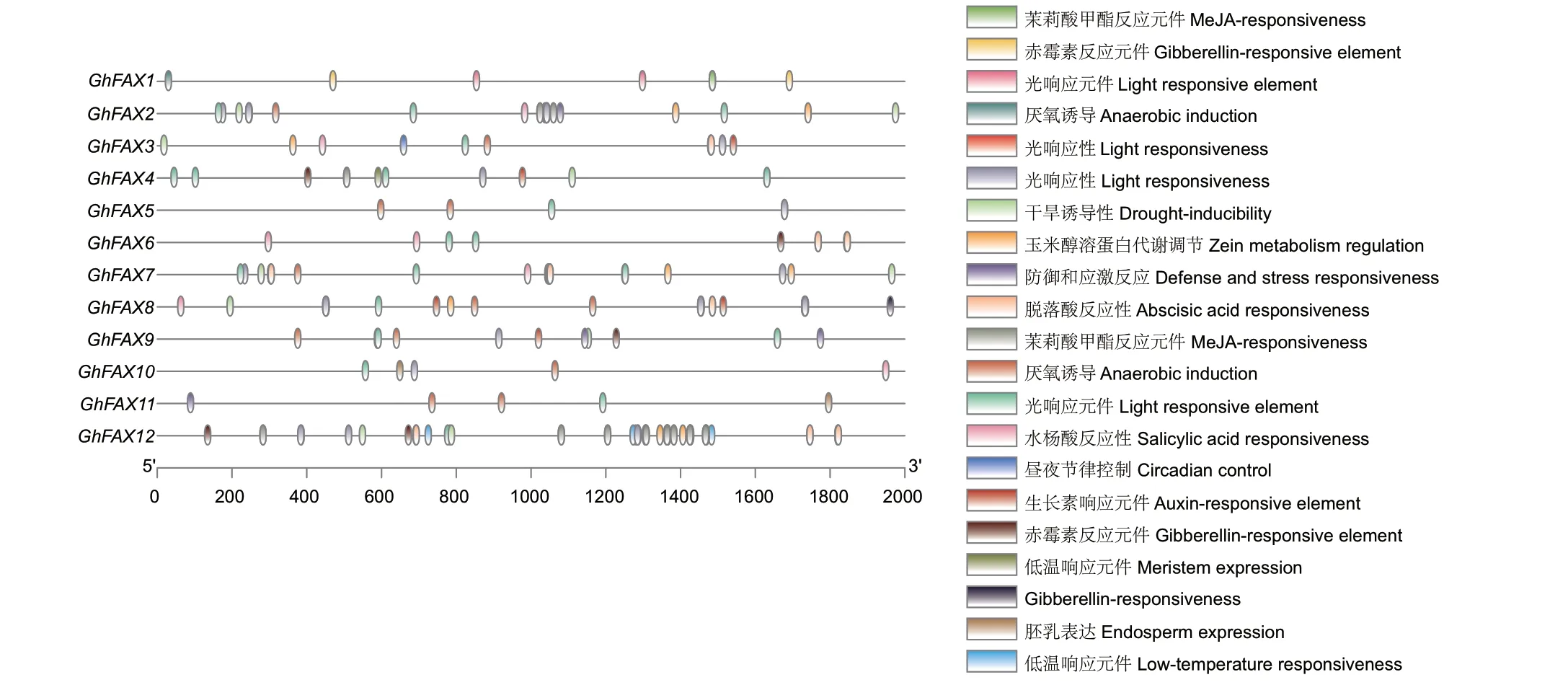
图5 陆地棉GhFAXs 基因的启动子顺式作用元件分析Fig.5 Cis-acting elements analysis of GhFAXs genes in G.hirsutum
2.6 GhFAX家族蛋白跨膜结构和三级结构分析
为了分析GhFAX 家族蛋白空间结构的差异,利用SWISS‑MODEL 对GhFAX 家族蛋白进行三维结构预测。结果(图6)表明,尽管GhFAX 家族蛋白氨基酸数量和组成差异很大,但三维结构预测结果显示,GhFAX 家族蛋白三维结构较为相似,除GhFAX2 含有3 个α 螺旋、GhFAX10 含有2 个α 螺旋外,其余10 个GhFAX 家族蛋白均含有4 个α 螺旋。利用TMHMM 在线软件对GhFAX 家族蛋白跨膜结构域进行分析,结果(图6)表明,尽管GhFAX家族蛋白在序列长度和蛋白基序上保守性较低,但均包含跨膜结构域,1 个GhFAX 含有2 个跨膜结构,5 个GhFAX 含有3 个跨膜结构,6 个GhFAX 含有4个跨膜结构。GhFAX 家族蛋白跨膜结构的位置与α螺旋的分布一致,说明在GhFAX 家族蛋白中蛋白的膜定位与α 螺旋相关。由于GhFAX 家族蛋白均含有跨膜结构域,结合其可能具有的脂肪酸转运活性,推测GhFAX 家族蛋白可能位于内质网、过氧化物酶体或者质膜参与脂肪酸转运。

图6 陆地棉FAX 家族蛋白跨膜结构域与三维结果预测Fig.6 Transmembrane domain and 3D result prediction of the FAX family proteins in G.hirsutum
2.7 GhFAXs家族基因的基因组织转录组分析
转录组数据表明(图7),在冷胁迫下,GhFAX家族中GhFAX9 从开始1-6 h 时持续高表达,并在6 h 达到峰值,与对照相比具有极显著差异,推测该基因在陆地棉响应冷胁迫过程中具有正向调控作用,GhFAX5 和GhFAX11 在受到冷胁迫1 h 后,表达量持续下降,推测该基因在陆地棉响应冷胁迫过程中具有负向调控作用。
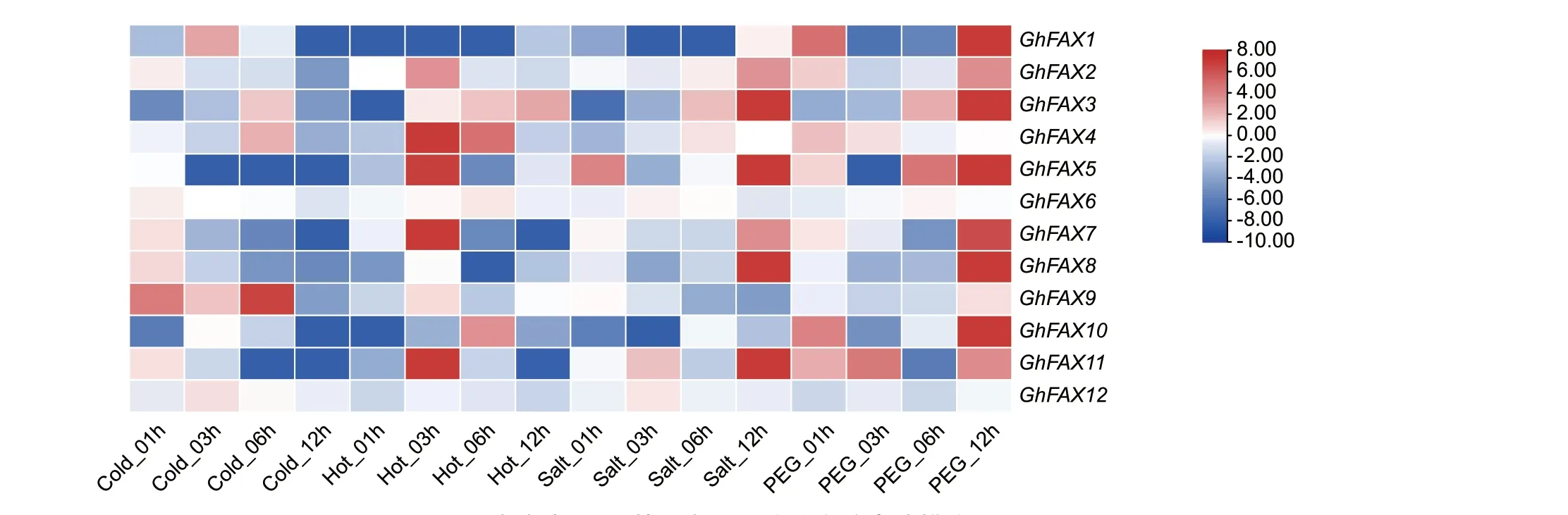
图7 陆地棉FAX 基因在不同胁迫中的表达模式Fig.7 Expression patterns of FAX genes in G.hirsutum under different stresses
在高温胁迫下,GhFAX 家族中GhFAX1、Gh‑FAX10 在刚开始胁迫时表达量迅速下降,但在后期逐渐恢复;GhFAX3 在高温胁迫3 h 后随着胁迫时间的增加,表达量也在持续上升,推测该基因在陆地棉响应高温胁迫过程中具有正向调控作用。
在盐胁迫下,GhFAX1、GhFAX9、GhFAX10 的表达量下降,其中GhFAX1 与GhFAX10 在胁迫后3 h 表达量到达最低,GhFAX9 在受到盐胁迫后,表达量持续下降,推测该基因在陆地棉响应盐胁迫过程中具有负向调控作用。
在PEG 胁迫下,GhFAX10 在胁迫12 h 时有着显著高表达;GhFAX6 在受到胁迫后表达量基本不变;GhFAX12 在受到PEG 胁迫后表达量一直处于下降状态,推测该基因在陆地棉响应PEG 胁迫过程中具有负向调控作用。
综上所述,冷胁迫下,GhFAXs 基因表达量出现上调的家族成员有10 个,表达量出现下调的家族成员有2 个;高温胁迫下,GhFAXs 基因表达量出现上调的家族成员有10 个,表达量出现下调的家族成员有2 个;盐胁迫下,GhFAXs 基因表达量出现上调的家族成员有9 个,表达量出现下调的家族成员有3 个;PEG 胁迫下,GhFAXs 基因表达量出现上调的家族成员有11 个,表达量出现下调的家族成员有1 个。
2.8 GhFAXs基因表达模式分析
为鉴定GhFAXs 基因在陆地棉中的时空表达特性,提取陆地棉的根、茎、叶、花及不同发育时期的种子(开花后5、15 和35 d)的RNA,进行RT‑PCR 和RT‑qPCR 检测。结果(图8)显示,FAX 家族基因在棉花根、茎、叶、花和胚珠等组织中均有表达,因此,陆地棉FAX 家族基因均为组成型表达基因,具有广谱表达特性。通过对陆地棉不同组织中FAX 基因表达情况进行对比发现,GhFAX4、GhFAX10 在陆地棉花中表达量高于其他组织,GhFAX7、GhFAX9 在陆地棉茎中表达量高于其他组织,GhFAX1、GhFAX9、GhFAX12 在陆地棉FAX 家族基因表达中明显高于其他基因,推测这些基因可能在陆地棉发育和油脂转运积累过程中发挥主要作用。

图8 陆地棉FAX 家族基因表达模式分析Fig.8 Analysis of gene expression patterns of FAX family
2.9 GhFAX1蛋白亚细胞定位分析
选择在各个组织表达量较高的GhFAX1 构建载 体,将 构 建 好 的35S∷GhFAX1∷GFP 载 体 和pCAMBIA1300 空载体(对照)通过农杆菌介导法注射侵染本氏烟草叶片,进行瞬时表达,在共聚焦显微镜下观察GFP 荧光信号(图9),空载体的荧光信号分布在细胞膜、细胞质和细胞核上,而35S∷GhFAX1∷GFP 的荧光信号只分布在质体上,表明GhFAX1 定位于质体。

图9 GhFAX1 蛋白的亚细胞定位分析Fig.9 Subcellular localization analysis of GhFAX1 protein
2.10 过表达GhFAX1酵母的总脂肪酸含量与底物偏好性分析
为研究GhFAX 的具体功能,将GhFAX1 连接到酵母表达载体pYES2.0 上,获得pYES2.0‑GhFAX1,将转化成功的GhFAX1 过表达酵母进行总脂肪酸含量测定(图10),与野生型酵母相比,转空载pYES2.0 酵母的总脂肪酸含量并无明显变化,说明pYES2.0 载体并不影响酵母本身的生长与油脂合成。与转空载酵母相比,GhFAX1 过表达酵母中总脂肪酸比对照提高了3.53%。说明GhFAX1 参与了酵母的脂肪酸代谢并能够提高酿酒酵母的总脂肪酸含量。为了进一步研究GhFAX1 对4 种常见底物(C16:0、C18:0、C18:1、C18:2)的偏好,将这4 种脂肪酸外源性加入酵母培养基中,观察酵母在96 h 的生长情况(图11),GhFAX1 转基因酵母在底物为C16:0 与C18:0 时生长曲线明显高于野生型酵母INVSc1,表明GhFAX1 对含有C16:0、C18:0 底物具有选择性。
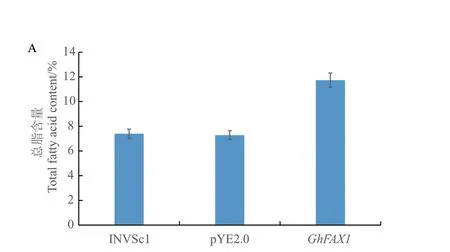
图10 转基因酵母总脂肪酸含量Fig.10 Total fatty acid content of transgenic yeast

图11 转基因酵母在外源添加脂肪酸下生长指标Fig.11 Transgenic yeast growth indicators under exogenous added fatty acids added fatty acids
2.11 过表达GhFAX1烟草光合与总脂肪酸含量分析
叶绿素是质体的重要组成部分,为探究Gh‑FAX1 对质体的影响,分别在5 株GhFAX1 过表达植株中选取生长情况良好且长势一致的2 株转基因烟草,使用SPAD502 叶绿素仪测定GhFAX1 过表达和野生型烟草叶片叶绿素含量(图12‑A),GhFAX1 的表达促进了转基因烟草叶绿素含量提高13.24%和11.8%。为进一步探究GhFAX1 对烟草叶绿素具体功能的影响,以野生型烟草作为对照,检测GhFAX1过表达烟草叶绿素荧光参数(图12‑B),GhFAX1 过表达烟草较野生型烟草的F0有明显降低,证明Gh‑FAX1 的表达提高了烟草叶绿素的稳定性;过表达烟草较野生型烟草在Fm、Y(II)、ETR 上有明显提高,说明GhFAX1 的表达提高了烟草叶片PSII 的电子传递,提高了烟草叶片PSII 光能转换率,提升了PSII的反应活性。为了验证GhFAX1 在脂肪酸生物合成和油脂积累过程中的功能,对2 株过表达烟草取样,测定总脂含量(图12‑E),以野生的烟草叶片为对照,GhFAX1 过表达烟草叶片总脂肪酸含量提高了5.2%与4.93%。结果表明,GhFAX1 可以促进脂肪酸的积累。测定了过表达烟草叶片的可溶性糖、淀粉以及蛋白的含量(图12‑C-D、图12‑F),与野生型烟草叶片相比,过表达烟草叶片蛋白的含量有显著下降趋势。综上所述,GhFAX1 过表达使烟草叶片总脂的提高,同时GhFAX1 可以使蛋白合成途径上的碳源更多地流向油脂合成途径。

图12 转基因烟草叶片叶绿素含量(A)、相关荧光参数(B)和转基因烟草蛋白含量(C)、淀粉(D)、叶片总脂肪酸(E)、可溶性糖(F)及转基因烟草种子千粒重(G)与总脂肪酸含量(H)Fig.12 Chlorophyll content(A), relevant fluorescence parameters(B), total fatty acid(C), soluble sugar(D), starch(E),protein content(F), 1 000-grain weight(G)and total fatty acid content(H)in transgenic tobacco leaves
标准栽培条件下,2 株GhFAX1 过表达烟草分别随机选取种子,称量其千粒重,重复称量3 次,结果(图12‑G)发现,GhFAX1 过表达烟草的种子千粒重较野生型烟草显著增加。转基因种子的千粒重较野生型种子质量分别增加了近19.1%与16%。收集转基因烟草和野生型烟草植株的种子进行油脂提取(图12‑H),与野生型相比,转基因烟草种子含油量分别提高了6.18%与6.52%,说明GhFAX1在烟草中能够显著提升种子含油量。
3 讨论
3.1 GhFAX基因家族在棉花属中的演化与扩张机制
根据数据库显示,棉花属中的FAX 基因在品种进化中有明显的数量规律,表明棉花属中FAX 基因家族在历史中经历过一定的扩张。根据已有的研究表明,基因组多倍化事件与片段复制有助于植物中基因家族的扩展。陆地棉中FAX 基因家族成员可能来自基因组多倍化与片段复制。复制事件分别发生在115-146 百万年和13-20 百万年前的亚洲棉和雷蒙德氏棉,随后是通过一万年前2 个现存祖亲的杂交和多倍体化形成的陆地棉和海岛棉。因此,四倍体陆地棉中的FAX 基因数量可能取决于亚洲棉和雷蒙德氏棉的数量[15-17]。通过进化树分析,在整个棉属中,陆地棉FAX 基因的进化与亚洲棉、雷蒙德氏棉紧密相关,陆地棉FAX 基因家族的染色体分布也表明,该家族中的基因相对均匀的分布在整个棉花染色体上。因此,片段重复事件有助于棉花中FAX家族的扩增[18-20]。
3.2 FAX基因在植物脂肪酸转运中的关键作用及其对陆地棉生长发育的研究
已有研究证明FAX 是参与植物脂肪酸转运的一种跨膜蛋白[21]。在拟南芥fax1 突变体中,拟南芥的生物量和花粉繁殖力显著降低,脂质合成减少,突变植物身材矮小。结果表明,FAX1 的缺失会影响拟南芥的生长发育[5]。在本研究中,GhFAX4 在花中表达较高,这可能与其参与陆地棉雄性发育等过程有一定的相关性。GhFAX9 在茎中表达较高,这可能与其参与陆地棉侧芽生长等过程有一定的相关性。对于GhFAX1、GhFAX12 在陆地棉胚珠中表现为高表达,这与棉籽油脂积累合成和积累过程相吻合,推测可能在棉籽发育和油脂转运积累过程中发挥主要作用,后续有必要对上述家族基因成员功能进行进一步验证。
3.3 陆地棉FAX家族蛋白的理化性质及功能
对陆地棉FAX 家族蛋白理化性质进行分析,陆地棉FAX 家族同时含有亲水性和疏水性成员,这可能与FAX 蛋白结合疏水性脂肪酸从而实现跨膜转运功能相关。GhFAX 家族蛋白均富含α-螺旋,这与其膜定位具有一定的相关性。这一结果与前人对拟南芥和水稻FAX 家族研究结果具有一致性[21]。继续对GhFAX 进行亚细胞定位预测发现,GhFAX 蛋白定位在叶绿体中,叶绿体作为植物脂肪酸合成的主要场所,因此,GhFAX 可能参与脂肪酸相关功能,这与植物油脂合成其他关键酶家族蛋白亚细胞定位差异结果相似。顺式作用元件是决定植物基因启动子能否正确调控基因表达的关键[22]。研究发现,陆地棉GhFAX 基因的启动子作用元件主要与胁迫应答相关,对GhFAX 在各种胁迫下的表达进行研究发现,在受到胁迫后,陆地棉GhFAX 基因大部分进行上调,因此GhFAX 可能参与陆地棉逆境胁迫响应或生长发育调控过程。
3.4 外源基因GhFAX1在酿酒酵母中的表达及其对脂质合成与底物选择的影响
酿酒酵母(INVSc1)是一种典型的真核生物,具有分离的亚细胞结构和核膜。目前,已有细菌[23]、真菌[24]、动物[25]、植物[26]的外源基因利用酵母表达系统验证其基因功能。王丽艳[27]将油莎CePAP2转入酵母细胞中,结果发现重组酵母细胞的DAG 含量和总油脂含量均显著提升;试验将GhFAX1 转入酵母中,酵母总脂有明显提高;根据拟南芥质体中酰基‑ACP 合成速率和硫酯酶的特异性,油酸(C18:1)是质体输出的主要游离脂肪酸,其次是棕榈酸(C16:0)和极少量的硬脂酸(C18:0)[5]。酵母测定中的GhFAX1 在外源添加脂肪酸C16:0(确定的特异性范围:16:0>18:0>18:1≈18:2)中表现最好,因此,GhFAX1 最有可能参与质体中游离棕榈酸的输出。
3.5 GhFAX1在烟草中的重组表达及其生物学效应
以农杆菌介导的遗传转化是获得转基因植物广泛应用的一种方法[28]。通过亚细胞定位实验发现GhFAX1 定位于质体中,对过表达烟草叶片叶绿素含量以及相关荧光参数进行检测,烟草叶绿素含量显著提升,并且叶绿素荧光参数都有显著提高。继续研究GhFAX1 对烟草油脂代谢的影响,检测过表达烟草叶片与种子的总脂,相对于野生型烟草显著提高,证明GhFAX1 能显著提高烟草含油量。当植物体内总碳源一定时,氨基酸和糖与FA 在利用光合产物方面存在竞争关系[29-31],所以对转基因烟草的蛋白、淀粉、可溶性糖进行检测发现,转基因烟草的淀粉与可溶性糖无明显变化,但蛋白含量有显著的降低,表明GhFAX1 可以使蛋白合成途径上的碳源更多地流向油脂合成途径。
4 结论
从陆地棉全基因组中鉴定出12 个GhFAXs 基因。GhFAXs 基因通过片段复制进行基因家族扩张。GhFAXs 基因在陆地棉各个组织和不同胁迫中存在差异表达。GhFAX1 定位在质体中,且参与酵母的脂肪酸代谢,并对C16:0 有选择性,推测GhFAX1 参与质体中游离棕榈酸的输出。GhFAX1 可以提高烟草光合速率与含油量,同时使蛋白合成途径上的碳源更多地流向油脂合成途径。
