贝莱斯芽孢杆菌生防次级代谢产物研究进展
2024-04-17许沛冬易剑锋陈迪潘磊谢丙炎赵文军
许沛冬 易剑锋 陈迪 潘磊 谢丙炎 赵文军
(1.三亚中国检科院生物安全中心,三亚 572024;2.中国检验检疫科学研究院,北京 100000;3.海南大学植物保护学院,海口 570228)
芽孢杆菌类(Bacillus spp.)微生物分布广泛,对环境无污染,是重要的有益微生物。许多芽孢杆菌菌株已经作为生物杀菌剂、杀虫剂、杀线虫剂以及植物生长促进剂进行商业化开发利用[1-2]。贝莱斯芽孢杆菌(Bacillus velezensis)是芽孢杆菌中最重要的代表性生防菌,被广泛应用于农业产业中[3-5]。B.velezensis 的命名经历了长时间的修正与更迭,随着分子生物学技术和组学手段的应用,近5 年来,芽孢杆菌的分类更加清晰和明朗,许多商业化的菌株被重新分类为B.velezensis[6-7];并且这些菌株已经制备成生物防治剂广泛用于控制各种病原微生物,如RhizoVital®(B.amyloliquefaciens subsp.plantarum FZB42)、Serenade®(B.subtilis QST713)、Kodiak®(B.subtilis GB03)、Taegro®(B.subtilis var.amyloliquefaciens FZB24) 等[8]。B.velezensis 模 式菌株FZB42,曾分类为B.amyloliquefaciens subsp.plantarum,已配制成商业化生物防治剂RhizoVital®,用于控制植物土传病害;同时该菌株能够促进植物生长,并且产生不同类型具有生物活性的次级代谢产物,从而抑制植物病原菌群[9]。尽管B.velezensis和B.subtilis 的基因组高度相似,但B.subtilis 物种基因组中仅有4%-5%与抑菌物质的合成有关,而B.velezensis 基因组中有10%用于抑菌物质的合成[10]。得益于B.velezensis 具有能够产生丰富次级代谢产物的能力,作为益生菌在动物饲料工业中也具有潜在的应用价值[11]。然而基于次级代谢产物的芽孢杆菌生物防治剂依旧存在知识空白和瓶颈,主要包括在细胞和分子水平上,次级代谢产物活性物质的表征和生物防治剂组合物协同增效作用尚不清晰,生物防治剂的作用机制并不明确;此外,由于田间的各种环境因素,如土壤化学、生物和非生物胁迫等,导致生物防治剂的田间应用效果很难预测[12]。因此,对贝莱斯芽孢杆菌次级代谢产物的研究,有利于解析芽孢杆菌的生防机制,以及菌株作为生物防治剂的商业化进程,故而本文对贝莱斯芽孢杆菌的命名、次级代谢产物类型、合成和调控基因、靶标病原等进行综述,以期为后续生防菌剂的改良和生物农药的研发提供理论参考。
1 贝莱斯芽孢杆菌的命名与更迭
B.velezensis 的分类经历了很长时间的混淆,一方面,传统的表型方法很难准确区分芽孢杆菌属各个种;另一方面,由于基因的高度保守性,16S rRNA 系统发育分析也无法区分类群中的部分种[6]。2004 年,B.subtilis、B.amyloliquefaciens、B.licheni‑formis、B.pumilus 由于具有相似的表型和系统发育特征,被统一为“枯草芽孢杆菌复合体(B.subtilis species complex)”[13]。2005 年,B.velezensis(菌 株CR‑502T和CR‑14b)从西班牙马拉加省托雷德尔马尔的Vélez 河河口采集的环境样本中被分离出来[14]。表型分析和系统发育表明,这些菌株与B.subtilis和B.amyloliquefaciens 具有亲缘性,但是进一步的DNA‑DNA 杂交实验表明,新菌株与芽孢杆菌其他物种的相似性不到20%,代表了一类新的芽孢杆菌[14]。2011 年,基于全基因组分析,B.amyloliquefaciens 被分为两个亚种:B.amyloliquefaciens subsp.amyloliq‑uefaciens(模式菌株为DSM7)和B.amyloliquefaciens subsp.plantarum(模 式 菌 株 为FZB42)[15]。2015-2016 年,基于比较基因组分析,B.amyloliquefaciens subsp.plantarum 与B.velezensis、B.methylotrophicus表型和基因型高度一致,被界定为同物异名[3,16]。2017 年,通过rpoB 基因序列和核心基因组比较分析,B.amyloliquefaciens subsp.plantarum 和B.methy‑lotrophicus 统 一 为B.velezensis,B.amyloliquefaciens类群整合划分为3 个种,即B.amyloliquefaciens、B.siamensis、B.velezensis[4]。随着基因组时代的到来,基于基因组序列的多种方法被用于包括B.subtilis 类群在内的芽孢杆菌的鉴定与分类,包括平均核酸均一性(average nucleotide identity, ANI)、平均氨基酸均 一 性(average amino acid identity, AAI)、DNA 杂交(DNA‑DNA hybridization, DDH),同时它们作为种间判定的依据,界定阈值分别设定为DDH=70%、ANI=95%、AAI=95%[17];截至2023 年9 月,NCBI(National Center for Biotechnology Information)已公布的B.velezensis 全基因组序列共有665 个,其中装配注释完整的共有303 个,B.velezensis 的分类地位得到进一步的明确和稳固(图1)。

图1 贝莱斯芽孢杆菌分类学地位的变迁Fig.1 Changes in the taxonomic status of B.velezensis
2 贝莱斯芽孢杆菌的生防作用机制
贝莱斯芽孢杆菌的生防机制通常包括以下3 个方面:(1)产生次级代谢产物对抗病原体和害虫;(2)改善宿主植物微生物群落,促进宿主营养和生长;(3)刺激植物宿主防御,产生系统抗性(induced systemic resistance, ISR)[1,10,18-19]。国 内 外 许 多 研究报道了贝莱斯芽孢杆菌可以产生抑制植物病原菌和线虫生长的活性物质[2,20-21]。这类物质包括抗生素(antibiotics)、铁载体(siderophores)、挥发性有机化合物(volatile organic compounds, VOCs)、裂解酶(lytic enzymes)和解毒酶(detoxification enzymes)等[21-22]。其中,抗生素阻止细菌定植;铁载体从土壤中螯合铁;氰化氢等挥发物可以抑制真菌病原体的生长;裂解酶可以降解包括几丁质(真菌细胞壁)在内的许多有机化合物;解毒酶可防止致病毒素造成的损害[22-23]。B.velezensis GB03 产生的VOCs 会触发ET/JA 响应性植物防御基因PDF1.2 的合成[24];B.velezensis FZB42 鉴定出可以产生13 种VOCs,其中benzaldehyde、1,2‑benzisothiazol‑3(2 H)‑one和1,3‑butadiene 可以抑制植物细菌性青枯病病原体茄科雷尔氏菌(Ralstonia solanacearum)[25]。B.velezensis FZB42 产生的表面活性素(surfactin)可以有效抑制由稻瘟病菌(Magnaporthe oryzae)引起的多年生黑麦草(Lolium perenne)灰叶斑病;产生的杆菌霉素(bacillomycin D)可以有效抑制小麦、玉米(Zea mays)上的病原菌禾谷镰刀菌(Fusarium graminearum);此外FZB42 还可以产生聚酮化合物macrolactin 和difficidin[26-27]。B.velezensis SQR9产生的脂肽类化合物fengycin 和bacillomycin D,聚酮化合物macrolactin、difficidin 和bacillaene,二肽bacilysin,胞外多糖(exopolysaccharides)和VOCs可以抑制植物病原菌丁香假单胞菌番茄致病变种(Pseudomonas syringae pv.tomato)和灰霉菌(Botrytis cinerea)[28]。由此可知,芽孢杆菌主要通过产生次级代谢产物来直接对抗植物病原细菌和真菌,这是它最直接的生防机制。
3 贝莱斯芽孢杆菌产生次级代谢产物的类型
自青霉素(penicillin)这一类主要来源于微生物的次级代谢产物被发现以来,科学家们试图从微生物中分离出新的化合物,作为药物或杀虫剂的天然物质。近年来,许多B.velezensis 菌株被鉴定为含有大量编码用于生产次级代谢产物的基因簇,其中包括编码聚酮化合物合酶(polyketide synthases,PKS)和非核糖体肽合成酶(non‑ribosomal peptide synthetases, NRPS)的基因簇,而这些具有生物活性的代谢产物成为了天然新药和候选抗生素的储存库[8,29]。首个B.velezensis 基因组(FZB42 基因组)于2007 年注释完成,并发现该基因组中存在9 个基 因 簇( 即srf、bmy、fen、dhb、bac、min、bae、dfn 和nrs),其大小约占整个基因组的10%[30]。在这9 个基因簇中,有5 个编码合成非核糖体脂肽类化合物(non‑ribosomal lipopeptides, LPS),这一合成过程依靠于非核糖体肽合成酶,主要包括3 种化合物surfactins(srf)、bacillomycin‑D(bmy)、fengycins(fen)或plipastatins(pps)[31]。另一大类,是在聚酮合成酶指导下合成聚酮类化合物(polyketides),例 如macrolactin(mln)、bacillaene(bae)、difficidin(dfn)[9,32]。 此 外,bac 基 因 簇 指 导 抗 菌 二 肽bacilysin 的合成和表达[33];核糖体途径的次级代谢产物amylocyclicin 和plantazolicin 也被鉴定出来[34-35]。另一类次级代谢产物并非直接作用于病原微生物,如铁载体bacillibactin(dhb),它可以通过与病原微生物竞争铁等营养素起到保护植物的作用[36-37]。不同贝莱斯芽孢杆菌菌株产生的次级代谢产物并不相同,如B.velezensis HAB‑2 菌株编码13 个次级代谢产物基因簇,其中包括8 个合成已知化合物的基因簇,分别参与mersacidin、bacilysin、bacillibactin、difficidin、fengycin、bacillaene、macrolactin、surfactin 的生物合成;其余5 个合成未知化合物的基因簇[17]。由此可知,随着基因组测序技术的普及以及多组学的应用,将有大量未知的次级代谢产物被发现,B.velezensis 潜在的抑菌机制值得我们深入挖掘。
4 核糖体途径产生的次级代谢产物
4.1 小菌素的合成基因簇及靶标病原菌
2010 年, 小 菌 素(microcins)plantazolicin 在B.velezensis FZB42 突变体中被发现[34];随着近年来基因组数据的扩充,其不断在B.velezensis 基因组中被解析出来[38-39]。这种小分子化合物属于噻唑/ 恶 唑 修 饰 的 小 菌 素(thiazole/oxazole‑modified microcins, TOMM),它的结构中包括一定数量的噻唑(thiazoles)和恶唑(oxazoles),由线性的14 聚前体肽(14‑mer precursor peptide)形成,根据结构不同分为plantazolicin A 和plantazolicin B[34,40]。调控合成plantazolicin 的基因簇pzn 包含12 个基因,大约10 kb,这些基因参与到这类天然产物的生产、修饰、输出和自身免疫的过程中[34]。Liu 等[41]证实基因RBAM_007470(pznD)参与plantazolicin 的合成,转座子TnYLB‑1 插入基因RBAM_007470 会导致plantazolicin 合成的完全丧失。同时,甲硫氨酸依赖性甲基转移酶对plantazolicin 的合成起到至关重要的作用[42]。与小菌素B17(microcin B17)和链球菌溶血素S(streptolysin S)类似,plantazolicin可以刺激促进植物生长,抑制植物病原体的侵染[34,43-44]。但是plantazolicin 并非广谱性抑菌化合物,如表1 所示,它主要作用于密切相关的革兰氏阳性细菌,如芽孢杆菌属的部分菌株,尤其是炭疽芽孢杆菌(B.anthracis)[45]。此外它具有良好灭杀根结线虫(Meloidogyne incognita)的活性[41]。

表1 B.velezensis 核糖体途径产生次级代谢产物靶标病原菌Table 1 Target pathogens controlled by ribosomal secondary metabolites of B.velezensis
4.2 细菌素的合成基因簇及靶标病原菌
环状疏水细菌素amylocyclicin 是一种高度疏水的环状肽,分子量为6 381 Da,于2014 年在B.ve‑lezensis FZB42 中被发现[35]。调控合成amylocyclicin的基因簇acn 包含6 个基因(acnA、acnB、acnC、acnD、acnE、acnF),共计大小约4 490 bp;acnA、acnB、acnC 直接参与amylocyclicin 的合成,其中acnA 编码112 个氨基酸组成的线性前体肽,翻译后去除N 端48 个氨基酸前导肽(leader peptide)后,成熟肽(mature peptide)由64 个氨基酸组成[35,46]。Amylocyclicin 表现出对金黄色葡萄球菌(Staphyloc‑occus aureus)等革兰氏阳性菌的抑制作用[35,46-47]。
4.3 羊毛硫抗生素的合成基因簇及靶标病原菌
Mersacidin 是一种含有β- 甲基羊毛硫氨酸的新型多肽抗生素,它被归类为羊毛硫抗生素(lantibiotic)[48-49]。Mersacidin 含有20 个氨基酸,分子量为1 825 Da。Mersacidin 由基因簇mrs 合成调控,基因簇包含10 个基因(mrsA、mrsR1、mrsR2、mrsK2、mrsF、mrsG、mrsE、mrsM、mrsD、mrsT);其中mrsR2 和mrsK2 编码双组分调节系统,mrsR1编码响应调控因子,mrsM 和mrsD 编码参与前肽翻译后修饰的酶,mrsT 编码具有相关蛋白酶结构域的转运蛋白;此外,mrsF、mrsG、mrsE 操纵子编码3种蛋白质形成B 型ABC 转运蛋白(ATP 结合盒),mrsR2 和mrsK2 调节mrsF、mrsG、mrsE 的转录,但不影响mersacidin 的生物合成[50-51]。在早期的报道中仅有部分芽孢杆菌可以产生mersacidin;Herzner等[52]将mersacidin 基因簇转移到B.velezensis 中,菌株具备了产生mersacidin 的能力;Viel 等[53]成功将mersacidin 在大肠杆菌中的异源表达。近年来,许多学者在B.velezensis 部分菌株中发现了完整mersacidin 的基因簇,证实了B.velezensis 具有产生mersacidin 的能力[17,54]。Mersacidin 通过与前体分子脂质II(precursor molecule lipid II)结合来抑制病原细菌细胞壁的生物合成[51,55]。如表1 所示,mersacidin 对革兰氏阳性菌有抑菌活性,包括金黄色葡萄球菌(S.aureus),但对革兰氏阴性菌或真菌没有抑菌活性[48,56]。
5 非核糖体途径产生的次级代谢产物
5.1 脂肽类化合物的类型
5.1.1 表面活性素的合成基因簇及靶标病原菌 表面活性素surfactin 的历史可追溯到1968 年,由Arima 等[57]从B.subtilis 中鉴定并表征;迄今为止,已经报道了来自不同芽孢杆菌属的菌株可以产生surfactin,包括B.velezensis、B.amyloliquefaciens、B.licheniformis、B.methylotrophicus、B.thuringiensis[58]。Surfactin 是一种环状脂肽,由一种链长可变的β-羟基脂肪酸和7 种氨基酸组成的肽环通过内酯桥连接在一起,形成肽链的环状结构,包含亲水性七肽环结构,氨基酸序列为Glu‑leu‑lew‑val‑asp‑leu‑leu‑leu,连接β-羟基脂肪酸,通常在C‑13 和C‑16 之间[59-60]。根据氨基酸的差异,将surfactin 分为3 类,即L‑亮氨酸、L‑缬氨酸和I‑异亮氨酸分别存在于surfactinA、surfactinB 和surfactinC 中[61]。Surfactin通过srfA 操纵子编码的NRPS 合成,包含srfAA、srfAB、srfAC 和srfAD 四个基因[62]。有关研究表明,胞外信号因子(extracellular signaling factor)Comx,传感器激酶(sensor kinase)KinC,产孢刺激因子(sporulation‑stimulating factor, CSF)和天冬氨酸磷酸酶(aspartate phosphatase, Rap)会影 响surfactin 的生物合成[62-65]。如表2 所示,surfactin 是一种强大而有效的生物表面活性分子,对多种病原微生物具有抑菌活性,包括茄科雷尔氏菌(R.solanacearum)、丁香假单胞菌番茄致病变种(P.syringae pv.tomato)、拟轮枝镰孢菌(F.verticillioides)、串珠镰刀菌(F.moniliforme)、葡萄轴霜霉菌(Plasmopara viticola)等[66-70]。Surfactin 在膜水平上影响靶细胞,对植物病原菌、真菌和病毒具有广谱的拮抗活性[71],最新报道surfactin 对南方根结线虫(M.incognita)也具有灭杀趋避能力[72]。
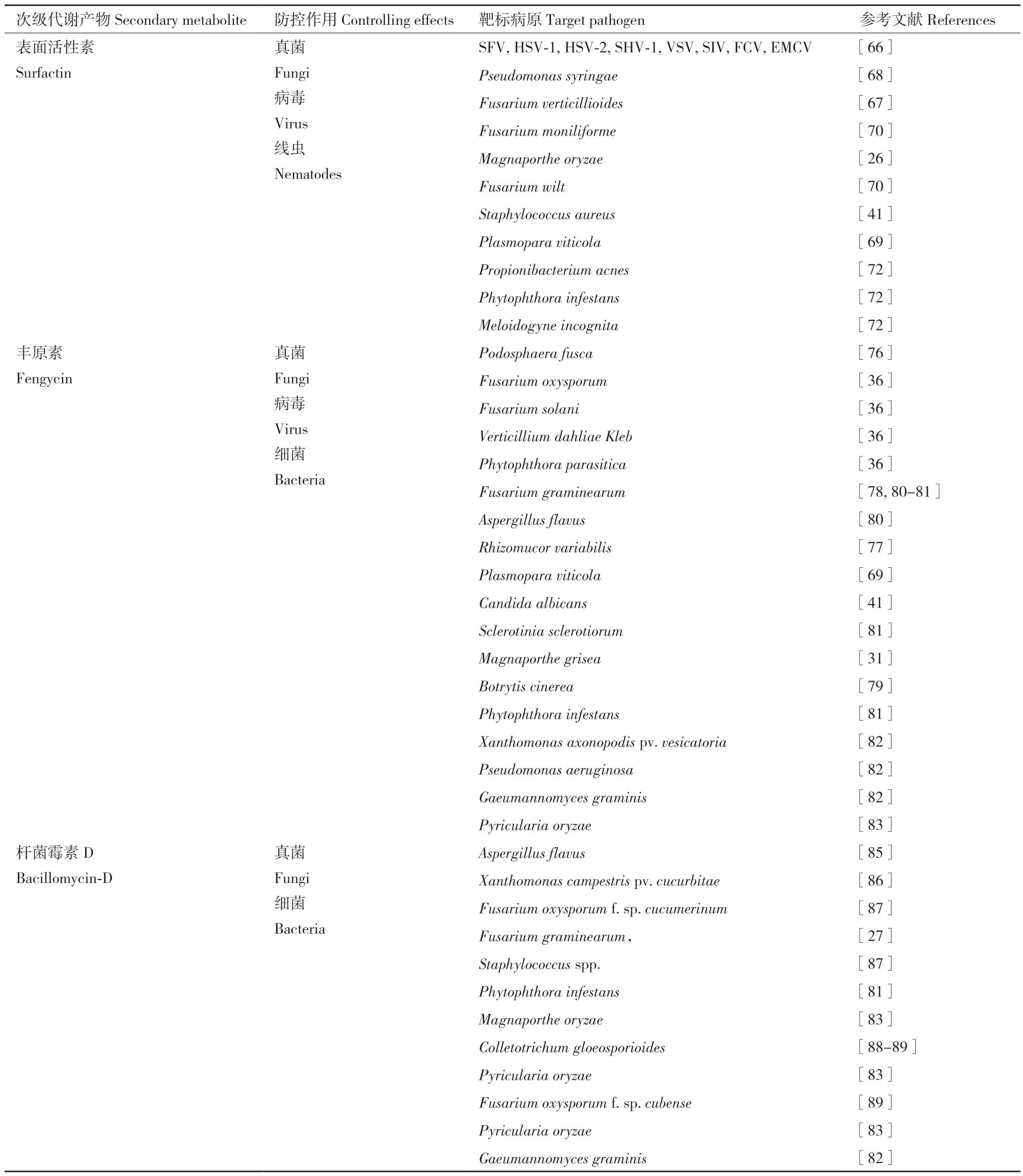
表2 B.velezensis 非核糖体途径产生脂肽类次级代谢产物靶标病原菌Table2 Target pathogens controlled by non-ribosomal secondary lipopeptides metabolites of B.velezensis
5.1.2 丰原素的合成基因簇及靶标病原菌 丰原素fengycin,也称plipastatin,1986 年从B.subtilis 中发现[73]。Fengycin 是八肽环结构,连接N‑末端β-羟基脂肪酸链,通常在C‑12 和C‑19 之间;根据结构的不同,即在第六位存在Ala 或Val,将fengycin 分为fengycin A 和fengycin B 两种类型[74]。Fengycin 由NRPS 合成,包含fenA(ppsA)、fenB(ppsB)、fenC(ppsC)、fenD(ppsD)和fenE(ppsE)5 个基因[75]。fengycin 对广谱丝状真菌具有抑菌活性,例如大麦赤霉病(Fusarium graminearum)、稻瘟病(Magnaporthe grisea)、灰 霉 病(Botrytis cinerea)、玉 米 穗 腐 病(Rhizomucor variabilis)、瓜类白粉病(Podosphaera fusca)等[31,76-80]。不同菌株产生的fengycin 靶标病原菌也有一定的差异性,B.velezensis SQR9 和B.amyloliquefaciens S76‑3 产生的fengycin 表现出对侵染禾本科植物病原真菌的抑菌作用,如F.oxysporum、F.solani、F.graminearum、Phytophthora parasitica 和Verticillium dahliae Kleb[36,81];B.amyloliquefaciens MEP218 产生的fengycin 对番茄疮痂病病原菌野油菜黄单胞菌疮痂致病变种(Xanthomonas axonopodis pv.vesicatoria)有良好的抑菌效果[82];B.altitudinis 和B.velezensis 的菌株产生fengycin 可以直接拮抗触发诱导系统抗病性,抑制P.oryzae 孢子萌发,从而保护水稻免受稻瘟病的侵染[83]。
5.1.3 杆菌霉素D 的合成基因簇及靶标病原菌 杆菌霉素D(bacillomycin‑D)属于脂肽类化合物iturin家族,这一家族成员包括iturin A、iturinC、iturinD、iturinE,bacillomycin‑D、bacillomycin‑F、bacillomy‑cin‑L,bacillopeptin,mycosubtilin[33]。Bacillomycin‑D的结构是环状七肽与氨基脂肪酸链结合,C‑15 到C‑18 之间。Bacillomycin‑D 由bmy 操纵子调控生物合成,包括bmyD、bmyA、bmyB 和bmyC 等4 个基因[84]。同时,它还受到3 个多效调节因子Degu、Degq、ComA 和2 个sigma 因子σB、σH 的调控[84]。如表2所示,bacillomycin‑D 可以有效抑制多种病原微生物,包括X.campestris pv.cucurbitae、Aspergillus flavus、F.graminearum、F.oxysporum f.sp.cucumerinum 等[85-88]。B.velezensis FZB42 产 生 的bacillomycin‑D 表 现 出 对丝状病原真菌优异的抑菌活性[88]。B.velezensis HN‑2中分离的bacillomycin‑D 对C.gloeosporioides(Penz.)具有强烈抑制作用,可损伤bacillomycin‑D 菌丝和孢子的细胞壁和细胞膜,细胞内细胞质和细胞器渗出并形成空洞,从而对炭疽病具有良好的抑制效果[89](表2)。
5.2 聚酮类化合物的类型
5.2.1 Bacillaene 的合成基因簇及靶标病原菌 Bacillaene 是由反式酰基转移酶聚酮合成酶合成的一种线性聚酮/非核糖体肽,从B.subtilis 中发现的多烯类抗生素[90]。在B.velezensis 中存在3 个PKSs 基 因 簇(pks1、pks2、pks3),bacillaene 是 由pks1(bae)基因簇编码合成[9]。Bacillaene 化学结构的复杂性、生物合成的特殊性、强大的生物活性和竞争力,使其成为抵抗其他微生物和维持最佳根际环境的理想天然产物武器[91]。尽管bacillaene 对多重耐药细菌(multi‑drug resistance, MDR)具有抑菌活性,但多年来,由于bacillaene 的化学不稳定性,很难使用传统的分离方法获得bacillaene 的纯化物[92]。在光照或室温条件下,bacillaene 会迅速分解,这阻碍了对bacillaene 生物合成的尝试[69]。如表3所示,B.velezensis FZB42 产生的bacillaene 对梨火疫病病原菌(Erwinia amylovora)具有一定的抑菌效果[32]。Bacillus spp.产生的bacillaene‑A 显示出对真菌鸡枞菌(Termitomyces albuminosus(Berk)Heim)的抑菌活性[93]。
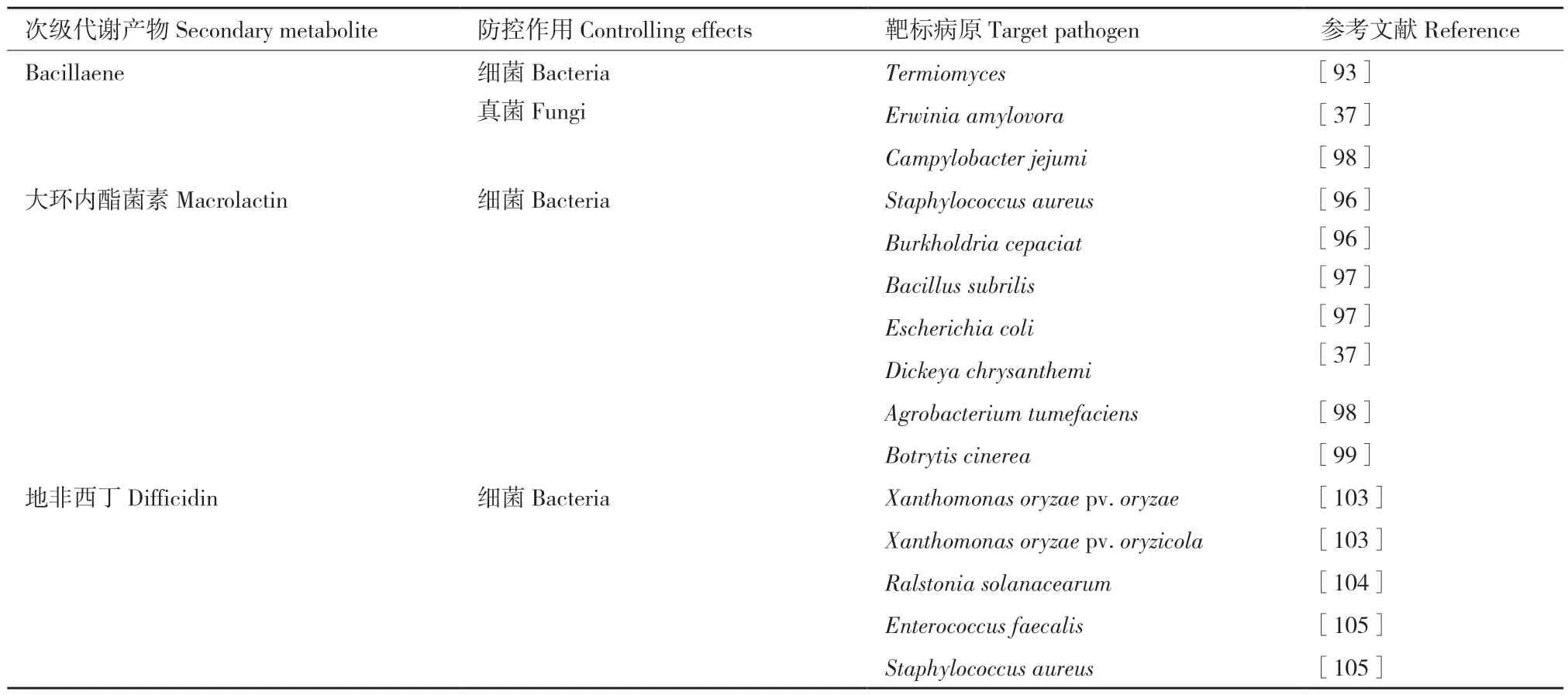
表3 B.velezensis 非核糖体途径产生聚酮类次级代谢产物靶标病原菌Table 3 Target pathogens controlled by non-ribosomal secondary polyketides metabolites of B.velezensis
5.2.2 大环内酯菌素的合成基因簇及靶标病原菌 大环内酯菌素macrolactin 最早是从深海细菌Bacillus spp.Sc026 菌株的乙酸乙酯提取物中分离出来[94]。在B.velezensis 中,pks2(mlnB、mlnC、mlnD、mlnE、mlnF、mlnG、mlnH)基因簇编码合成macrolactin,macrolactin 是细菌肽去甲酰酶抑制剂[30,95]。目前已鉴定出17 种不同类型的macrolac‑tin,其中在B.velezensis 中发现4 种形式,包括mac‑rolactin‑A、macrolactin‑D、7‑O‑malonyl‑macrolactin‑A、7‑O‑succinyl‑macrolactin。其中7‑O‑succinyl‑macrolactin对多种革兰氏阳性细菌和多重耐药细菌病原体有抑制效果,包括耐甲氧西林菌株金黄葡萄球菌(Staph‑ylococcus aureus),耐万古霉素菌株肠球菌(Escherichia coli),洋葱伯克霍尔德菌(Burkholderia cepacian),根癌农杆菌(Agrobacterium tumefaciens)[96-98]。最近研究表明,macrolactin 影响草莓病原真菌灰葡萄孢(Botrytis cinerea)的膜结构,导致膜通透性变化,蛋白质和核酸泄漏,进而导致细胞死亡;同时,mac‑rolactin 对灰葡萄孢的孢子萌发、芽管伸长和菌丝生长具有显著的抑制作用[99]。
5.2.3 地非西丁的合成基因簇及靶标病原菌 地非西丁difficidin,或称达菲菌素,是在B.subtilis ATCC‑39320 发酵液中被首次发现,归类为不饱和大环多烯内酯磷酸酯[100]。Difficidin 存在氧化形式oxydifficidin,它在difficidin 环状结构的第五位具有一个羟基,它们都是由pks3(dif)基因簇编码合成的[9]。转录因子Spo0A 可调控difficidin 的合成[101-102]。Difficidin 和bacilysin 对水稻细菌性枯萎病病原菌(X.oryzae pv.oryzae)和水稻细菌性条斑病病原菌(X.oryzae pv.oryzicola)表现出抑菌活性,这两种抑菌化合物可以联合影响病原菌黄单胞菌的细胞壁,RT‑qPCR 结果表明,difficidin 和bacilysin可以导致黄单胞菌的相关基因下调表达,包括毒力、细胞分裂、蛋白质和细胞壁生物合成基因rpfF、gumD、glmS、ftsZ 和rrlA 等[103]。另一项研究中,B.velezensis DR‑08 的 丁 醇 提 取 物 含 有difficidin 和oxydifficidin,对番茄青枯病病原菌青枯雷尔氏菌(R.solanacearum)有抗菌活性[104]。Difficidin 对耐万古霉素的乳酸菌(Enterococcus faecalis)、耐甲氧西林金黄色葡萄球菌(Staphylococcus aureus)和其他耐药菌株具有良好的抑菌活性,表明了difficidin 类似物在药物和生物技术应用中对抗新出现的耐药病原体的潜力[105](表3)。
5.3 二肽的合成基因簇及靶标病原菌
Bacilysin 是一种特洛伊木马抗生素(Trojan horse antibiotic),由Bacillus spp.的bac 基因簇(bacA、bacB、bacC、bacD、bacE,也被称 作ywfB、ywfC、ywfD、ywfE、ywfF)合 成[106]。Bacilysin 依 赖 肽 转运蛋白进入到病原菌靶细胞当中,随后bacilysin 会被细胞质肽酶水解成非蛋白原性抗荚膜菌素(ant‑icapsin, epoxy‑cyclohexanonyl‑Ala) 和N 端L‑ 丙 氨酸(N‑terminal L‑alanine),其 中anticapsin 起 到 抑菌 活 性 的 作 用[107]。Bacilysin 中 的anticapsin 可 以阻断病原细菌肽聚糖或病原真菌甘露糖蛋白的生物合成途径,RT‑PCR 结果也表明bacilysin 会使铜绿微囊藻(Microcystis aeruginosa)的多个基因下调表达,包括glmS、psbA1、mcyB 和ftsZ,这些基因涉及肽聚糖的生物合成、细胞分裂和光合作用[108]。B.velezensis FZB42 产生的bacilysin 对金黄色葡萄球菌(S.aureus)和马铃薯环腐病病原菌(Corynebacterium michiganense subsp.sepedonicum)具有抑菌效果[103]。Bacilysin 还对铜绿微囊藻(M.aeruginosa)有很强的抗蓝藻能力[108];对水稻细菌性枯萎病病原菌(X.oryzae pv.oryzae)和水稻细菌性条斑病病原菌(X.oryzae pv.oryzicola)表现出抑菌活性[103]。Bacilysin通过抑制葡糖胺6‑磷酸合成酶,作为一种多效性信号分子,影响不同的细胞活动,由于其对各种细菌、真菌和藻类病原体的强大拮抗作用,在工业农业和制药行业中越来越受到关注[109-110]。
5.4 铁载体的合成基因簇及靶标病原菌
铁是所有生物体的必需元素,是执行细胞过程的重要辅助因子,包括DNA 合成、呼吸和防御活性氧[111]。Bacillus spp.可以产生儿茶酚铁载体嗜铁素bacillibactin,当菌株细胞被限制吸收铁元素 时,bacillibactin 可 以 促 进Fe3+的 吸 收[112]。在B.velezensis 中,基 因 簇dhb 指 导bacillibactin 的 生物合成[33]。Bacillibactin 通过剥夺病原微生物生长必需的铁来间接抑制其生长,B.velezensis SQR9 产生的bacillibactin 与脂肽类抗生素 bacillomycin D、fengycin、surfactin 联合对某些病原真菌起到拮抗作用,包括 F.oxysporum、F.solani、P.parasitica,在这个过程中bacillibactin 表达量显著上调;但是当突变菌株缺乏脂肽类抗生素时,bacillibactin 的抑菌效果大大降低[36]。在前期的研究中,一直没有证据表明bacillibactin 纯品直接具有抑菌活性[113];直到2021 年,Dimopoulou 等[114]首次从生防芽孢杆菌中分离获得bacillibactin 并发现,除了螯合铁这一途径之外,bacillibactin 对病原细菌和病原真菌具有显著的生物防治活性;随后,一系列研究证明嗜铁素是潜在的天然抗菌剂[115-116]。此外,最新研究表明,bacillibactin 介导的相互作用具有螯合剂传感这一新概念,利用这一机制,芽孢杆菌将依赖特定的外源铁载体作为“窃听”策略来准确识别竞争对手,并通过重塑次生代谢组的表达来做出适当的反应[117]。
6 总结与展望
在过去的几十年里,数百种抗菌药物从微生物中开发出来,这些抑菌物质可以安全地应用于植物病害的防治中,与传统的化学药剂相比,不仅毒性降低,对环境更友好,而且还降低了病原微生物耐药性的风险[118-120]。芽孢杆菌菌株对N2的固定、P和K 的溶解、植物激素的产生、抗生素的合成、裂解酶的产生,以及ISR 成为其直接和间接的生防机制,这些作用机制都支持植物的生长促进、害虫抗性和规避疾病[5]。尤其是B.velezensis,它产生的次级代谢产物在农业产业中表现出极大的抑菌活性和市场价值,受到了广泛的关注和研究。尽管部分B.subtilis 也能够产生具有抑菌活性的次级代谢产物,但是B.velezensis 的次级代谢产物显然更加强大,更多样化。近年来,随着基因组数据的补充,B.velezensis 的进化分类地位也更加明晰,B.velezensis已经成为生物防治功能强大的生防菌株,其产生的次级代谢产物抑菌活性物质可以用作化学农药的有效替代品。然而贝莱斯芽孢杆菌在应用过程中也存在一些问题有待进一步研究和解决。第一,B.velezensis 作为生物防治剂在现场应用时,在不同农业气候区的表现不一致[121];第二,生物防治剂的植物根际有效定植能力的差异,尤其是在根际微生物群落的影响下,菌株的存活和增殖能力存在差异性[122];第三,分子技术已被用于表征B.velezensis中次级代谢产物合成的基因,但生物防治机制的遗传基础尚未确定[123-124]。因此,针对上述问题,未来对B.velezensis 的研究应该根据特定的靶标病原菌确定特定的次级代谢产物,重点放在菌株的稳定性和定植能力方面,以帮助确定生物防治剂的最佳浓度、接种时间、接种位置以及土壤和作物管理策略,从而提高菌株的存活和增殖能力,以确保菌株在可持续农业中的商业化应用推广。此外,也可以通过研究其生防机制对菌株进行遗传改良,形成高效菌株,或者利用B.velezensis 开发创新生物制剂,从而改善作物健康,促进作物生长,比如B.velezensis 可以在纳米技术领域发挥关键作用,制备纳米肥料和纳米农药[21,125-126]。
