基于指纹图谱、量值传递及化学计量学的薏苡竹叶散质量评价
2024-04-17王野谌邱智东张衍旭王俪颖王茂旭董雪莲
王野谌 邱智东 张衍旭 王俪颖 王茂旭 董雪莲
(长春中医药大学药学院, 长春 130117)
薏苡竹叶散(Yiyi-zhuye powder, YZP)出自清代吴鞠通所著《温病条辩》,由薏苡仁、淡竹叶、飞滑石、豆蔻仁、连翘、茯苓和通草7 味药材组成,具辛凉解表、淡渗利湿之功,是除温湿之名方,吴鞠通称其为“双解表里之妙法”[1]。现代临床主要用于治疗湿疹、荨麻疹、手足口病和带状疱疹等疾病[2-4]。散剂指由药材或药材与适宜辅料粉碎后混匀得到的干燥粉末状制剂,是中医重要传统剂型之一[5],《黄帝内经》中有述: “散者散也,去急病用之”,具有起效快、效果显著和制作方法简单等诸多优势,至今仍被广泛应用[6-7]。但由于散剂剂型原始、制剂工艺粗糙,加之研究基础薄弱、研究进展缓慢,散剂的现代发展与传承举步维艰[8-10]。
目前,有关YZP质量标准的研究相对较少且对其临床应用的研究占绝大多数[3],缺乏整体的指纹图谱、含量测定以及制剂工艺研究,因此为了促进YZP 复方的开发应用,通过查阅古籍文献确定YZP 的处方剂量和制备工艺,采用高效液相色谱(HPLC)法开展YZP指纹图谱和含量测定研究,探究荭草苷、异荭草苷在淡竹叶饮片-YZP 复方的量值传递规律,并结合化学计量学阐明15 批YZP 的整体质量和差异性成分,初步建立YZP质量控制标准,以期为YZP后续制剂研究与开发提供科学依据。
1 实验部分
1.1 仪器和试剂
Agilent 1260 型高效液相色谱仪(HPLC,美国安捷伦科技有限公司);EL204 型电子天平(瑞士梅特勒-托利多仪器有限公司);MS105型十万分之一电子天平(瑞士梅特勒-托利多仪器有限公司);KQ-500B型超声波清洗仪(昆山市超声仪器有限公司);ZN-20L型小型粉碎机(北京中科耐驰技术有限公司)。
连翘苷对照品(批号: 110821-202117,纯度94.9%)、连翘酯苷A 对照品(批号: 111810-202108,纯度96.2%)和异荭草苷对照品(批号: 111974-201401,纯度98%)均购自中国食品药品检定研究院;荭草苷对照品(批号: G11N11L130730,纯度98%)、牡荆素(批号: M12GB14216,纯度98%)和异牡荆素(批号: 27GB165516,纯度98%)均购自上海源叶生物科技有限公司;乙腈、甲醇为色谱纯(美国Fisher scientific公司);磷酸为分析纯,购自于天津市永大化学试剂有限公司;实验用水为娃哈哈纯净水。
YZP 中所涉及到的饮片均购自于各主产地,饮片的批号、产地等相关信息见表1。经长春中医药大学中药鉴定教研室翁丽丽教授鉴定: 薏苡仁为禾本科植物薏米Coix lacryma-jobi L. var. ma-yuen(Roman.)Stapf 的干燥成熟种仁; 淡竹叶为禾本科植物淡竹叶Lophatherum gracileBrongn 的干燥茎叶;飞滑石为硅酸盐类矿物滑石族滑石经水飞法炮制后的粉末; 豆蔻仁为姜科植物白豆蔻Amomum kravanh Pierre exGagnep. 的干燥成熟果实; 连翘为木犀科植物连翘Forsythia suspensa(Thunb.) Vahl 的干燥果实; 茯苓为多孔菌科真菌茯苓Poria cocos(Schw.)Wolf 的干燥菌核;通草为五加科植物通脱木Tetrapanax papyrifer(Hook.) KKoch的干燥茎髓。

表1 YZP中饮片产地来源及批号Table 1 Origin and batch number of YZP Chinese decoction pieces
1.2 实验方法
1.2.1 YZP制备工艺考证
《温病调辩》[1]中记载薏苡竹叶散用法用量为: “薏苡五钱,竹叶三钱,飞滑石五钱,白蔻仁一钱五分,连翘三钱,茯苓块五钱,白通草一钱五分,共为细末,每服五钱,日三服”。经查阅《中国科学技术史·度量衡卷》[11]、《中国历代度量衡单位量值表及说明》[12]等书籍文献后确定,清代一钱约为今之3.73 g,一分约合0.373 g。
细末在古代口服散剂中应用较多,张仲景《伤寒论》中五苓散原方粉碎粒度为“为细末”[13],2020 版《中国药典》中粉末粒度被分为最粗粉、粗粉、中粉、细粉、最细粉和极细粉6 个规格,其中五苓散制法为“粉碎成细粉,过筛,混匀,分装”。因此,根据古今对照建议原方中“细末”采用2020 版《中国药典》中细粉规格,即过六号筛(150 μm)。
综上所述,最终确认YZP现代制备工艺为: 薏苡仁18.65 g,淡竹叶11.19 g,飞滑石18.65 g,豆蔻仁5.595 g,连翘11.19 g,茯苓18.65 g,通草5.595 g,粉碎后过六号筛(150 μm)筛,即得。
1.2.2 指纹图谱测定方法
1.2.2.1 标准品溶液的制备
精密称取连翘苷、连翘酯苷A、荭草苷、异荭草苷、牡荆素和异牡荆素对照品适量,加入80 %甲醇溶液分别制成浓度为86.52、30.02、62.34、49.33、89.89和74.36 μg/mL的单一对照品溶液。
1.2.2.2 供试品溶液的制备
精密称取5.0 g YZP 样品(S15),精密加入30 mL 80%甲醇,超声处理30 min(500 W,40 kHz),冷却至室温后补足重量,摇匀,滤过,取续滤液,过0.45 μm的微孔滤膜,即得。
1.2.2.3 各单味饮片溶液的制备
分别精密称取YZP样品(S1)中各单味饮片,即薏苡仁18.65 g,淡竹叶11.19 g,飞滑石18.65 g,豆蔻仁5.595 g,连翘11.19 g,茯苓18.65 g,通草5.595 g,精密加入30 mL 80%甲醇,超声处理30 min(500 W,40 kHz),冷却至室温后补足重量,摇匀,滤过,滤液浓缩至5 mL,过0.45 μm的微孔滤膜,即得。
1.2.2.4 色谱条件
色谱柱为Agilent Eclipse SB-C18 色谱柱(4.6×250 mm,5 μm); 流动相为乙腈(A)-0.05%磷酸水溶液(B),梯度洗脱(0~20 min,5% A; 20~30 min,5%~10% A; 30~40 min,10%~13% A; 40~60 min,13%~15% A; 60~80 min,15%~16% A; 80~110 min,16%~28% A; 110~130 min,28%~8% A); 流速为0.8 mL/min;检测波长为210 nm; 柱温为30 ℃; 对照品及供试品溶液进样量为10 μL。
1.2.3 荭草苷、异荭草苷含量测定方法
1.2.3.1 供试品溶液的制备
1)淡竹叶饮片: 精密称取2.0 g淡竹叶饮片样品(S1),置具塞锥形瓶中,精密加入20 mL 60%乙醇,超声处理30 min(500 W,40 kHz),冷却至室温后用60%乙醇补足减失的重量,摇匀,滤过,续滤液过0.45 μm的微孔滤膜,即得。
2)YZP: 精密称取5.0 g YZP样品(S15),置具塞锥形瓶中,精密加入40 mL 60%乙醇,超声处理30 min(500 W,40 kHz),滤过,容器洗涤3 次,合并溶液,蒸干,精密加入5 mL 60%乙醇溶解,过滤,续滤液过0.45 μm的微孔滤膜,即得。
1.2.3.2 对照品溶液的制备
精密称取荭草苷、异荭草苷对照品,加入60%乙醇定容至20 mL,分别制备质量浓度为33.20 和64.17 μg/mL的混合对照品溶液。
1.2.3.3 阴性样品溶液的制备
按处方比例称取各药材,按照1.2.3.1小节步骤2)制备不含淡竹叶的阴性样品溶液。
1.2.3.4 色谱条件
色谱柱: Agilent Eclipse SB-C18(4.6×250 mm,5 μm); 流动相: 乙腈(A)-0.05%磷酸水溶液(B),梯度洗脱(0~7 min,8% A;7~17 min,8%~13% A; 17~30 min,13%~15% A; 30~45 min,15%~18% A; 45~50 min,18%~8% A; 50~56 min,8% A); 流速: 0.8 mL/min; 检测波长: 360 nm; 柱温: 30 ℃; 进样量: 10 μL。
2 结果与讨论
2.1 15 批YZP指纹图谱建立
2.1.1 相似度评价及色谱峰归属
取15批YZP样品(S1-S15)以及各单味饮片按照1.2.2.2小节和1.2.2.3小节方法制备供试品溶液,按照1.2.2.4小节色谱条件进样测定,记录色谱图。采用《中药色谱指纹图谱相似度评价系统(2012版)》软件进行分析,以S1 为参照图谱,采用中位数法,经多点校正后匹配生成YZP 指纹图谱,结果见图1。21 个共有峰相似度为0.956~0.995,结果见表2 和表3,符合指纹图谱要求,认为15 批YZP 化学构成相似。所得薏苡仁、淡竹叶、连翘、豆蔻仁、飞滑石、茯苓和通草各单味饮片图谱见图2。结果显示,全方中21 个共有峰多数来自于淡竹叶、连翘、豆蔻仁和薏苡仁,而通草、滑石和茯苓3 味饮片色谱峰较少,这可能与饮片成分检测特殊性关有。

图1 15批YZP HPLC指纹图谱和对照指纹图谱Fig.1 HPLC fingerprints and control fingerprints of 15 batches of YZP
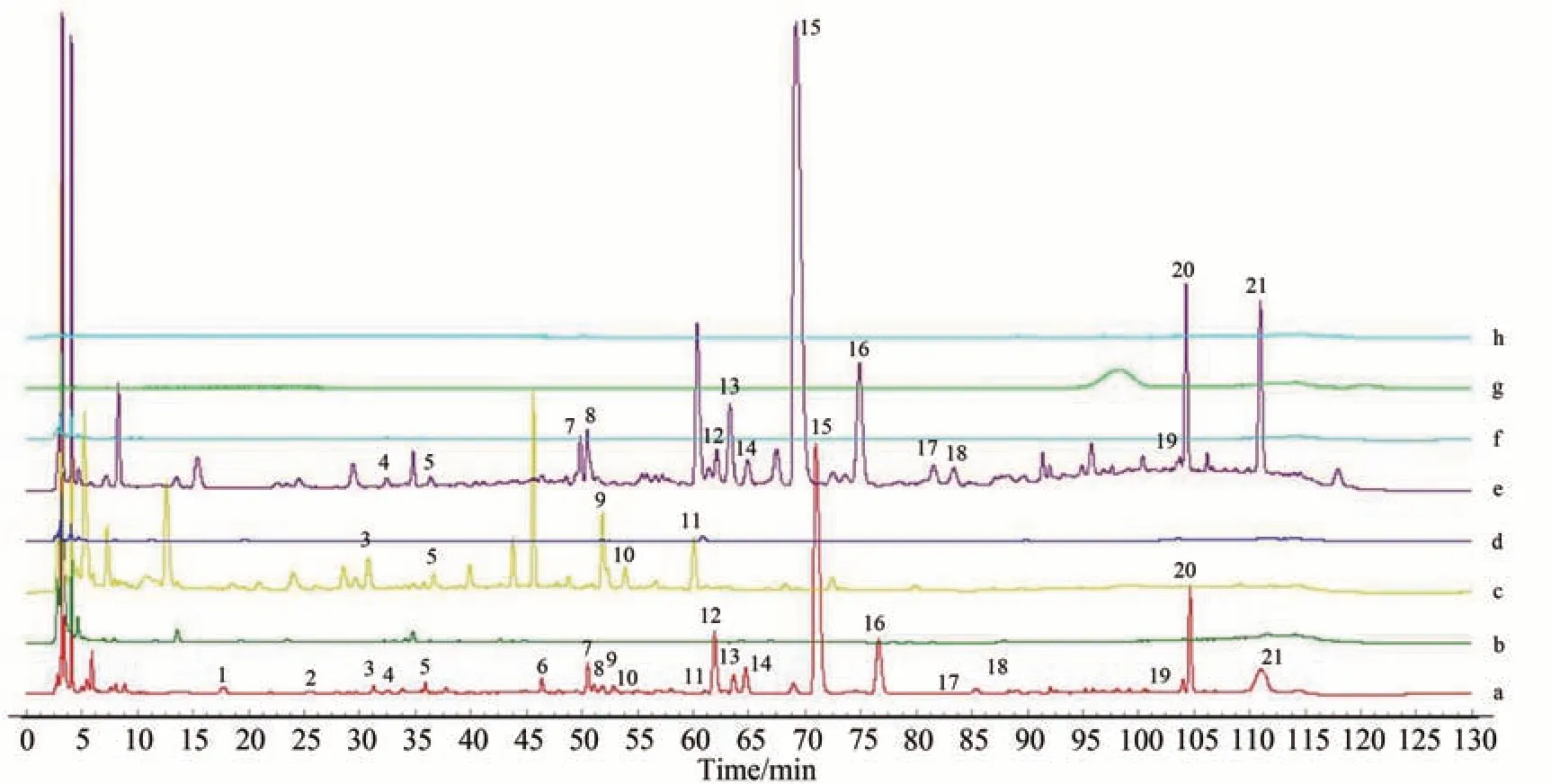
图2 YZP中单味饮片测定结果Fig.2 Results of single decoction pieces in YZP
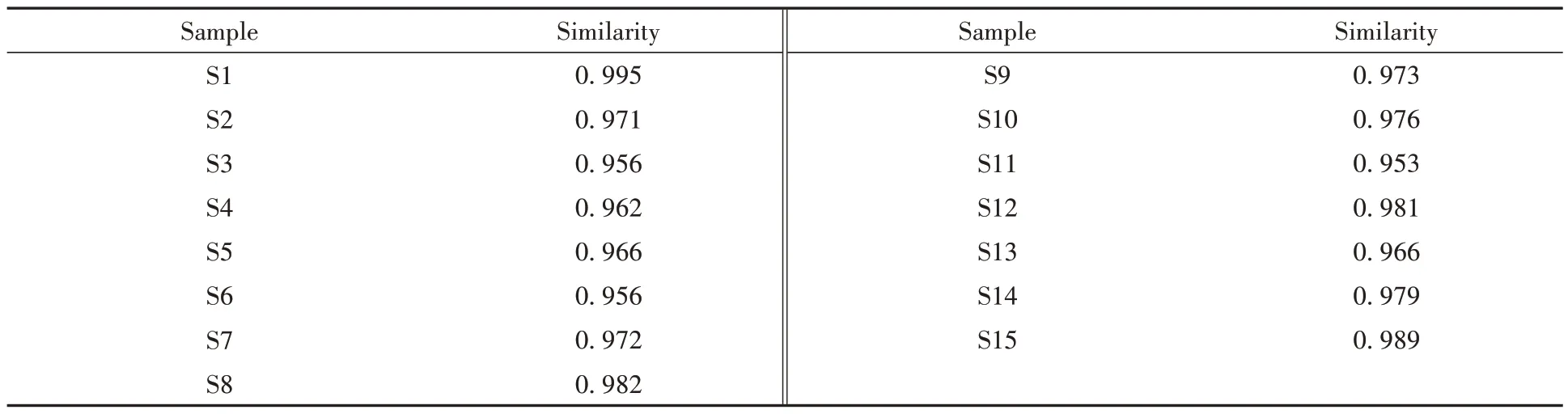
表2 YZP指纹图谱相似度值Table 2 Similarity value of YZP fingerprint
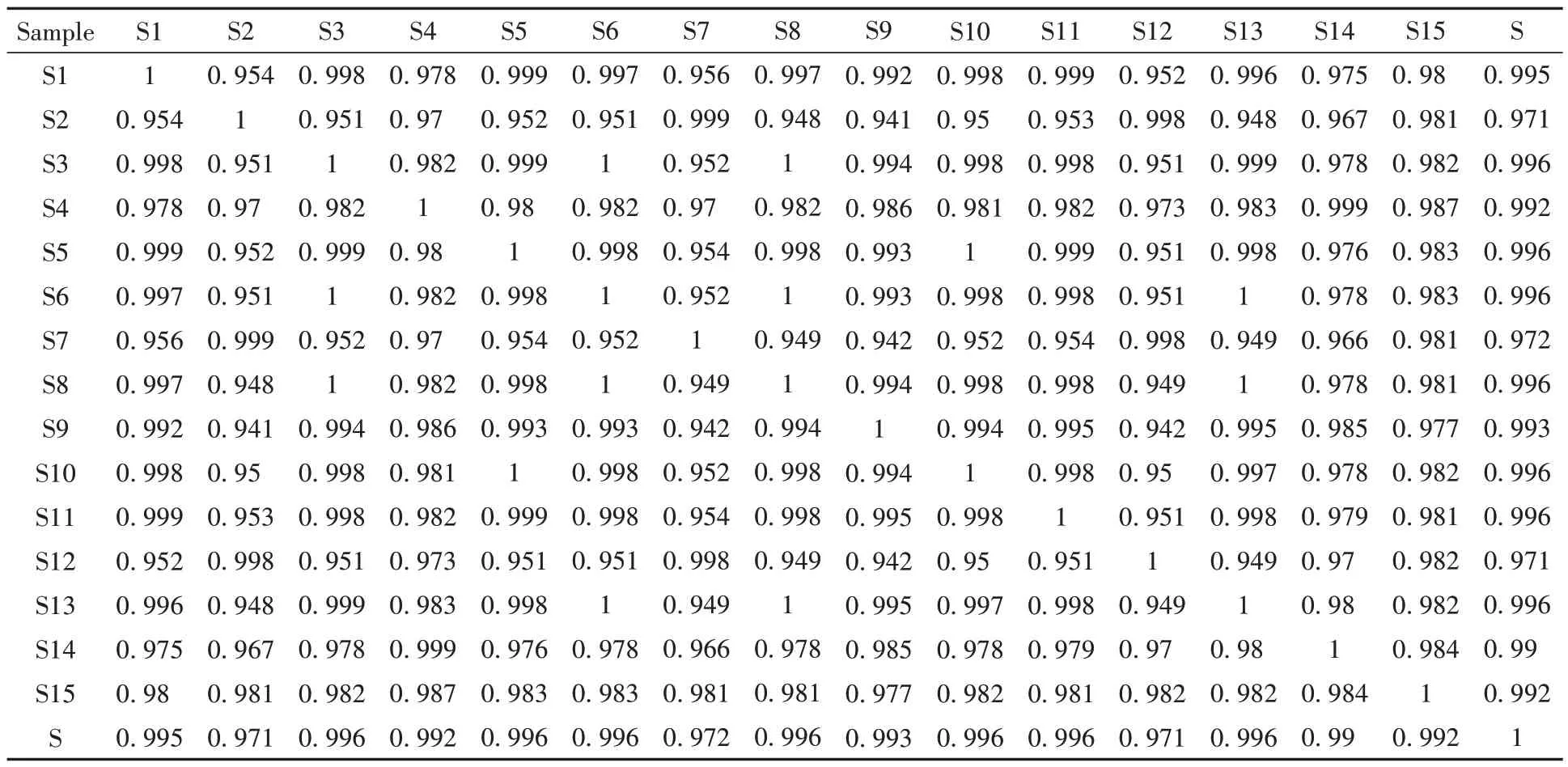
表3 15批YZP指纹图谱相似度评价结果Table 3 Similarity evaluation results of 15 batches of YZP fingerprint
将YZP 指纹图谱与各对照品色谱图比对,以保留时间是否相近为主要评判标准,同时结合色谱图中其它信息,最终指认出6 个成分,分别为9 号峰(异荭草苷)、10 号峰(荭草苷)、13 号峰(牡荆素)、14 号峰(异牡荆素)、15 号峰(连翘酯苷A)和20 号峰(连翘苷)。由于16 号峰分离度良好且峰面积适宜,因此选择16号色谱峰为参照峰,计算出各共有峰的相对峰面积值,结果RSD值在12.2%~133.3%之间,反映不同批次YZP中各成分含量相差较大,质量有明显区别,具体结果见表4。

表4 15批YZP共有峰相对峰面积Table 4 Common peak-peak area of 15 batches of YZP
2.1.2 方法学考察
2.1.2.1 专属性考察
取1.2.2.1 和1.2.2.2 小节标准品和供试品溶液各10 μL,按1.2.2.4 小节色谱条件注入高效液相色谱仪测定,结果显示各对照品峰形良好,分离度较高(R>1.5),理论塔板数按连翘苷计不低于5000,表明该方法具有较强的专属性,结果见图3。
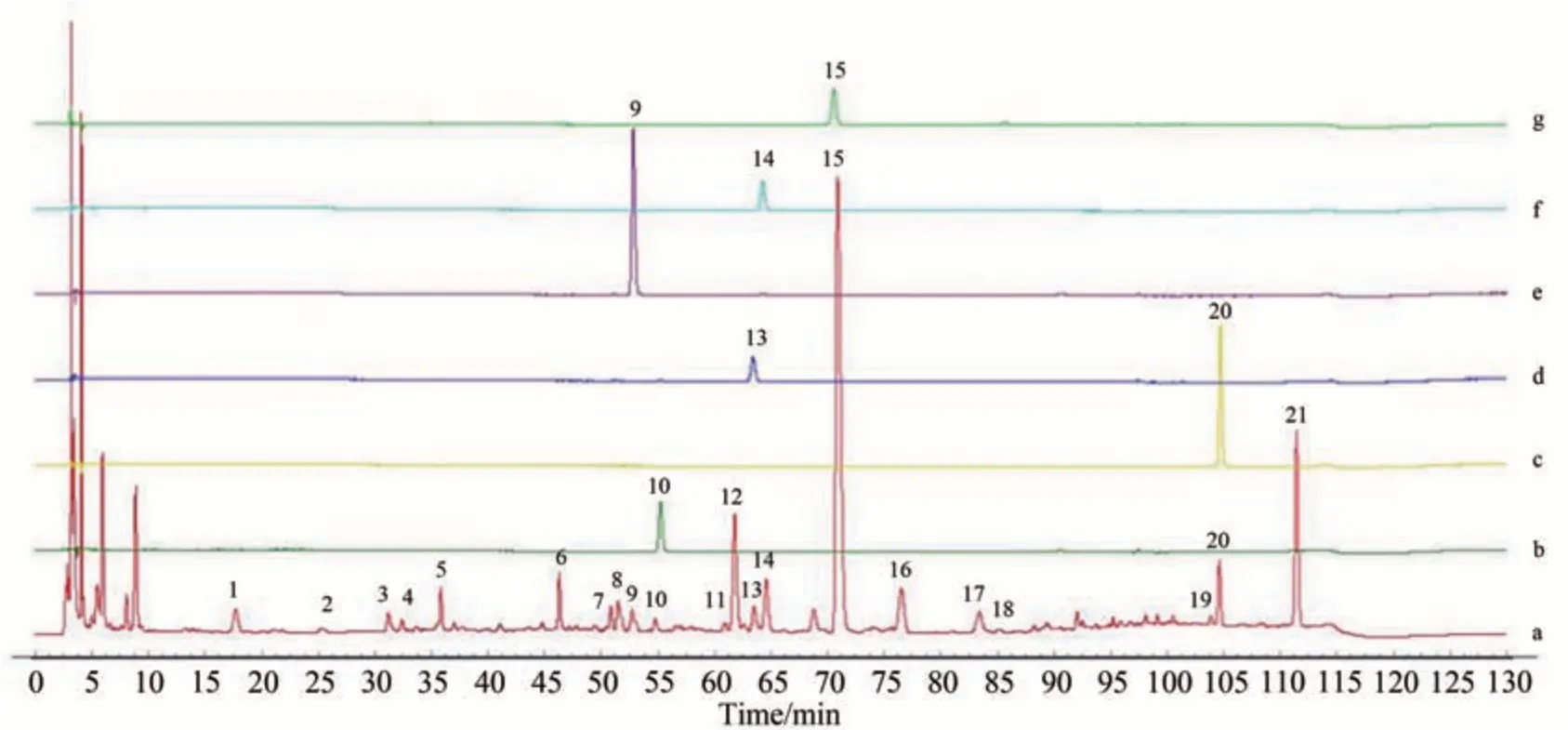
图3 YZP指纹图谱专属性试验Fig.3 Specificity test of YZP fingerprint
2.1.2.2 精密度、重复性和稳定性实验
精密度实验 精密吸取1.2.2.2小节供试品溶液10 μL,按照1.2.2.4小节色谱条件连续进样6次,将22号峰(连翘酯苷A)作为参照峰,计算各共有峰相对保留时间及相对峰面积值。结果显示,RSD值均小于2%(n=6),表明仪器精密度良好。
重复性实验 取1.2.2.2 小节供试品溶液6 份,精密吸取10 μL 并按照1.2.2.4 小节色谱条件分别测定6 次,将22 号峰(连翘酯苷A)作为参照峰,计算各共有峰相对保留时间及相对峰面积值。结果显示,RSD值均小于2%(n=6),表明方法重现性良好。
稳定性实验 将1.2.2.2小节供试品溶液于室温下放置0、2、4、6、8、12和24 h后,精密吸取10 μL,按照1.2.2.4小节色谱条件测定6 次,将22 号峰(连翘酯苷A)作为参照峰,计算各共有峰相对保留时间及相对峰面积值。结果显示,RSD值均小于2%(n=6),表明供试品溶液在室温下24 h内稳定性良好。
2.2 饮片-YZP中荭草苷、异荭草苷含量测定
2.2.1 淡竹叶饮片-YZP样品荭草苷、异荭草苷含量对应关系
将15批饮片按照表1排序依次搭配成15批YZP(S1-S15),按1.2.3.4小节色谱条件进样分析,测定淡竹叶饮片和YZP样品的异荭草苷含量,考察淡竹叶饮片-方的质量传递关系如公式(1)[14-15]所示:
结果见表5 和表6。15 批淡竹叶饮片中荭草苷、异荭草苷的质量分数为0.2156%~0.9923%、0.530%~2.052%,15批YZP中荭草苷、异荭草苷的质量分数为0.022%~0.112%、0.065%~0.312%,饮片-YZP中荭草苷、异荭草苷转移率为78.41%~119.54%、74.57%~127.96%,荭草苷、异荭草苷从饮片到处方的转移率在平均值±30%范围内,未出现离散数据,符合相关规定,表明样品的制备工艺稳定可靠。
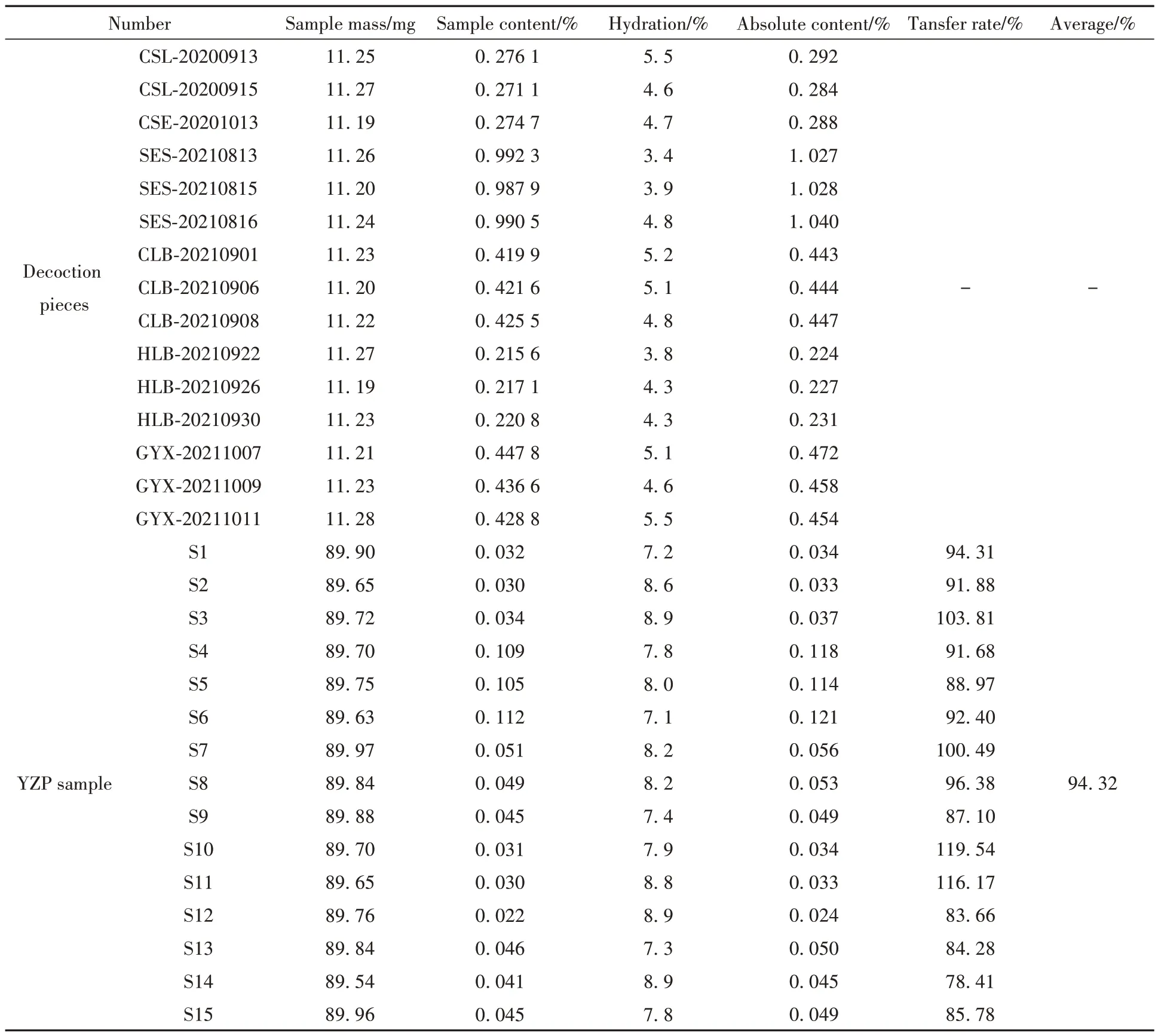
表5 饮片-YZP样品荭草苷质量传递结果Table 5 The mass transfer results of orientin between decoction pieces and YZP sample
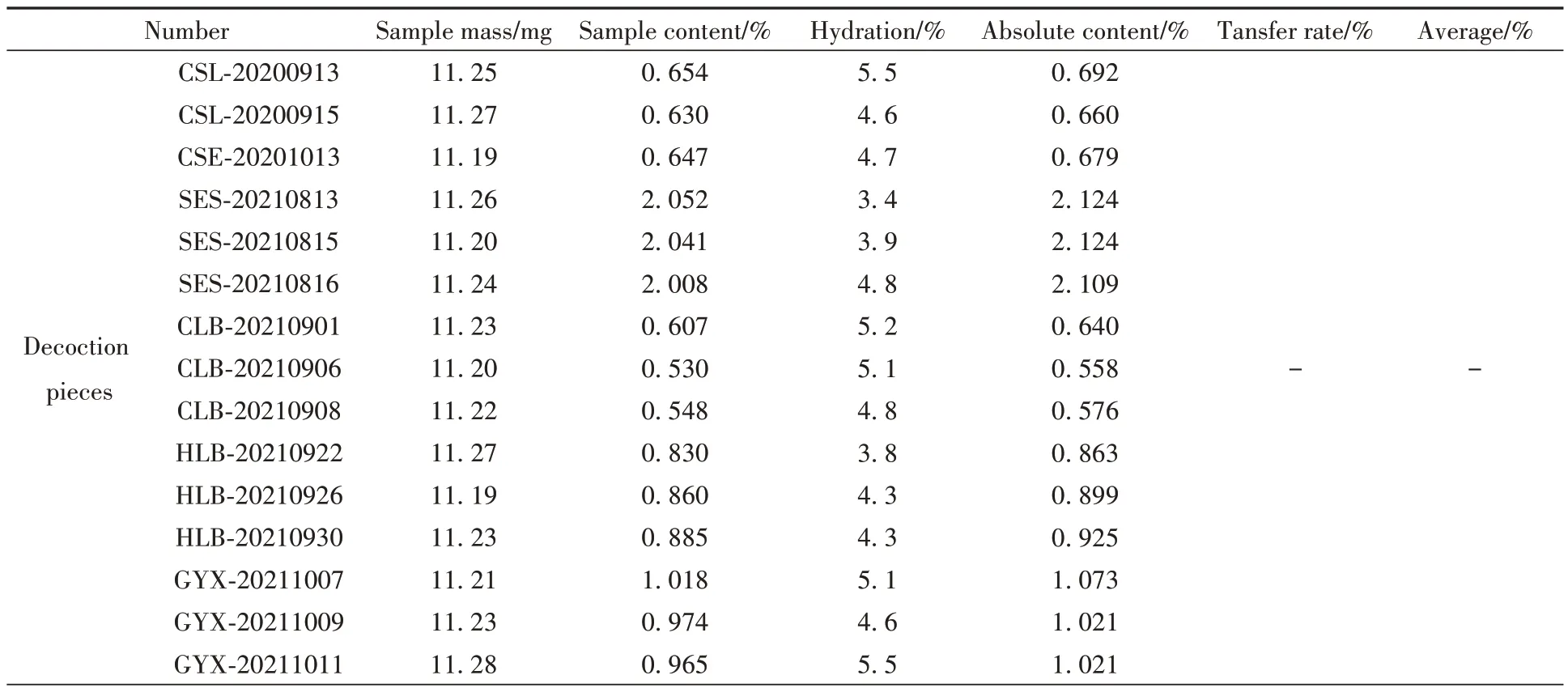
表6 饮片-YZP样品异荭草苷质量传递结果Table 6 The mass transfer results of isoorientin between decoction pieces and YZP sample
2.2.2 方法学考察
2.2.2.1 专属性实验
取1.2.3.2 小节2 种对照品溶液各10 μL,按照1.2.3.4 小节色谱条件分别进行HPLC 测定,结果显示荭草苷、异荭草苷峰形良好,分离度高(R>1.5),理论塔板数不低于5000。
2.2.2.2 线性关系考察
1)淡竹叶饮片: 精密吸取浓度为0.5001 和0.4990 mg/mL 的荭草苷、异荭草苷对照品溶液,加甲醇制成一系列不同质量浓度的对照品溶液,按照1.2.3.4 小节色谱条件进样分析,测定峰面积,以峰面积(Y)对质量浓度(X)进行线性回归,结果见表7。
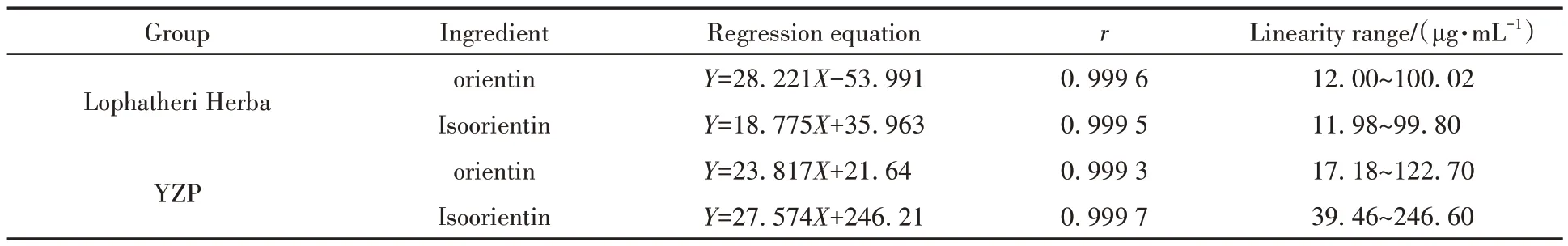
表7 淡竹叶饮片与YZP中异荭草苷线性关系考察结果Table 7 Results of isoorientin linear relationship investigation between Lophatheri Herba and YZP
2)YZP: 精密吸取浓度为0.1227 和0.2466 mg/mL 的荭草苷、异荭草苷对照品溶液,加甲醇制成一系列不同质量浓度的对照品溶液,按照1.2.3.4小节色谱条件进样分析,测定峰面积,以峰面积(Y)对质量浓度(X)进行线性回归,结果见表7。
2.2.2.3 精密度实验
精密吸取1.2.3.2 小节对照品溶液各10 μL,按照1.2.3.4 小节色谱条件连续进样测定6 次。饮片和处方中荭草苷、异荭草苷RSD 值分别为0.46%、0.26%(n=6)和0.77%、1.49%(n=6),表明仪器精密度良好。
2.2.2.4 重复性实验
精密称取淡竹叶饮片和YZP样品各6份,按1.2.3.1小节方法制备,依1.2.3.4小节色谱条件测定,计算平均含量及RSD 值。淡竹叶饮片、YZP中荭草苷平均质量分数分别为0.5971%为0.0720%,RSD 值为0.43%、2.59%; 异荭草苷平均含量分别为1.201%、0.1885%,RSD 值为0.25%、2.94%, 表明该方法重复性良好。
2.2.2.5 稳定性实验
按1.2.3.1 小节方法制备溶液,分别在0、2、4、8、12 和24 h 进样,依法测定,考察样品稳定性。淡竹叶饮片、YZP 中荭草苷峰面积RSD 值为3.06%、2.69%,异荭草苷峰面积RSD 值为3.20%、1.14%,表明供试品溶液在制备24 h内稳定性良好。
2.2.2.6 加样回收率
1)淡竹叶饮片: 精密称取淡竹叶饮片样品(S1)样品0.5 g,共6 份,按1∶1 质量比精密加入对照品,按1.2.3.1小节方法制备溶液,按1.2.3.4小节色谱条件进样测定,计算加样回收率,结果见表8和表9。荭草苷平均加样回收率为99.43%,RSD为1.53%; 异荭草苷平均加样回收率为96.84%,RSD为0.69%,表明方法准确性较好。
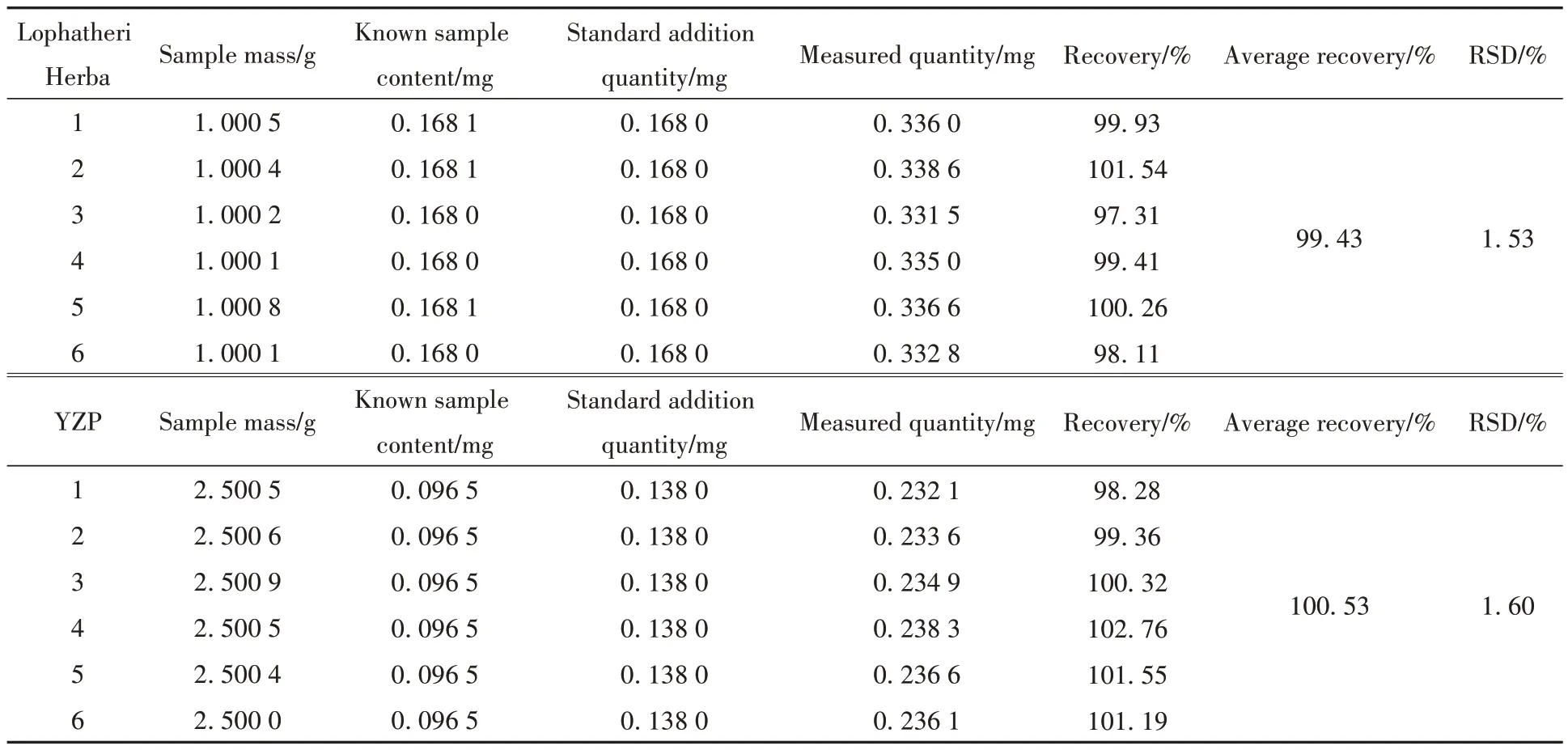
表8 荭草苷加样回收率实验Table 8 Spike-and-recovery experiment of orientin

表9 异荭草苷加样回收率实验Table 9 Spike-and-recovery experiment of orientin
2)YZP: 精密称取YZP(S15)样品2.5 g,共6份,按1∶1质量比精密加入对照品,按1.2.3.1小节方法制备溶液,按1.2.3.4小节色谱条件测定,计算加样回收率,结果见表8和表9。荭草苷平均加样回收率为100.53%,RSD为1.60%; 异荭草苷平均加样回收率为100.68%,RSD为1.16%,表明方法准确性较好。
2.3 化学计量学分析
2.3.1 CA
将15 批YZP 样品21个共有峰峰面积作为15×21阶原始数据矩阵输入到Origin 2019b(64 Bit)中,聚类方法选择系统聚类分析法,度量标准选择Euclidean 距离进行聚类分析,结果见图4。结果表明,15 批YZP 被分为A 类(1、3-6、9、11、13、14 批)和B 类(2、7、12、15 批),说明不同批次之间的YZP 间存在质量差异。所采购的饮片多数有2 种以上的主产区,因此,由于气候、土壤、水质和采收时间等因素的不同,药材的质量也良莠不齐[16]。YZP属B类的第2、7、12和15批次中相比于A类饮片来自道地产地的较多,与其它来源的药材相比,其质量更好,因此推测道地药材的种类在方剂中所占的比例与复方整体质量密切相关。

图4 15批YZP聚类分析(CA)结果Fig.4 Results of 15 batches of YZP CA
2.3.2 PCA
以YZP指纹图谱21个共有峰峰面积的15 × 21阶原始数据矩阵,导入SIMCA 14.1进行主成分分析,共得到3 个主成分,累计贡献率82.4%,表明这3 个主成分能够体现出大部分信息; 15 批YZP 被划分为两类,印证了聚类分析结论。此外,解释能力参数R2x和预测能力参数Q2两个值分别为0.885 和0.61,均大于0.5,说明模型的稳定性高、预测能力好[17]。PCA得分图见图5。
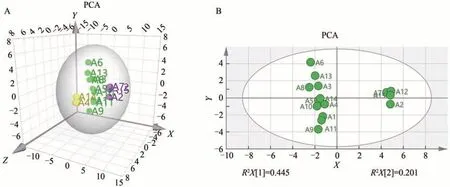
图5 YZP主成分分析(PCA)得分图Fig.5 PCA score chart of YZP
2.3.3 OPLS-DA
将15×21阶原始数据矩阵输入SIMCA 14.1中进行OPLS-DA,其相关分析所得图见图6。其中,R2x、R2y和Q2值分别为0.629、0.997、0.994,均大于0.5,反应模型本身具有较好的预测性、稳定性[18]。图6A进一步印证了CA 和PCA 的结论; VIP 值(变量投影重要性值)反应每一指标对整体的贡献度,一般认为VIP 值≥1时具有参考意义[19],另外VIP 值越大,其贡献率越大,图6B 中贡献率由大致小分别为17、5、1、8、9(异荭草苷)、18、16、20(连翘苷)、21和13(牡荆素)号峰,贡献率均具有参考意义; 另外,还考察了模型拟合程度,随机排列200 次Y矩阵变量进行permutation 实验,所得图见图6C,结果显示R2截距0.358(一般R2<0.4),Q2截距-0.705(一般Q2<0.05),无过度拟合的情况[20],适用于YZP 批次间质量差异的判别与分析。
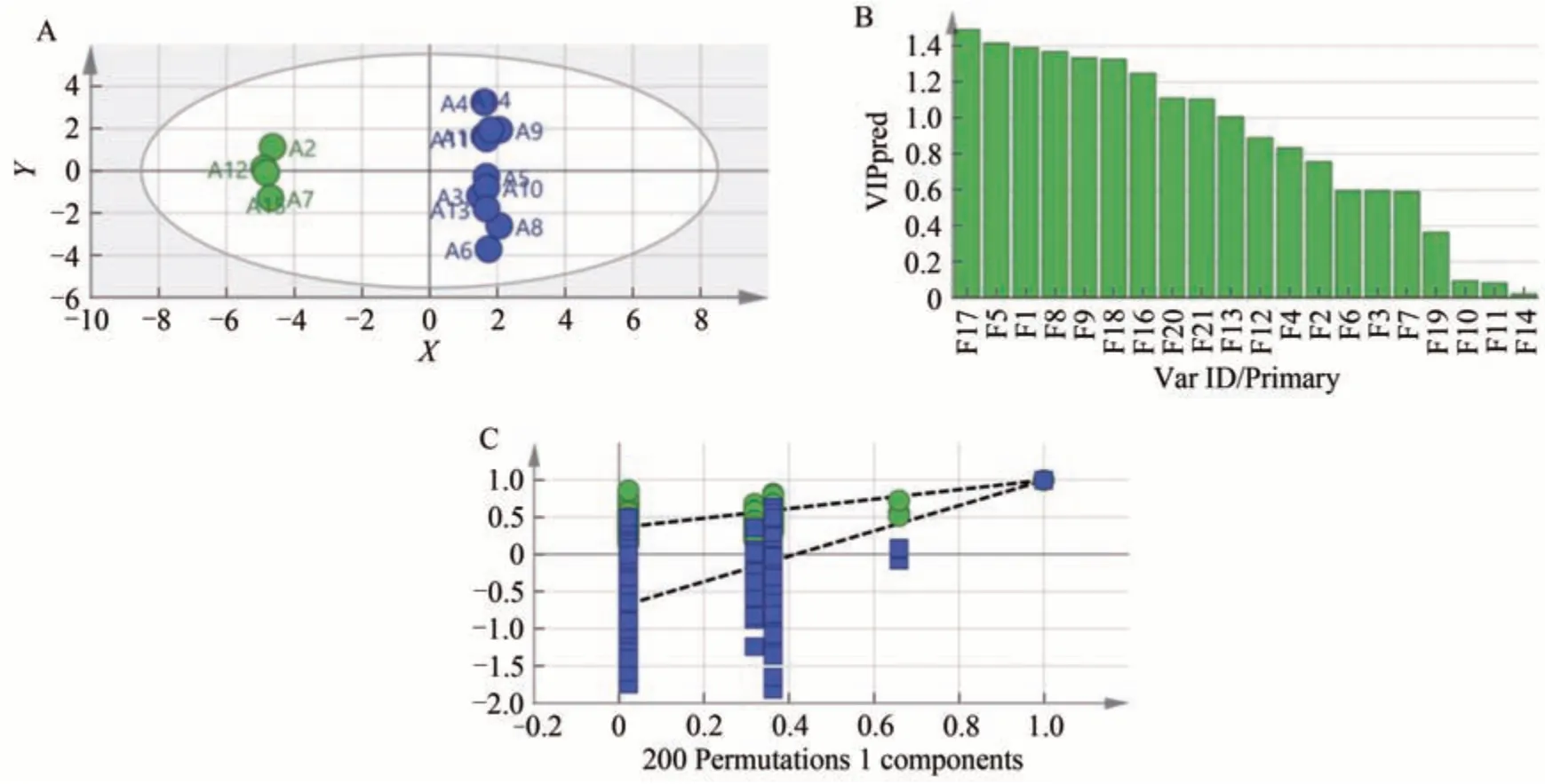
图6 15批YZP OPLS-DA分析结果Fig.6 OPLS-DA analysis results of 15 batches of YZP
OPLS-DA中获得了贡献率较大10个差异性成分,其中包含了连翘苷、连翘酯苷A、异荭草苷和牡荆素等,与其能治疗皮肤炎症性疾病有密切关系,杨本军等[21]认为连翘苷能够对脂多糖诱导的炎症具有调控作用; Sung等[22]实验发现连翘中的连翘酯苷A、连翘苷、松脂醇二葡萄糖苷和连翘脂素4个成分通过抑制人角质形成细胞TARC、MDC和RANTES的产生进而改善过敏性皮炎; Shi等[23]实验发现直接静脉注射异荭草苷能够有更好的提高生物利用度和维持更长时间的有效浓度,从而达到抗炎抗氧化的作用; Zhang等[24]认为牡荆素能够促进炎症细胞的凋亡,使炎症因子水平正常化,对于炎症治疗有很好的疗效。
2.4 供试品溶液制备方法考察
供试品溶液制备主要考察了不同提取溶剂(60%、80%、100%甲醇和乙醇)、不同提取时间和不同提取方法(回流30、60 和90 min; 超声15、30 和45 min)3 个方面,通过比对色谱峰峰形、数量、峰面积和分离度等,最终认为80%甲醇超声提取30 min不仅提取时长适宜、提取方法易操作,而且色谱图的整体效果最佳。除此之外,还考察了不同供试品溶液浓度,确定加入溶剂量为30 mL,分别称取YZP样品3.00、5.00 和8.00 g,观察后确认在取样量为5.00 g时其峰面积大小与强度适中。
2.5 色谱条件考察
通过DAD检测器对YZP供试品溶液进行全波段扫描,在210 nm条件下指纹图谱信息的完整性和基线平稳程度较高,能够使指纹图谱信息最大化,同时也有适宜的色谱峰数量、峰形和分离度。考察了不同流动相对色谱图的影响,分别为有机相(甲醇、乙腈)和无机相(水、0.05%及0.1%的甲酸水溶液、磷酸水溶液),梯度洗脱后确定流动相为乙腈-0.05%磷酸水溶液。另外,还对不同流速(0.8 和1.0 mL/min),不同柱温(30、35和40 ℃),不同进样量(2、5和10 μL)进行考察,确定最终条件为“流速0.8 mL/min,柱温30 ℃,进样10 μL”。以上研究进一步确定了YZP 指纹图谱分析方法,方法学验证的精密度、重复性和稳定性RSD均小于2%,表明该方法稳定可靠。
2.6 指纹图谱建立
本研究建立了YZP 的指纹图谱,但对于处方中的矿物药滑石粉和特殊质地药材通草无法检测到相关色谱峰,后续应采用液质联用等技术探究二者化学组成及检测指标。
滑石粉为硅酸盐类矿物,主要成分为含水硅酸镁,2020 版中国药典中采用了滴定法对其中的可溶性钙镁进行含量测定,除此之外有少量文献报道了对滑石粉的质量控制方法,多采用了粉末X射线衍射技术[25-26],因此YZP中滑石粉的质量控制方法需要后续单独建立。
通草为五加科植物通脱木Tetrapanax papyrifer(Hook.) KKoch 的干燥茎髓,其本身质地疏松轻盈,在称量提取过程中存在体积大、易飞絮、吸水性强等问题,导致了含量测定困难。而2020版中国药典中并未建立通草的含量测定方法,有文献建立了通草水提液-三氯甲烷萃取部位的超高效液相色谱(UPLC)指纹图谱[27],因此对通草的提取方法和测定方法应重新进行考察。
3 结 论
采用HPLC 法建立YZP指纹图谱测定方法和YZP中荭草苷、异荭草苷含量测定方法,辅以化学计量学分析筛选出导致组间差异的主要成分,实现了YZP 的外部质量控制及内部影响质量因素探究,同时通过对淡竹叶饮片-YZP复方的量值传递规律的把握,进一步确定了YZP “外部质量控制-内部质量探究-制备工艺确认”的质量评价体系,为后续YZP的质量标准研究提供科学依据。
