水系锌离子电池宽温域性能的电解质改性策略研究进展
2024-04-17何灵均林楚园肖富玉赖文斌钱庆荣黄晓霞陈庆华曾令兴
程 羽 何灵均 林楚园 林 慧 肖富玉 赖文斌钱庆荣,2 黄晓霞 陈庆华,2 曾令兴,2*
1(福建师范大学环境与资源学院, 聚合物资源绿色循环利用教育部工程研究中心, 福州 350007)
2(南开大学化学学院, 先进能源材料化学教育部重点实验室, 天津 300071)
3(福建水利电力职业技术学院, 三明 366000)
随着全球能源需求的不断增加、气候变化的威胁和不可再生能源资源的日益稀缺,迫切需要开发更环保的能源生产方法[1-2]。目前,锂离子电池(LIBs)凭借其高能量密度和出色的循环寿命,是应用最广泛的储能设备[3]。然而,LIBs 依赖于高活性的锂和有毒、挥发性和易燃的电解质,存在一定的安全隐患[4-7]。凭借着成本低、安全性高和容量高(820 mA·h/g)[8]的优点,水系锌离子电池(AZIBs)被广泛应用于大规模储能系统[9-11]。
与传统的有机电解质相比,水系电解质具有以下优点: 1)成本低廉,不易燃,安全性高; 2)离子电导率远高于有机电解质; 3)在水系电解质中,正(负极)过程的电荷转移电阻和相关活化能明显较低,促进了金属离子去溶剂化,增强AZIBs 中阴极-电解质界面的离子传输动力学[12]; 4)作为具有高介电常数的极性质子介质,水可以显著提高锌盐的溶解度[13-14]。
基于上述优势,AZIBs 具有广泛的应用前景,随着对能源需求的持续飙升和更多应用场景的出现,人们希望AZIBs 能够在较宽的温度范围下发挥作用,例如地下勘探、航空航天工业和极地研究等领域[15-20]。但水对温度的敏感性阻碍了其实际应用。在低温下,水电解质的凝固导致离子电导率低,粘度和电荷转移阻抗增加,电解质的体积膨胀和电极与电解质之间的界面分离,致使电池性能下降[21-25]; 在高温下,会出现电解质中溶剂水的挥发、水诱导的副反应(包括析氢反应和锌腐蚀)加剧以及阴极材料的溶解等问题[26-27]。
作为电池的重要组成部分,电解质的种类、性质会影响电池的各项性能,甚至影响反应机理[28]。因此,对电解质进行改进能够显著提升电池的高低温性能,例如,在低温下使用高浓盐电解质来破坏氢键网络,降低电解质的凝固点; 在高温下,使用添加剂来抑制副反应,避免电极的腐蚀,延长电池寿命。鉴于解决AZIBs 温度问题的重要性和紧迫性,本文主要从低温和高温2 个方面系统总结了2021-2023 年以来关于电解质策略的研究进展(图1),并对宽温域条件下AZIBs未来的发展做出了展望。

图1 宽温域下AZIBs的电解质策略Fig.1 Electrolyte strategy for AZIBs in a wide temperature range
1 低温下的水系锌离子电池
AZIBs的低温性能主要取决于电解质中的离子传输和电极中的离子扩散,因此,目前的研究工作主要集中在降低电解质的凝固点和提高离子电导率上。水分子间的氢键对于水在低温下的离子电导率和冻结特性起着重要作用,其驱动着从无序的水到有序的冰的相变。故而,提高低温性能的一般方法是削弱H—O键的强度或抑制水中氢键的形成。本节将介绍一些电解质策略如何应对AZIBs在低温下面临的挑战。
1.1 高浓度盐电解质
当温度降至0 ℃以下时,水分子行为的改变,使它们能够形成0.52 个额外的氢键,导致水分子从无序状态转变为有序状态,形成固体冰[29-30]。因此,通过调节水中O 和H 原子的化学环境以破坏氢键网络可以有效降低水系电解质的凝固点。根据拉乌尔定律指出的溶液依数性: 对于难挥发非电解质的稀溶液,凝固点随离子浓度的增加呈线性下降[29,31-32],即ΔTf=T水-T溶液=kf·m,其中,ΔTf为溶液凝固点下降温度,T水和T溶液分别为溶剂和溶液的热力学凝固点(水的热力学凝固点为0 ℃),kf为凝固点下降常数(单位为K·kg/mol或℃·kg/mol,其中水的kf值为1.86 ℃·kg/mol),m为溶液的质量摩尔浓度(mol/kg),此数值只取决于溶剂,而与溶质无关。原则上,随着盐浓度的增加,水中更多的氢键会被破坏。然而,大量盐的引入会影响溶液的物理特性。首先,阴离子和阳离子之间的相互作用增强会导致溶液粘度增加。同时,随着温度的降低,盐的溶解度会降低,这导致盐的析出,严重限制了液体的温度范围[33]。因此,为了实现在极低温度下工作的电解质,必须考虑溶液的浓度。
“盐包水”电解质(WiSE)已经被开发用于高性能水系电池。该电解质类似于高盐和低水浓度的离子液体,高盐浓度能够延长电化学稳定性窗口,并增强电极材料在水环境中的表面结构[34-36]。高浓度电解质中游离阳离子、阴离子之间的协同作用,直接决定了降低水电解质冰点的有效性[37],同时还可以减少Zn2+离子周围的溶剂分子,改变溶剂化结构以及阳离子和阴离子的传输行为(图2a)[29]。Sun等[38]开发了一种超低凝固点(-122 ℃)、高离子电导率(-70 ℃时为1.47 mS/cm)的4 mol/L Zn(BF4)2电解质,BF-4可以与多达3 个水分子形成O—H···F。此外,2 个BF-4取代水分子进入Zn2+离子的溶剂化层,这均有效地阻止了它们形成有序的氢键网络(图2b)。Zn//四氯苯醌(TCBQ)电池在-95~25 ℃内保持良好的电化学性能,展现出优异的低温性能(图2c)。

图2 (a)“盐包水”的作用机理[29]; (b)不同浓度Zn(BF4)2中2种氢键的占比[38]; (c) Zn//TCBQ电池在-95~-60 ℃温度范围内的充放电曲线[38]; (d)计算Zn2+溶剂化构型和Mg2+溶剂化构型的形成能和水合半径[53]; (e)不同类型氢键的比例[37]; (f) PAM-H2O-Gly、PAM-H2O-EG、PVA-H2O-Gly 和PAA-H2O-Gly 的DFT 优化结构[53];(g) PAM-H2O-Gly、PAM-H2O-EG、PVA-H2O-Gly 和PAA-H2O-Gly 的相互作用能和氢键的平均长度[51]; (h)防冻水凝胶电解质的原理图和机理[54]; (i)通过DFT模拟计算得到Zn(BF4)2-PAM-H2O体系和ZnSO4-PAM-H2O体系的结合能[54]; (j) MD模拟得到的水分子间形成氢键的平均数[54]Fig. 2 (a) The mechanism of “ water-in-salt” electrolyte action[29]; (b) The proportion of two hydrogen bonds in different concentrations of Zn(BF4)2[38];(c) The charge-discharge curves of Zn//TCBQ battery in the temperature range from -95 ℃ to -60 ℃ were obtained[38]; (d) The calculated formation energy and hydrated radius of Zn2+solvation configuration and Mg2+ solvation configuration[51]; (e) The ratio of different types of HBs[37]; (f) DFT optimized structures of PAM-H2O-Gly, PAM-H2O-EG, PVA-H2O-Gly and PAA-H2O-Gly were obtained; (g) The interaction energies and the average length of hydrogen bonds of PAM-H2O-Gly, PAM-H2O-EG, PVA-H2O-Gly and PAA-H2O-Gly were calculated[51];(h) The principle diagram and mechanism of antifreeze hydrogel electrolyte[54];(i) The binding energy of Zn(BF4)2-PAM-H2O system and ZnSO4-PAM-H2O system obtained by DFT simulation[54];(j) The average number of H-bonds formed between water molecules obtained by MD simulation[54]
尽管许多研究着重于引入氢键受体改变H原子的配位环境以降低电解质的凝固点,但调节O原子化学环境以抑制结冰的研究却较为少见。Sun等[37]提出了一种凝固点低至-120 ℃的3.5 mol/L Mg(ClO4)2+1 mol/L Zn(ClO4)2电解质,引入氧配体Mg2+和氢配体ClO-4,其中,Mg2+作为氢键供体,与H2O中的O原子形成稳定的水合离子(图2d)。而ClO-4作为氢键受体,能在H2O 中与H 原子形成弱氢键,水分子中氢键的比例显著降低(图2e)[37],当温度降至-70 ℃时,Zn//Pyrene 4,5,9,10-四酮(PTO)电池在0.5 C(200 mA/g)时显示出101.5 mA·h/g的高放电容量。
高浓盐电解质主要通过以下途径破坏氢键网络: 1)改变H 原子的配位环境; 2)改变O 原子的配位环境; 3)改变Zn2+的溶剂化结构,从而降低溶剂水的凝固点,扩大电解质的电化学稳定性窗口,提高电池防冻性能[29],但其也存在着高粘度、严重的盐沉淀和成本高等问题[39-40],仍需不断研究改进。
1.2 凝胶电解质
凝胶电解质也是提高AZIBs 低温性能的有效方法。水凝胶通常由柔性交联水合聚合物链组成,其具有丰富的亲水官能团,如—OH、—COOH、—SO3和—NH2,形成分子内或分子间的氢键[41],因此水分子和水凝胶网络之间的相互作用可能导致水凝胶中水的凝固温度更低[42]。
设计具有防冻和防干燥性能的凝胶电解质的关键是削弱其水分子之间的原始氢键。聚丙烯酰胺(PAM)由于其丰富的酰胺基,通常用作凝胶电解质的聚合物基质[43-46]。甘油(Gly)作为一种常见的冷冻保护剂和保湿剂,可以提供大量的羟基与水分子构建强氢键[47-50]。Wang 等[51]研发了一种基于Gly 和PAM 的防冻防干凝胶电解质。如图2f 和2g 所示的PAM-H2O-Gly、PAM-H2O-EG、PVA-H2O-Gly 和PAAH2O-Gly 的DFT 优化结构、相互作用能和氢键的平均长度可知,Gly 和PAM 链分别具有丰富的羟基和酰胺基,与水分子之间通过氢键的作用,避免了低温下凝胶电解质的冻结。其中使用这种凝胶电解质的柔性锌离子电池即使在充电/放电500次循环后,在-40 ℃下仍保持其初始容量的76.8%。
添加高浓度的可溶性离子也可提高凝胶电解质的防冻性能[52-53]。Shi等[54]设计了一种基于PAM的饱和Zn(BF4)2的防冻水凝胶电解质(图2h)。在该电解质中,得益于F原子的强电负性,BF-4可以有效地打破水分子之间原有的氢键网络,与ZnSO4-PAM凝胶电解质相比,Zn(BF4)2-PAM水凝胶电解质具有更低的结合能,水分子间的平均氢键数更少(图2i和2j)。因此,这种凝胶电解质在-70 ℃下保持未冻结状态。
凝胶电解质具有不易泄漏、抑制阳极表面锌枝晶的生长、减少副产物的产生和减弱析氢反应(HER)[55]以及优异的离子导电性、良好的韧性、低界面阻抗和与电极的高集成度等优点[56],因此被认为是液体和全固态电解质的优异替代品[42,57-59]。尽管凝胶电解质具有上述优势,但其内部的大孔径导致自由水分子起主导作用,极性基团对聚合物骨架的影响减弱,这使得凝胶电解质在低温下容易冻结[60]。为了解决这个问题,水凝胶策略通常与助溶剂、添加剂或高浓度盐结合使用,进一步扩展电解质的低温应用范围。
1.3 电解质添加剂
除了上述方法之外,电解质添加剂也可以拓宽电解质的温度窗口[24,61-62]。电解质添加剂具有用量小、见效快的特点[32],使用添加剂降低水系电解质冰点的机制是通过添加剂与水分子之间的竞争性相互作用破坏水网络内的氢键。广泛使用的防冻添加剂包括乙二醇(EG)[63]、二甲基亚砜(DMSO)[64-65]和乙腈(AN)[66]等。
1-丁基-3-甲基咪唑鎓三氟甲磺酸酯([BMIM]OTF)是一种熔点极低(-71 ℃)的水溶性离子液体,常被用作AZIBs 的功能电解质添加剂。Chen 等[67]将0.5 mol/L [BMIM]OTF 用作3 mol/L 三氟甲磺酸锌(Zn(OTF)2)水性电解质的添加剂。 [BMIM]OTF 的添加仅牺牲了5.8%的室温离子电导率却能显著提高防冻能力。 [BMIM]OTF添加剂可以优先吸附在Zn电极上(图3a),调节水合Zn2+离子的溶剂化鞘,降低Zn 电极的腐蚀活性,并能够形成有机、无机混合固体电解质界面层。添加[BMIM]OTF 的Zn//H11Al2V6O23.2(HAVO)电池在-30 ℃下仍表现出优异的循环性能。Lin 等[68]选择一种三功能电解质添加剂乙酸铵(CH3COONH4),以提高AZIBs 的电化学性能(图3b)。研究结果表明,NH+4(氧配体)和CH3COO-(氢配体)在锌电极表面具有优先吸附作用,这阻遏了活性水分子与锌阳极直接接触,同时调节了电解质的pH 值,达到了抑制寄生反应的效果。基于此组装成的具有ZnSO4∶CH3COONH4电解质的Zn//Zn对称电池在-10 ℃下循环900 h(图3c)。

图3 (a)不同组合电解质的Eb值[67]; (b)含/不含CH3COONH4添加剂的电解质中Zn 表面演变的示意图[68];(c)锌对称电池-10 ℃下在ZnSO4∶CH3COONH4电解质和ZnSO4电解质中的长寿命循环性能[68]; (d)低温水系锌电池的细胞-核结构电解质设计示意图[69]; (e)表示具有DAA、DDAA、DA、DDA 和非HB 的H2O 分子的示意模式[69]; (f)有无山梨醇添加剂的锌沉积过程对比[70]; (g)不同山梨醇添加量电解液的离子电导率值, g中插图为未添加山梨醇的2 mol/L ZnSO4水系电解液在-10 ℃的照片[70]Fig. 3 (a) Eb values of different couples[67]; (b) A schematic diagram of Zn surface evolution in electrolytes with/without CH3COONH4 additives[68]; (c) Long-life cycling performance of zinc symmetric cells in ZnSO4∶CH3COONH4 and ZnSO4 electrolytes at -10 ℃[68];(d) Schematic illustration of the cell-nucleus structured electrolyte design for low temperature aqueous Zn batteries[69]; (e) A schematic pattern of H2O molecules with DAA, DDAA, DA, DDA and non-HB[69]; (f) Comparison of Zn deposition process with or without sorbitol additive[70]; (g) Ionic conductivity values of the electrolytes with different amounts of sorbitol, The inset in g shows the photograph of 2 mol/L ZnSO4 aqueous electrolyte without sorbitol at -10 ℃[70]
上述研究大多采用高极性分子,然而,初级溶剂化鞘中的有机分子参与不可避免的扩大了脱溶惩罚,降低了离子电导率和Zn2+扩散动力学。Dong等[69]通过将低极性的1,2-二甲氧基乙烷(DME)引入稀的1 mol/L Zn(OTf)2水溶液中,设计了一种细胞核结构的电解质(图3d),其特征是富含(OTf)-的Zn2+初级溶剂化鞘(PSS,内核)和DME 调制的Zn2+外溶剂化鞘,DME 的加入在不插入Zn2+-PSS 的情况下促进了Zn2+-OTf-配位,实现了超低温下良好的反应动力学。此外,DME 破坏了水原有的氢键网络,有效地降低了电解质的凝固点(图3e)。
尽管使用电解质添加剂延长AZIBs 的寿命,但许多先前报道的添加剂不够环境友好,Quan 等[70]使用具有丰富羟基的食品级山梨醇(C6H14O6)作为电解质添加剂,山梨醇添加剂可以调整Zn2+离子的配位环境,改变Zn 电极表面,破坏水分子间的氢键,降低电解液的活性(图3f),添加了山梨醇的电解液在-10 ℃时仍不结冰,并仍能提供较大的离子电导率(图3g)。因此,改性电解质使Zn//MnO2电池在-10 ℃时,仍能具有良好的电化学性能。
在添加剂和水分子之间构建稳定的氢键是设计防冻水电解质的关键。在设计具有溶剂添加剂的水基电解质时,有必要确定锌离子、溶剂和水之间的相互作用。有机添加剂结合水溶液和非水溶剂的优势,在构建能够有效适应低温环境的固体电解质界面方面发挥着重要作用[71-73]。然而,有机添加剂是有毒的,而且有机添加剂的加入会影响电解质的离子电导率。因此,还需要继续研究安全无污染的有机/无机添加剂,在不影响AZIBs的独特安全特性的情况下实现低温性能。
1.4 共晶电解质
深共晶溶剂(DES)通常被定义为至少由2 种成分组成的体系,这2 种成分相互结合形成新的共晶相,其熔点低于任意单一成分的熔点[6]。在低共晶区,随着温度的降低,结晶主要由水分子形成。而在高共晶区,更易形成盐晶体或晶体水合物。在最低共晶点,冰与盐或结晶盐水合物与水溶液达到平衡状态。这些盐的水合物混合物的凝固点远低于纯冰的凝固点。因此,使用共晶电解质能够提升AZIBs 的低温性能。Ma 等[8]提出了Zn2+的外部溶剂化壳由2-丙醇组成的“共晶溶剂化壳”概念,随着具有不同异构体和碳链长度醇的加入,醇分子可以取代水分子从而调节外部溶剂化壳层,形成共晶层(图4a)。由于对Zn表面特定晶面有强亲和力,共晶溶剂化壳层促进了Zn的定向沉积,并显示出良好的去溶剂化动力学。在-20 ℃的条件下,Zn//V2O5袋式电池可以循环1000圈,表现出较为优异的电化学性能。

图4 (a)共晶溶剂化结构的结构示意图[8]; (b)环丁砜的加入破坏了本体H—O—H…O—H 网络,并形成一种新型的环丁砜-H2O 网络[72]; (c)基于1∶1 电解质的Zn-VOH 电池在-20 ℃下的倍率性能[72]; (d) -20 ℃不同溶剂化结构对Zn镀层影响的示意图[74]Fig. 4 (a) Structure diagram of cocrystal solvation structure[8]; (b) The addition of sulfolane destroyed the bulk H—O—H…O—H hydrogen bond network and formed a new type of sulfolane-H2O hydrogen bond[72]; (c) The rate performance of Zn-VOH battery based on 1∶1 electrolyte at -20 ℃[72]; (d) The schematic diagram of the effect of different solvation structures on Zn coating at -20 ℃[74]
环丁砜作为一种价格合理、环境友好的非质子极性溶剂,由于其存在2个孤对电子,可以提供比水分子更多的氢键受体,常被用作共晶溶剂。Li等[72]提出了一种可以打破水分子间氢键的Zn(TFSI)2-硫烷-水深共晶溶剂混合电解质。与其它砜基添加剂不同,超高浓度环丁砜(质量分数87%或93%)的引入表现出DES系统的特性,并消除了绝大多数本体游离水。这种策略切断了质子/氢氧化物的转移,并抑制了水的活性(图4b)。使得使用该混合电解质的Zn//V2O5·nH2O即使-20 ℃的低温条件下也能稳定运行(图4c)。
受ZnCl2共晶特征、低浓度和低成本需求的启发,Lu 等[74]利用Cl-阴离子诱导的与醋酸锌溶液的共晶相互作用,提出了一种氯功能化共晶(Cl-FE)电解质。如图4d所示,这种新型共晶液体与1,3-二氧戊环(DOL)展现出了高度的亲和性,能轻松形成具有独特的内/外共晶溶剂化结构的Cl-FE/DOL基电解质。这种结构更为有效地调节Zn 的溶剂化过程和重构氢键,同时有效地抑制副反应。使用3 mol/L ZnOAc1.2Cl1.8-DOL 组装的Zn//活性炭(AC)扣式电池在-20 ℃、2 A/g 下表现出91.2%的出色电容保持率和约100%的库伦效率。
值得注意的是,含水量较低的共晶电解质通常会导致低离子电导率和高粘度,降低电池在低温下的性能。共晶电解质未来的研究工作应致力于进一步探索合适的材料,并通过先进的非原位和原位表征与建模和模拟相结合,彻底研究共晶电解质的配位几何和形成机制[75]。AZIBs 在低温下的高性能仍需开展更多的研究工作,重点是改良共晶电解质的物理化学性质,并优化相关氧化还原反应的稳定性和活性。
2 高温下的水系锌离子电池
与低温时锌金属阳极由于形成不均匀的锌核而经历严重的锌枝晶生长不同,寄生反应(析氢和腐蚀)的加剧是锌金属阳极在高温下循环能力差的主要原因[76-78]。尽管水性电解质是不易燃电池的有利选择,但由于水分子的活性增强,大多数电解液在高温下稳定性较差。电池内部的高温会加速2个电极由水引起的副反应,并进一步影响AZIBs 的稳定性[79],因此下一节将讨论在高温条件下实现高稳定性AZIBs的电解质改性策略。
2.1 凝胶电解质
由于水在水凝胶结构中的保留,水凝胶可用于高温应用。引入添加剂通常是减少水分损失和提高水凝胶在极高温度下性能的必要手段。Jiang 等[80]首次将Gly 添加剂和冷冻/解冻技术结合起来设计了凝胶电解质。如图5a 所示,Gly 不仅能抑制水的冻结,还能与聚合物和水形成分子间和分子内氢键,促进柔性。同时,冷冻/解冻过程促进了位于交点的聚乙烯醇(PVA)微晶交联凝胶电解质的产生,显著提高了热稳定性和力学性能。基于此构建的宽温度范围准固态柔性锌离子混合超级电容器(FZHSC)可以在-30~80 ℃范围内工作(图5b),确保了其在全气候条件下的应用。Lu 等[65]采用聚丙烯酰胺(PAAm)(图5c)作为交联聚合物骨架,DMSO 作为有机添加剂,Zn(CF3SO3)2作为锌盐,开发了一种用于AZIBs 的PAAm/DMSO/Zn(CF3SO3)2多组分水凝胶电解质(记为PDZ-H电解质)。如图5d所示,PDZ-H电解液的离子电导率随环境温度的升高而增加,表明PDZ-H电解液具有良好的温度适应性。

图5 (a) PVA基凝胶电解质示意图[80]; (b)组装的防冻FZHSC在80、30、0和-30 ℃下的循环性能[80]; (c)合成PDZ-H电解质的过程示意图[65]; (d)不同温度下PDZ-H电解质的离子电导率[65]; (e)温度调节水凝胶电解质机制示意图[81]; (f)温度从30 ℃上升到100 ℃时,空白电解质(BE)、基线水凝胶电解质(BHE)和TRHE 的袋装电池的表观体积膨胀[81]Fig. 5 (a) The PVA-based gel electrolyte schematic[80]; (b) The cycle performance of the assembled antifreeze FZHSC at 80, 30, 0 and -30 ℃[80]; (c) Schematic diagram of synthesis process of the PDZ-H electrolyte[65]; (d) The ionic conductivity of the PDZ-H electrolyte at different temperature[65]; (e) The schematic diagram of the temperatureregulated hydrogel electrolyte mechanism[81]; (f) When the temperature rises from 30 ℃ to 100 ℃, the apparent volume expansion of the blank electrolyte (BE), the baseline hydrogel electrolyte (BHE) and the TRHE bagged cell[81]
调节氢键是提升凝胶电解质高温性能的重要手段之一。Meng 等[81]利用氢键相互作用向琼脂糖骨架中整合了具有吸热效应的相变链(图5e),制备了能适应温度变化的水凝胶电解质(TRHE)。得益于均匀的离子迁移通道水凝胶网络,使用该电解质可加速离子迁移并使离子均匀分布,抑制了枝晶的形成,有效地解决了锌腐蚀和析氢的问题。极端条件下,TRHE能经受骤然的热冲击; 因此,由于其热自适应(能适应温度变化)特性,其可在100 ℃的环境下正常运行一段时间(图5f)。
2.2 其他电解质
加入共溶剂作为电解质添加剂可以抑制高温下的HER 以及阴极材料的溶解[76-77]。Wang 等[82]使用了一种环境友好的拥挤剂1,5-戊二醇(PD)来制备Zn(OTf)2-H2O/PD共溶剂电解质,通过改变Zn2+溶剂化结构和增强H2O 的O—H 键来抑制水的反应活性(图6a),大大抑制了水引起的寄生反应,使锌能够在高温下沉积均匀,拓宽电解质的电压窗口(2.35 V),同时保持电解质的高阻燃性和热稳定性(图6b)。Zhou 等[76]通过引入多羟基聚合物(聚乙二醇、PEG)共溶剂,其中吸附在Zn 表面的PEG 诱导Zn2+的均匀沉积,抑制了枝晶的生长(图6c)。同时,PEG 和水分子之间的相互作用降低了自由水的活性,从而抑制了锌阳极在高温下的寄生反应,实现了AZIBs在宽温域(-20~80 ℃)下的高循环稳定性(图6d和6e)。
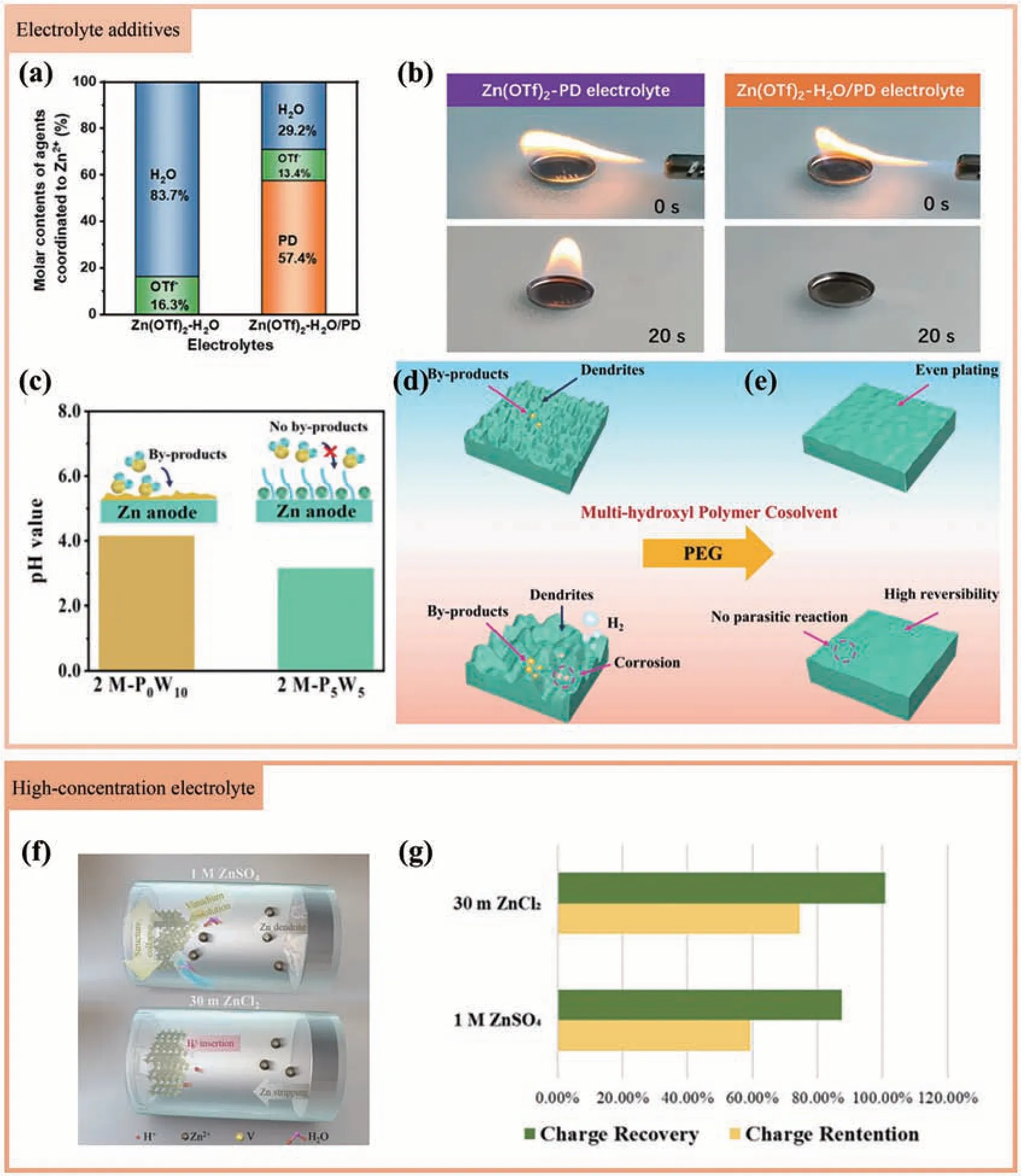
图6 (a) 25 ℃下Zn(OTf)2-H2O和Zn(OTf)2-H2O/PD电解质中不同试剂与Zn2+配位的比率[82];( b) Zn(OTf)2-PD和Zn(OTf)2-H2O/PD 电解质的点火试验[82];( c) pH 值低至3.23 的2 mol/L-P5W5共溶剂电解质的酸性环境可能有利于在较宽的温度条件下抑制副产物的生长[76]; 在不含(d)或与(e)多羟基聚合物共溶剂的水电解质中镀锌演示图[76];( f) 1 mol/L ZnSO4和30 mol/L ZnCl2电解质的电化学反应示意图[83];( g) V2O5阴极在各种电解质中高温储存(55 ℃)后的电荷保持和电荷回收[83]Fig.6 (a) The coordination ratios of different reagents to Zn2+ in Zn(OTf)2-H2O and Zn(OTf)2-H2O/PD electrolytes at 25 ℃[82]; (b) Ignition test of Zn(OTf)2-PD electrolyte and Zn (OTf)2-H2O/PD electrolyte[82]; (c) The acidic environment of the 2 mol/L-P5W5 cosolvent electrolyte with a pH value as low as 3.23 may be beneficial to inhibit the growth of by-products at a wide temperature[76]; the zinc plating demonstration diagram in a water electrolyte without(d) or with(e) polyhydroxy polymer cosolvent[76];(f) The electrochemical reaction diagram of 1 mol/L ZnSO4 and 30 mol/L ZnCl2 electrolyte[83];( g) The charge retention and charge recovery of V2O5 cathode after high temperature storage( 55 ℃) in various electrolytes[83]
当遇到高温时,水的快速挥发是不可避免的。因此,使用高浓盐电解质可以有效避免水的挥发。Tang等[83]使用30 mol/L ZnCl2作为电解质,抑制了晶体膨胀和界面寄生反应(图6f),增强了Zn//V2O5在高温储存时的可逆性并延长其保质期,在55 ℃下循环300 h后仍然有74.66%的容量保持(图6g)。
综上所述,高温电解质的主要原理是通过降低电解质的挥发性来调节电解质的热稳定性,故提高AZIBs 的高温性能可遵循以下原则: 1)使用亲水性或带电基团的水凝胶电解质; 2)使用能提高电解质热稳定性的添加剂; 3)提高电解质的盐的浓度; 此外,阴极材料在高温下容易溶解或分解,影响电池的寿命,因此,设计具有高温性能的电解质时还应充分考虑电解质对电极的影响。
3 可同时适应高温和低温的水系锌离子电池
拓宽AZIBs 温度适用范围的关键在于调节氢键网络,使其能够同时提升低温防冻性与高温热稳定性[84]。近年来,通过选用合适的电解质添加剂或采用凝胶电解质,可以在降低氢键强度的同时,抑制电解液的挥发和控制电极的分解反应,进而有效提高AZIBs在宽温度范围内的性能。
Niu 等[85]使用了一种特殊的非离子两亲性共聚物作为Zn(OTf)2水性电解质的添加剂。这种共聚物(称为APA)由亲水性丙烯酰胺和亲脂性甲氧基共聚而成,如图7a所示。这种添加剂的主要特点是其亲水性,可以从根本上抑制与水相关的副反应。此共聚物因具有亲水性和疏水性单元,从而促成了一个局部的纳米级H2O 贫乏环境,该环境下Zn2+基本上会从水性介质中分离出来。同时,亲水性片段在锌阳极上的优先吸附也产生了局部疏水层,协同保护金属免受直接的水性腐蚀的侵害。此外,这种调节后的电解质也增加了在阳极上的阴离子分解,产生了富F 和缺O 的界面,进一步增强了阳极的稳定性。因此,使用APA 添加剂的Zn//Zn 电池可以在从-30~50 ℃的宽温度范围内工作,其在1 mA/cm2、1 mA·h/cm2条件下能够持续8800 h(约为367 d)的超长循环。

图7 (a)不含和含APA 的Zn(OTf)2水性电解质中形态演变的示意图[85]; (b)基于PMPG-25 GPE 储能装置的ZIHC在5 A/g的循环性能[86]Fig.7 (a) The schematic diagram of the morphological evolution of Zn(OTf)2 aqueous electrolytes without and with APA[85]; (b) The cycle performance of ZIHC based on PMPG-25 GPE energy storage device at 5 A/g is studied[86]
Wan等[86]设计了一种基于2-丙烯酰胺基-2-甲基丙磺酸(AMPS)上的磺酸基的聚阴离子诱导的单锌离子凝胶聚合物电解质(GPE)。所得的P(AM-AMPS-Zn)/明胶(PMPG)的GPE 显示出优异的界面粘附力和高机械强度。同时,引入EG 作为溶剂的一部分,并向聚合物中加入高浓度的ZnCl2。AMPS 上的—SO3H 基团通过与Zn2+的螯合产生静电相互作用,这种相互作用不仅有助于降低Zn2+溶剂化鞘周围结合水的活性,减轻与水相关的寄生副反应,还能实现锌的均匀沉积,因此增强了电极与GPE 之间的界面稳定性。结合PMPG GPE 的优点,如图7b 所示,组装的ZIHC 可以在800 W/kg 的高功率密度下提供140 Wh/kg 的高能量密度以及出色的循环耐久性,在-20 和60 ℃的宽温域范围下,容量保持率分别达到了93.1%和84.2%。
综上所述,目前同时实现提高AZIBs 高低温性能的途径主要为使用合适的电解质添加剂或者凝胶电解质,以此达到减轻副反应、稳定阳极的目的。然而,从现有的研究可以看出,与单独针对高温或低温性能的电解质策略相比,为同时提升高低温性能而进行的电解质策略还有很多研究空间。因此,需要进一步加强这方面的研究,以便拓展AZIBs的应用范围。一些具有代表性的电解质的低温电导率、运行温度等如表1所示。

表1 AZIBs物理化学性能及电化学性能对比表Table 1 Comparison of physical and chemical properties and electrochemical properties of aqueous zinc ion batteries
4 结论与展望
AZIBs 由于其安全性高、成本低、丰富的储备以及环保性成为一种有前途的储能技术,然而,AZIBs运用于极端温度时面临着锌枝晶生长、不可逆电镀/剥离和电解质冻结/挥发等问题。使用电解质策略是解决上述问题的一种简单有效的方法。本综述系统总结了在高、低温度区域AZIBs 面临的挑战和解决方案,并提出了有效的电解质策略: 1)提高水电解质的溶质浓度; 2)使用固态电解质; 3)使用凝胶电解质; 4)向电解质中加入有效的添加剂; 5)使用共晶电解质。然而,对提升非室温下AZIBs性能的研究仍处于起步阶段,存在着相当大的挑战和机遇,针对AZIBs 在高低温环境下应用时存在的问题,我们提出以下几个观点与建议:
1)电解质在电池的阴极和阳极之间起着传递和导电电流的作用,是连接阴极和阳极的桥梁。为了更好地研究非室温下电解质的反应机理,应探索更先进和可靠的表征技术。
2)电极是电池的重要组成部分,然而,有机阴极可能溶解在有机溶剂基电解质中,而一些无机阴极可能在高温下溶解或分解。因此,对其高低温性能、抗渗性、与电解质之间的相互作用机理的研究也是提升AZIBs宽温域性能的重要一环。
3)选择电解质中盐的种类和浓度与电池在低温下的性能密切相关。特别是对于阴离子种类,不同阴离子的水合强度、电荷密度及其它特性对电解液的动力学产生不同的影响。高浓度盐策略虽然可以降低冰点,但存在成本高和离子电导率低的缺陷。此外,依据共晶效应,高浓度并不总是意味着溶液的冰点最低。通过研究水盐二元体系的共晶点以确定电解液中盐的适宜比例,可以更有效地降低成本、提高离子导电性,并进一步优化AZIBs在低温下的电化学性能。
4)水凝胶电解质在高温环境应用时,水蒸发无法避免,失水通常是从水凝胶表面直接接触电极开始的。干燥的水凝胶表面会失去其润湿性和粘附性,导致电极/电解质界面的电池电阻增加。深入研究凝胶电解质的结构对于进一步了解其在电极上的界面行为具有重要意义。
5)有机添加剂含氧官能团,可与自由水分子形成强氢键,破坏水分子之间的氢键网络,从而降低水电解质的冰点,明显提高AZIBs 的低温电化学性能。然而,有机添加剂具有易燃性和毒性,为了保持AZIBs的竞争力,应更加注意保持其本质安全性和低成本,还需要继续探索高安全性的有机添加剂和无污染无机添加剂。
6)为了开发实用的AZIBs,电化学测试应该模拟实际使用的质量加载量,同时应当构建标准化评价框架,利用先进和可靠的表征技术对其机理进行探索,以实现对AZIBs宽温域性能的合理评价。
