18F-FDOPA PET/CT 定量分析提高早期帕金森病的诊断效能
2024-04-15武婕周蕾蕾张逸悦蒋腾徐志宏张思伟白侠王峰
武婕,周蕾蕾,张逸悦,蒋腾,徐志宏,张思伟,白侠,王峰*
1.南京医科大学附属南京医院(南京市第一医院)神经内科,江苏 南京 210006;2.南京医科大学附属南京医院(南京市第一医院)医学影像科,江苏 南京 210006;3.南京医科大学附属南京医院(南京市第一医院)核医学科,江苏 南京 210006;4.江苏华益科技有限公司药物研发部,江苏 常熟 215522;5.内蒙古医科大学附属医院核医学科,内蒙古自治区分子影像学重点实验室,内蒙古 呼和浩特 010050;*通信作者 王峰 fengwangcn@njmu.edu.cn
帕金森病(Parkinson's disease,PD)是仅次于阿尔茨海默病的最常见神经系统退行性疾病[1],主要表现为震颤、强直、运动减少及姿势障碍等,起病隐匿。部分PD尤其是在疾病早期阶段,临床症状不典型,缺乏典型的运动症状,容易与多系统萎缩、原发性震颤、药物性PD等疾病混淆,误诊率高[2-3]。阿尔法突触核蛋白的沉积形成路易氏体及多巴胺神经元减少和功能降低是PD的特异性分子标志[4-6]。PD患者运动症状以及严重程度与纹状体的多巴胺能神经元变性及减少密切相关[7-8],本课题组既往利用单光子计算机发射断层围绕多巴胺转运体、多巴胺D2受体对PD的诊断及鉴别诊断进行研究,取得了较好的诊断效能[9-10]。PET/CT等神经成像技术对多巴胺能进行无创和定量评估,对于疾病诊断和进展监测具有重要意义[11-12]。6-18F氟-L-多巴(18F-FDOPA)作为L-多巴的类似物,是一种多功能显像剂,在人体内的代谢过程与L-多巴相似。目前18F-FDOPA PET/CT显像已用于评价PD患者突触前多巴胺能神经元功能[13-14]。本研究拟利用18F-FDOPA PET/CT对临床高度怀疑PD患者进行诊断及鉴别诊断。
18F-FDOPA PET/CT脑显像图像定量分析及标准化非常重要,纹状体与枕叶体积计数比(striatal to occipital ratio,SORs)常作为半其定量指标[15-17]。本研究通过HERMES BRASS半定量分析平台测量纹状体各亚区的SORs值,量化多巴胺能损伤情况,区分PD患者和健康对照;确定PD早期诊断定量参数,实现PD早期诊断;并使用人工智能技术对PD患者和健康对照者进行主成分分析,提高18F-FDOPA PET/CT对PD的诊断效能。
1 资料与方法
1.1 研究对象 回顾性收集2018年1月—2019年12月南京医科大学附属南京医院临床确诊的56例PD患者和同期本院体检中心27例健康对照者的18F-FDOPA PET显像结果。PD患者中33例早期(Hoehn-Yahr I~Ⅱ级),男18例,女15例,平均年龄(60.09±12.43)岁,23例晚期(Hoehn-Yahr Ⅲ~Ⅳ级)[18],男14例,女9例,平均年龄(67.09±10.42)岁;健康对照组中男15例,女12例,平均年龄(53.37±15.45)岁。各组性别差异无统计学意义(P>0.05),年龄差异有统计学意义(P<0.05)。
PD主要临床表现:①运动迟缓;②至少符合以下症状之一:肌肉强直;4~6 Hz静止性震颤;姿态不稳;③至少符合以下临床表现中的3项:单侧起病,静止性震颤,逐渐进展,发病后多为持续性不对称受累,左旋多巴治疗起初有效。排除其他各种继发性帕金森综合征(外伤性、肿瘤性、药源性、中毒性、血管性等)及帕金森叠加综合征。服用卡比多巴与左旋多巴的患者要求检查当日显像完成前停药。健康对照组年龄18周岁及以上,男性体重≥50 kg,女性体重≥45 kg,体重指数19~26 kg/m2,无心脑血管、恶性肿瘤、自身免疫疾病、脑外伤史。本研究经本院医学伦理委员会批准(KY20190509-05),已获得受试者书面知情同意。
1.218F-FDOPA PET/CT显像方法 使用uMI 780 112环数字光导PET/CT(上海联影医疗科技有限公司)。患者禁食至少4 h后,静脉注射18F-FDOPA(4 MBq/kg,江苏华益科技有限公司)。静息90 min后,运用三维扫描模式先后进行CT数据、PET数据采集,PET数据采集时间为20 min。采集完成后于图像处理工作站,运用有序子集最大期望法+飞行时间技术+高清技术5次迭代进行重建,得到脑断层图像。
1.3 图像分析 使用HERMES BRASSTM 2.6(Medical Solutions AB Stockholm Sweden)软件进行18F-FDOPA PET/CT图像半定量分析(图1),该软件可浏览感兴趣区(ROI)三维地图,进行视觉判断,也可通过平台给出各ROI的SORs,半定量分析18F-FDOPA的摄取情况。
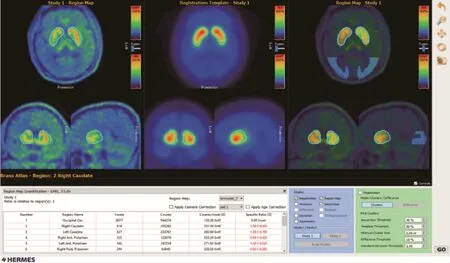
图1 HERMES BRASS软件对18F-FDOPA PET/CT图像半定量分析
导入患者PET和CT扫描数据,进行PET与CT图像融合。为准确配准,先对融合图像进行脑区裁剪得到脑PET图像,然后将CT和脑PET图像同时导入,与平台中标准脑模型进行配准,确定ROI,包括双侧尾状核、壳核(沿纵轴方向分为前、后部分)、纹状体和枕叶。通过聚类计算确定各ROI体积(voxel)、计数(count)和比值(counts/voxel)。使用HERMES BRASS平台计算纹状体各亚区与枕叶的SORs,并计算各组纹状体各亚区的不对称指数(striatal asymmetry index,SAI)。SAI = [(R-L)/(R+L)/2]×100。其中R为受累较轻侧的比值,L为受累较重侧的摄取值。
本研究中PD组平均年龄显著大于健康对照组。多项研究表明纹状体18F-FDOPA摄取可能与年龄无显著相关性[15,19]。因此在半定量分析过程中本研究未进行年龄校正。
1.4 统计学分析 使用SPSS 20.0和MedCalc 19.0.4软件。计量资料以±s表示,两组组间比较使用t检验,多组间两两比较采用LSD-t检验。使用人工智能技术对PD组与健康对照组行主成分分析,观察数据的聚类效果。通过受试者工作特征(ROC)曲线分析SORs值对PD的诊断效能,曲线下面积(AUC)比较采用Delong检验。P<0.05为差异有统计学意义。
2 结果
18F-FDOPA特异性地聚集于PD患者和健康对照者的基底节区,在小脑、枕叶等脑区分布极少,提示18F-FDOPA有很好的特异性。
2.1 晚期PD组与健康对照组比较 晚期PD组纹状体各亚区18F-FDOPA摄取显著低于健康对照组(P<0.001)(图2)。尾状核AUC为0.952、纹状体整体AUC为0.982,且后壳核(AUC 0.995)较前壳核(AUC 0.973)损失更为显著,鉴别PD准确度最高。
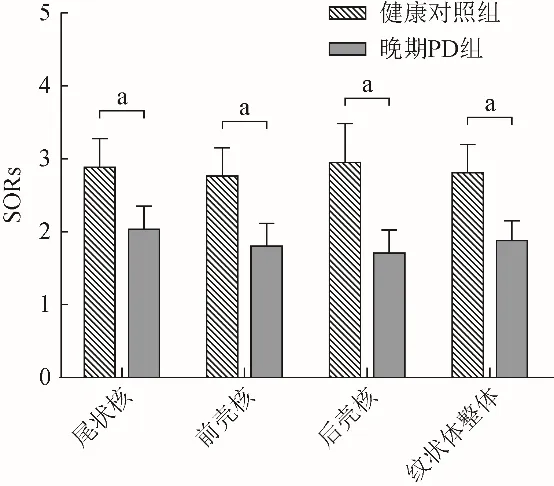
图2 健康对照组与晚期PD组纹状体各亚区SORs值比较。aP<0.001
2.2 早期PD组与健康对照组比较 早期PD组同侧和对侧尾状核、前壳核、后壳核、纹状体SORs分别为2.49±0.32、2.30±0.24、2.23±0.31、1.99±0.25、2.32±0.35、1.96±0.30、2.36±0.31、2.12±0.23,健康对照组尾状核、前壳核、后壳核、纹状体整体SORs分别为2.88±0.40、2.77±0.40、2.95±0.54、2.80±0.40。与健康对照组相比,早期PD患者尾状核、前壳核、后壳核、纹状体同侧和对侧SORs下降百分比分别为14%、20%,19%、28%,21%、34%,16%、24%,早期PD组各ROI同侧和对侧18F-FDOPA摄取均显著减少,且对侧损失更严重,其中对侧后壳核下降最严重(t=5.63~8.24,P<0.000 1)。
2.3 各组SORs和SAI比较 健康对照组的双侧尾状核、前壳核和后壳核等脑内区域的摄取均匀对称;早期PD组纹状体区摄取不均匀减少,对侧壳核减少明显;晚期PD组纹状体区摄取明显减少,以壳核尤为明显(图3)。早期PD组与健康对照组纹状体各亚区(除尾状核外)SAI差异有统计学意义(P均<0.05);晚期PD组与健康对照组各纹状体亚区SAI差异无统计学意义(P均>0.05),见表1。
表1 健康对照组、早期、晚期PD组的SAI比较(%,±s)
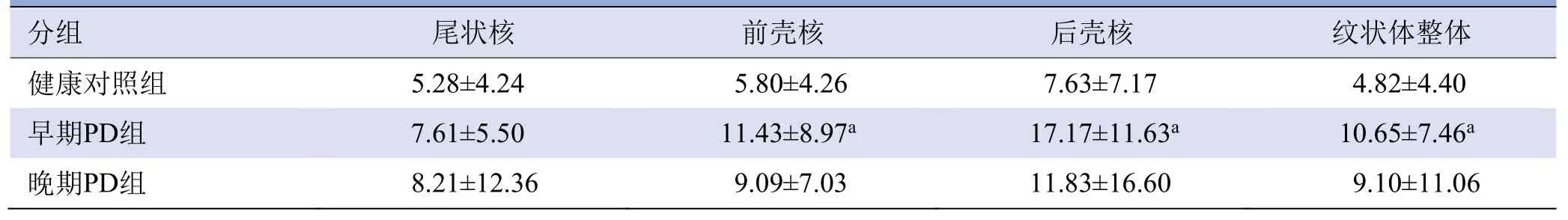
表1 健康对照组、早期、晚期PD组的SAI比较(%,±s)
注:PD:帕金森病;SAI:不对称指数;a与健康对照组比较,P<0.05
分组尾状核前壳核后壳核纹状体整体健康对照组 5.28±4.24 5.80±4.26 7.63±7.17 4.82±4.40 10.65±7.46a晚期PD组 8.21±12.36 9.09±7.03 11.83±16.60 9.10±11.06早期PD组7.61±5.50 11.43±8.97a 17.17±11.63a
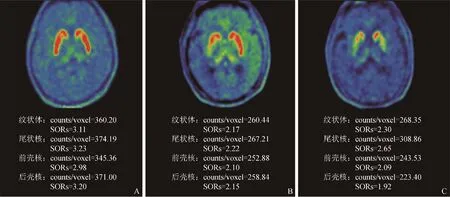
图3 健康对照组(A)和早期(B)、晚期(C)PD组18F-FDOPA PET图像
2.4 PD组与健康对照组的主成分分析 PD组和健康对照组在主成分空间中有明显分离,说明数据在主成分空间中样本的相似性较高,具有良好的聚类效果,组间有较好的区分度。两组数据纹状体各亚区的SORs值差异有统计学意义,见图4。
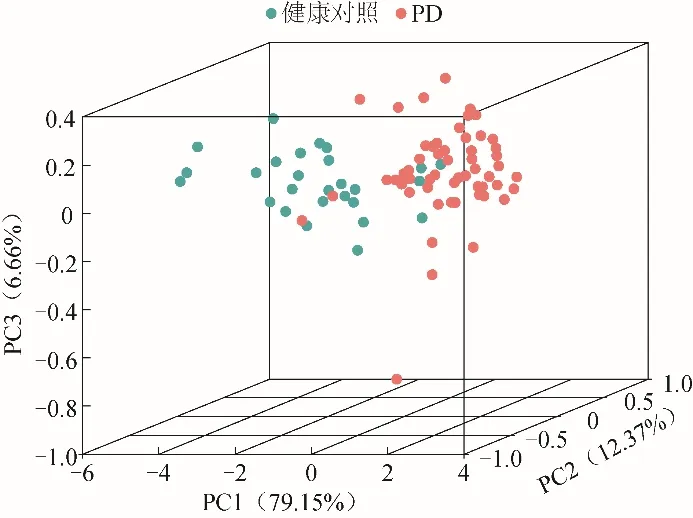
图4 PD组与健康对照组的主成分分析
3 讨论
近年PD诊疗发生了重大变化,寻找PD分子靶标和发病机制逐渐成为研究热点。PD诊断正从症状和体征的描述性诊断向基于分子标志和分子影像探索病因和发病机制的诊疗一体化转变。阿尔法突触核蛋白沉积和多巴胺神经元丢失是原发性PD的早期分子标志[4,20]。18F-FDOPA PET/CT是一种较灵敏、特异性较高的检查方法[21-22],从神经递质即突触前水平反映多巴胺神经元的受损水平,对PD诊断和疾病进展监测有很大帮助,有望实现PD早期诊断[7,23]。核医学医师凭借诊断经验和视觉分析辨别PET图像微小的变化存在困难,结果判断缺乏客观指标,容易产生观察者间的误差,标准化的图像半定量分析更有意义。近年来,越来越多研究聚焦于图像定量分析,探究生物标志物在早期诊断中的价值[24-25]。本研究通过PET定量及人工智能技术,分析早期PD组18F-FDOPA在纹状体各亚区的摄取情况,以SORs值为半定量指标分析纹状体各亚区多巴胺能神经元的损失情况,以期提高早期PD的诊断准确性。
PD患者纹状体多巴胺丢失不均匀,多巴胺能神经元变性首先发生在后壳核,随着疾病进展,逐渐发展至前壳核和尾状核[26]。本研究通过SORs值对PD患者和健康对照的突触前多巴胺能的功能进行评价,结果显示PD患者纹状体各亚区18F-FDOPA摄取均显著降低,其中后壳核损失最为明显。
早期PD患者伴有单侧运动症状,也是大多数PD患者的初诊症状。早期确诊对于PD的治疗非常重要,既可避免很多非必要的检查,患者也能够及时接受治疗。本研究分析早期PD组纹状体各亚区对侧和同侧SORs值与健康对照组各ROI双侧SORs的差异,发现早期PD组各对侧ROI的18F-FDOPA摄取显著降低,其中对侧后壳核损失最严重(34%),与既往研究一致[27]。与对侧相比,同侧SORs值损失幅度较小,但仍存在显著差异,且后壳核同样为损失最严重的区域。对侧多巴胺能神经元重度变性的同时也伴随着同侧多巴胺能神经元的轻微变性。18F-FDOPA PET/CT甚至能在运动症状前探测双侧黑质-纹状体通路的多巴胺神经元受损。
与健康对照组相比,早期PD组纹状体各亚区SAI均存在显著差异,这与PD早期患者伴有单侧运动症状符合。此外,早期PD组中3例患者视觉分析PET图像未见对侧基底节区核团18F-FDOPA摄取减少,半定量分析发现其双侧纹状体的SAI均>10%。相对于视觉分析,半定量分析能更好地识别细微变化。人工智能任务中,数据的维度通常很高,会导致计算复杂度增加和模型过拟合。主成分分析发现,PD组和正常对照组在主成分空间中有明显分离,组间则有较好的区分度。两组数据纹状体各亚区SORs值存在较显著差异。
定量分析及人工智能分析平台能够提供直观的可视化效果,人机交互友好仅需较少的手动干预,约1 min即可完成1例研究对象的18F-FDOPA PET/CT图像半定量分析;同时,避免了传统ROI半定量分析方法中烦琐的ROI勾画,减少了统计参数图中数据格式转换、反转层序等操作,并能够直接给出半定量数值。但目前本研究的健康对照数据库仍较小,需要进一步扩大数据库,通过标准差准则确定纹状体各ROI的SORs正常值范围。本研究同样缺乏神经病理学诊断,即未对所有PD患者进行临床随访获取诊断“金标准”。目前基于同步18F-DOPA PET/MR在PD的诊断研究正在进行中,结合人工智能,有望更早地定量分析多巴胺神经元损害程度,帮助医师诊断前驱期PD并指导治疗。
总之,PD患者尾状核、前壳核、后壳核、纹状体18F-FDOPA摄取明显减少,后壳核SORs值能很好地鉴别PD患者和健康对照者。本研究进一步发现,早期PD患者纹状体各亚区不对称损失明显,ROI同侧和对侧18F-FDOPA摄取显著减少,以对侧后壳核最为明显。基于分区水平的半定量分析平台在鉴别PD患者和健康人群以及早期PD诊断中具有很好的应用价值。
