有机光响应一氧化碳供体分子设计及其在疾病治疗中的应用(特邀)
2024-04-15樊睿枭李刚锋崔汉楠宋健王腾蛟
樊睿枭,李刚锋,崔汉楠,宋健,王腾蛟
(西北工业大学 柔性电子研究院,西安 710072)
0 引言
内源性气体信使分子是指人体内源性产生的具有类气体物化属性的第二信使分子,包括一氧化氮(Nitric Oxide,NO)[1]、一氧化碳(Carbon Monoxide,CO)[2]和硫化氢(Hydrogen Sulfide,H2S)[3]等,这些气体信使分子在生物体内发挥着重要的生理和病理调节作用[4],其潜在治疗能力引起了国内外研究者的广泛关注。CO 是一种无色、无味的气体,通常由一些含碳化合物的不完全燃烧产生。过去,CO 被认为是一种有毒气体,过量吸入CO 会导致CO 与血红蛋白结合形成碳氧血红蛋白(COHb)[5],使氧气无法与血红蛋白正常结合,从而阻碍了氧气运输到组织和器官,导致组织和器官缺氧,最终可能导致呼吸困难甚至死亡。虽然在高浓度下CO 气体对人体有危害,但在适当浓度下,CO 气体信使分子也能在细胞行为调控以及疾病治疗中发挥重要作用。据报道,CO 相关气体疗法已经在心血管舒张、抗炎、抗癌和抑制细胞凋亡等[6-7]领域取得一定进展,如图1 所示。

图1 CO 气体信使及其生理调节作用Fig. 1 The regulatory effect of CO on organisms
由于CO 气体分子具有生理半衰期短、传输距离有限以及生理浓度难以控制等缺点,无法达到理想的治疗效果,因此,为了实现对CO 更精确地调控并更高效利用其治疗作用,近年来人们设计合成了一系列可释放一氧化碳的供体分子(Carbon Monoxide Releasing Molecules,CORMs)[8]。与直接使用CO 气体吸入给药相比,CORMs 具有较好的稳定性,可以避免CO 浓度过高产生的生物安全性危害。此外,CORMs 分子结构能够通过化学修饰和药物载体系统实现靶向递送,从而实现多功能和多目的治疗[9]。
目前的研究中,CORMs 释放CO 行为动力学通常因其具体结构而异。传统CORMs 以金属羰基化合物为主,它包含一个中心金属离子和一个或多个配体。其配体通常是CO,通过配位键与金属离子形成配位化合物,而中心金属离子通常是过渡金属,如铁(Fe)[10]、锰(Mn)[11]、钌(Ru)[12]等,配体除了CO 本身,也可以是其他有机分子,如吡啶[13]、吡咯硼(BODIPY)[14]等。其中,五羰基合铁(Fe(CO)5)是常用的CORMs 之一,其中铁离子与五个CO 配体形成配位化合物,其CO 释放方式主要通过配体交换来实现。而其他基于配位键形成的CORMs 结构可以通过调节配体的选择和配位方式来实现对CO 释放行为的调控。此类CORMs 释放CO 行为还包括热解[15]、光解[16-18]、pH 响应[19]和氧化敏感解离[20]等方式,通过了解CORMs 的释放方式可以从多维度加深对它的理解,从而拓展其应用领域。过去已有相关的综述对传统CORM[21-22]和光响应一氧化碳供体分子(Photo-CORMs)[23]进行总结。作为此类综述的补充,本文主要侧重于近年来有机光响应一氧化碳供体分子(Organic Photo-CORMs)的相关研究,并对其具有的相关性质及应用进行简要分析,同时,对未来该领域的发展进行总结与展望。
1 Photo-CORMs 的分类
Photo-CORMs 是指在特定波长的激光照射下释放CO 的一类CORMs,由于其高效、安全、可控性等优点,这种光响应性CO 释放机制使得Photo-CORMs 在生物医学等领域具有巨大的应用潜力。在设计和选择Photo-CORMs 时,需要考虑结构与性质之间的关系,并根据具体应用需求进行合理设计和优化,如图2 为几种典型的金属羰基Photo-CORMs。目前为止,已经记录了两种类型的Photo-CORMs,包括金属羰基和有机小分子。例如,一种钌(II)的单羰基和二羰基络合物[24],其结构为[Ru(Cl)(CO)(qmtpm)(PPh3)]BF4和[Ru(Cl)(CO)2(qmtpm)]ClO,其中Ru 中心与羰基形成的配合物与三齿配体2-喹啉-N-(2'-甲硫基苯基)亚甲基亚胺(qmtpm)以经向方式结合,其在300~450 nm 范围内的低功率(3~15 mW)光照射下会迅速释放CO,在360 nm 波长光的照射下,[Ru(Cl)(CO)2(qmtpm)]ClO 的乙腈溶液也能迅速释放CO。另外,还有一种名为MnBrCORM 的金属羰基类Photo-CORMs 的结构分别为Fac-[MnBr(CO)3(NIF)]和Fac-[MnBr(CO)3(NTZ)2][25]。当这些MnBrCORM 受到525 nm 绿光照射时,配合物分子发生光解反应进而导致CO 释放。尽管金属中心Photo-CORMs 具有许多优点,但其最大的限制在于在生理条件下配体的快速交换而导致CO 的过早释放,进而无法达到理想的治疗效果。同时,传统金属中心Photo-CORMs 在应用中也存在一些缺陷,如高成本、稳定性差、选择性差和内在毒性等。
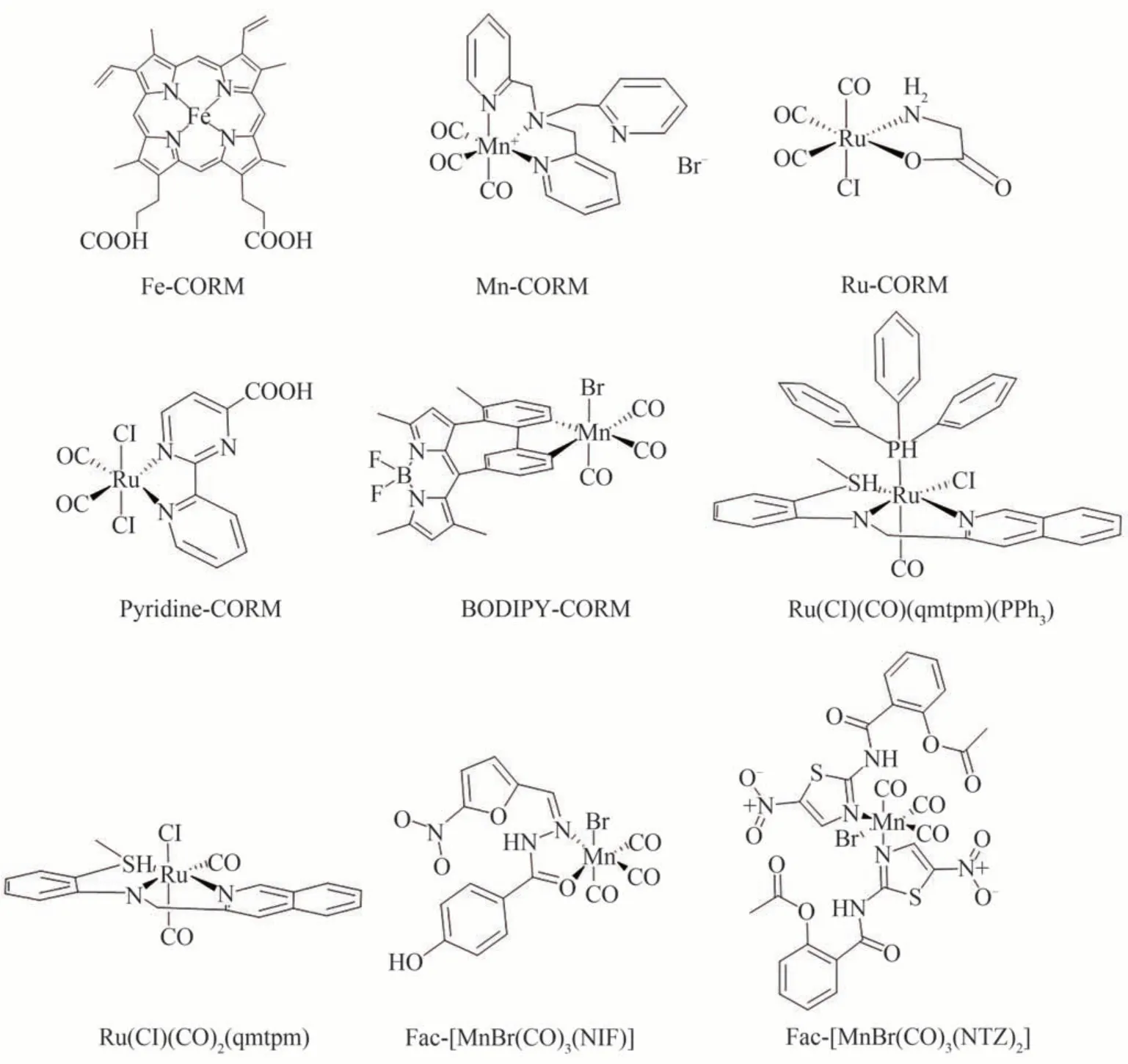
图2 几种典型的金属基CORMs 的结构Fig. 2 Several typical structures of metal based CORMs
无金属有机Photo-CORMs,如环芳α-二酮类(Cyclic Aromatic ɑ-Diketones)[26]、荧光素类(Fluorescein Analogs)[27]、黄酮醇类(Flavonols)[28]和3-羟基苯并[g]喹诺酮类(3-Hydroxybenzo-[g]quinolones)[29](图3)等,引起了人们的研究兴趣。这些有机Photo-CORMs可以有效地避免金属中心Photo-CORMs的上述缺点,可以被从紫外到近红外的光激活来实现CO 的释放。且这些有机物通常具有较好的生物相容性,能够在生物体内发挥作用而不引起明显的毒副作用,这一特点对于将它们用于药物递送系统或其他生物医学应用非常重要。在结构设计和修饰上,这些有机物具有很高的灵活性。使得研究人员可以根据具体需求来设计和优化CO 释放供体的性能,以实现更好的生物应用效果。

图3 具有代表性的有机Photo-CORMs 及其它们的典型活化波长Fig. 3 Representative organic Photo-CORMs and their typical activation wavelengths
1.1 环芳α-二酮类
目前,国内外关于无金属有机Photo-CORMs 的研究,主要源自于1972 年CHAPMAN O L 等提出的一篇关于利用光化学转化合成σ-内酯的文章[30],通过将4,4-二正丁基-1,2-二氧基-3,5-二酮的纯净液体,在77 K 下同时配备真空罩和杜瓦瓶的红外线空间中,使用800 W 高压石英光学汞弧照射,导致起始物质迅速光解形成二氧化碳和σ-内酯,通过再次辐射σ-内酯就会产生CO 和相应的酮产物。
2013 年,王朝明等报道了一种包封在胶束中的不饱和环α-二酮(DKs)作为可见光波长激发的Photo-CORMs[26]。实验研究了DKs 在DMSO、乙腈和DCM 溶液中的光化学反应,其紫外可见光谱表明三种化合物均发生了预期的光反应。DK3 在DMSO 中的吸收光谱如图4 所示,n-π*跃迁的吸收在400~550 nm 之间,最大吸收光谱(λmax)在465 nm 处。用470 nm LED 阵列照射10 min 后,DK3 的吸收完全消失,紫外-可见光谱与DK3 释放CO 后的产物2,6-双(辛氧基)蒽相匹配,说明其在有机溶剂中定量发生了光响应释放CO 的反应。值得一提的是,与许多多环芳烃不同,蒽不会产生急性细胞毒性、致癌性及诱变性,有利于其在治疗方面的应用。

图4 在470 nm 处照射前后DK3 在DMSO 溶液中的吸收Fig. 4 Absorption of DK3 in DMSO solution before and after irradiation at 470 nm
1.2 黄酮醇类
黄酮醇是一种存在于许多水果和蔬菜中的天然化合物。其中,槲皮素作为人类饮食中一种丰富的黄酮醇,因其强大的抗炎、抗氧化和抗癌特性而被广泛研究。据报道,槲皮素的核心骨架3-羟基黄酮在紫外线照射条件下会以光化学方式释放CO,因此黄酮醇类化合物可以看作一类优良的Photo-CORMs。
2017 年LAZARUS L S 等[31]报道了一种化学/光子双驱动逻辑门Photo-CORMs(SL-PhotoCORM)。他们通过在3-OH 位置引入丙烯酰氯来官能化扩展的黄酮醇。这种扩展的黄酮醇类Photo-CORMs 通过AND 逻辑门操作,首先通过检测硫醇来感测细胞环境,然后在可见光和O2触发下释放CO,进而实现治疗效果。实验分别在20%和1%的O2浓度下测试了结构1(如图5 所示)的可见光诱导反应性,在20%浓度的O2环境中用波长419 nm 的光照射结构1(0.1 mmol/L)的DMSO∶H2O(1∶1,V∶V)溶液,结果表明在不到600 s时间内超过90%的结构1 转化为结构2。而在1% 浓度的O2环境中,其在1 400 s 内只有约45%完成了反应。SL-PhotoCORM 作为一个AND 逻辑门CO 递送分子,其中的一系列触发步骤能最大限度地减少误报,且基于黄酮醇的SL-photoCORM 的荧光特性通过两个光致变色开关(蓝色到绿色和绿色到无色)产生一系列化学光子输入响应,从而实现CO 释放的可跟踪性和时空控制。这种荧光反馈变化的Photo-CORMs 可以跟踪细胞内CO 释放的每个步骤,为更加精确的CO 释放提供了一种全新的思路。
花菁素染料(Cy7)在约750 nm 的光治疗窗口表现出强烈的吸收特性,在生物医学领域,如光动力疗法、光学成像、分子探针等领域,该染料被广泛应用。2020 年ŠTACKOVÁ L 等[32]将黄酮醇与近红外吸收的花菁素染料偶联获得了2 种新型Photo-CORMs,如图6 所示。这种花菁素-黄酮醇偶联Photo-CORMs 在甲醇中的紫外/可见吸收光谱显示出典型的七甲基花菁素染料的强吸收带,λmax分别为791 nm 和793 nm,且该化合物在λem=815 nm 和819 nm 处也有发光,其强度与吲哚菁绿(ICG)相当。实验发现,母体花菁素辐照16 h后不产生CO(<2%)。基于此评估了两种Photo-CORMs 在近红外光(820 nm)下的光解情况,结果表明它们分别以(125±15)%和(131±6)%的化学产率生成了CO。进一步研究结果证明这类花菁素-黄酮醇杂化合物可以从两个黄酮醇部分释放两分子CO,在甲醇和PBS 中,每个黄酮醇单位释放CO 的产率分别约为65% 和55%。且5b 的PBS(pH 7.4,10 mmol/L,I= 100 mmol/L)溶液在770 nm 和820 nm 波长光的激发下,产生的CO 化学产率分别为(102±9)%和(110±6)%,而在黑暗中保存的样品只释放了微量的CO(<2%),这一现象解释了CO 释放的光响应性机制。
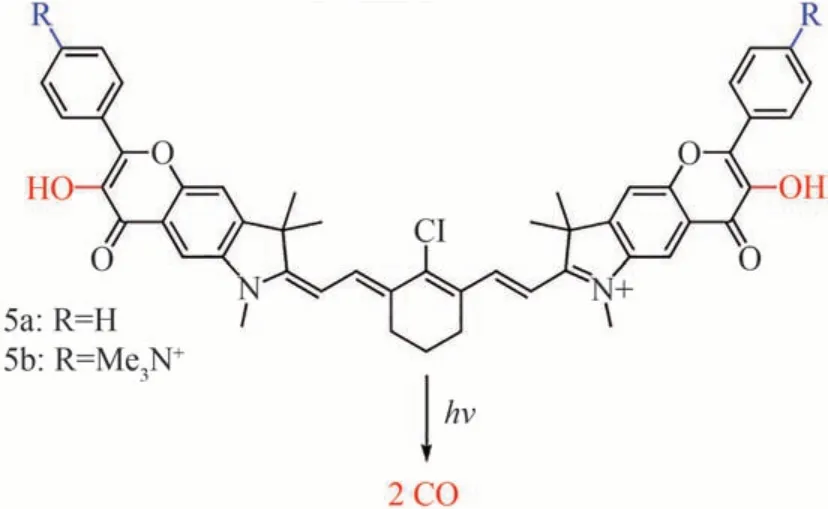
图6 两种花菁-黄酮醇Photo-CORMs 光响应释放CO 的情况Fig. 6 Photochemical release of CO from two cyanine-flavonol Photo-CORMs
2022 年孙英姬等[33]研制了首个以B 环-萘取代黄酮醇类半胱氨酸(Cys)比例荧光探针2-(萘-2-基)-4-氧代-4H-香豆素-3-基丙烯酸酯(2-(naphthalen-2-yl)-4-oxo-4H-chromen-3-yl acrylate,NCA)。该探针作为Photo-CORMs 前体,可经由Cys 传感反应驱动并定量生成3-羟基-2-(萘-2-基)-4H-香豆素-4-酮(3-hydroxy-2-(naphthalen-2-yl)-4H-chromen-4-one,HNC)荧光分子作为Photo-CORMs。通过控制光照强度、持续时间或Photo-CORMs 的用量,HNC 可以在富氧环境下提供精确和定量控制的CO 线性释放,同时利用HNC 自身的荧光特性还可以实时定位CO 释放位点。实验中,NCA、HNC 及其CO 释放产物均具有良好的生物相容性,且NCA 可以在活HeLa 细胞中实现外源和内源Cys 的快速检测和成像。
1.3 BODIPY 类
BODIPY 分子支架因其良好的荧光性能、较高的化学稳定性、较好的生物相容性且允许通过简单的结构修饰对BODIPY 发色团(COR-BDPs)的物理化学性质(如光学性质或水溶性)进行微调,从而实现一个更长波长响应机制,使其有望通过修饰成为一类新型的有机Photo-CORMs。
Eduardo Palao 等[34]研究了基于COR-BDPs 的新一代有机Photo-CORMs 的直接合成方法,这些Photo-CORMs 可在可见光至近红外光(高达730 nm)范围内激活。近红外波长能更好地穿透生物组织,进而实现深层次、完全可控地CO 释放,并在体外和体内实验环境中展示它们的优异性能,如图7 所示。2023 年SINGH P K[35]等设计并合成了两个间位取代BODIPY 的Photo-CORMs,这些BODIPY 衍生物通过苯氧基甲基吡啶片段和低聚乙二醇相连,以维持亲疏水平衡并改善细胞通透性。由于CO 在细胞中最容易被识别的靶标细胞器是线粒体,因此这些Photo-CORMs 可以通过近红外光照射选择性地将CO 递送到线粒体,并在细胞线粒体中积累。体外成像清楚地表明,低聚乙二醇亲水改性的BODIPY 基Photo-CORMs 更容易内化,表明亲水-亲脂平衡在有机纳米颗粒的细胞内化中起着至关重要的作用。细胞毒性实验表明,低聚乙二醇改性BODIPY 基Photo-CORMs 可以通过凋亡途径有效地杀死癌细胞,基于此,它也被认为是传统化疗实践中治疗癌症的一个新的有希望的选择。
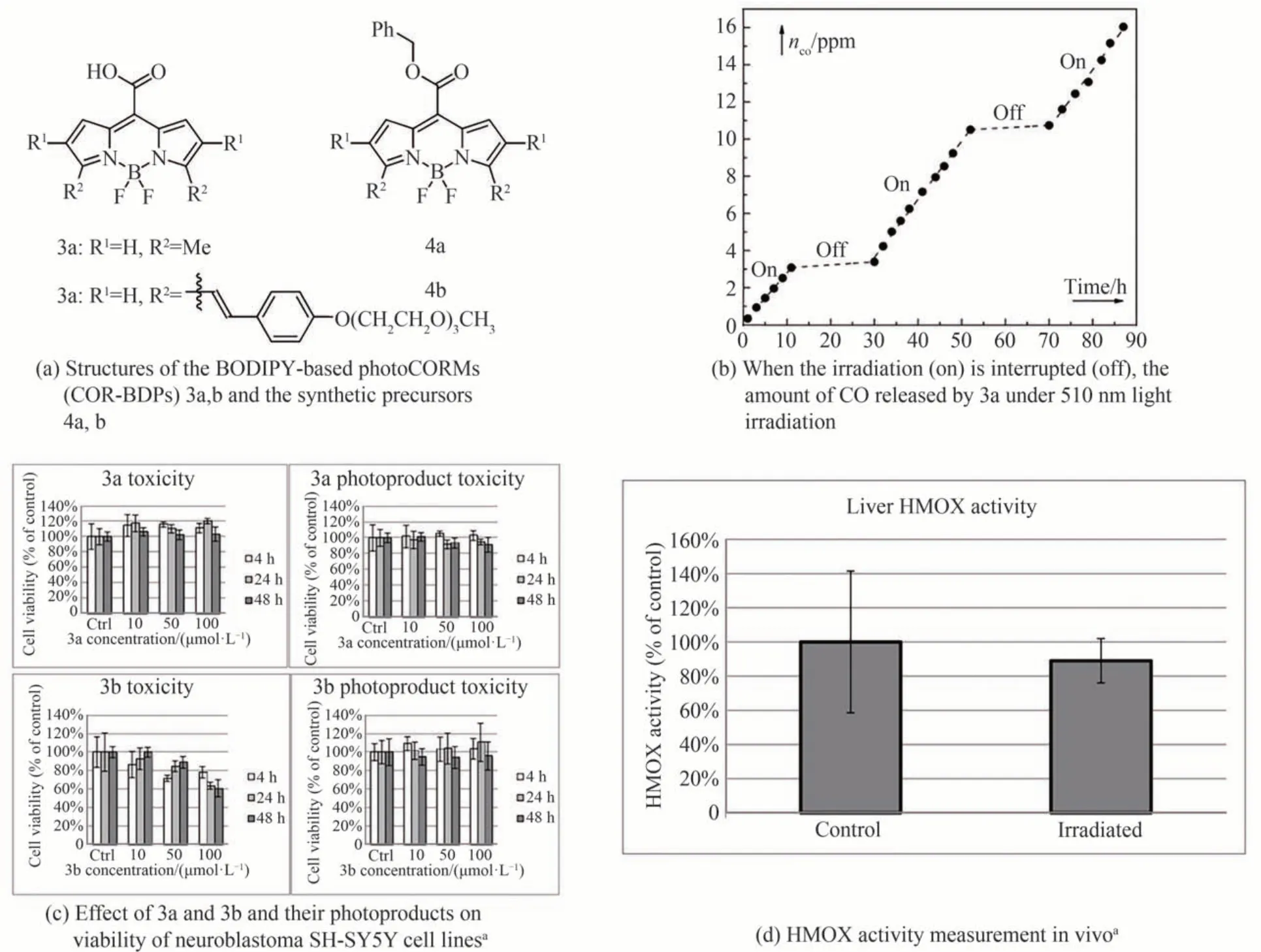
图7 COR-BDPs 的结构,CO 释放的光依赖性曲线及体内外实验Fig. 7 The structure of COR-BDPs, the light dependence curve of CO release, and in vitro and in vivo experiments
1.4 其他有机Photo-CORMs
除了上述介绍的几类有机Photo-CORMs,近年来基于荧光素类似物、喹诺酮等修饰的Photo-CORMs也取得了一定的研究进展。2013 年SLANINA T 等[27]研究发现6-羟基-3-氧-3H-杂蒽-9-羧酸(6-hydroxy-3-oxo-3H-xanthene-9-carboxylic acid)可以通过激光辐照来实现CO 的释放,且它是一个可见光激活的水溶性有机Photo-CORMs。这种水溶性荧光素类似物在500 nm 波长的光照射时可以释放CO。当在有血红蛋白(Hb)存在的生理条件下选择性照射时,释放的CO 被定量捕获形成COHb。反应进程可以通过反应物和产物的特征吸收和发射特性来精确监控。2018 年POPOVA M 等[36]基于3-羟基苯并[g]喹诺酮框架设计了Photo-CORMs,用可见光(419 nm 或465 nm)照射Photo-CORMs 的乙腈溶液,释放了0.90 当量的CO。实验中这种喹诺酮框架的无毒化合物可以在CO 释放之前使用荧光显微镜进行跟踪,并在完成CO 释放后产生同样无毒的副产物。在CO 释放的定位方面,前药在硫醇的存在下被还原为Photo-CORMs,而在癌细胞的还原环境中,细胞内硫醇的浓度更高,因此也为前药在癌细胞中的激活提供了一种方法。
2 Photo-CORMs 的光物理性质
截至目前已报道的Photo-CORMs 吸收峰通常位于300~500 nm 范围内[37-40],无论是金属羰基类还是有机Photo-CORMs 均在紫外和可见光区域有吸收。这是由于紫外光和可见光具有较高能量,可以更容易地激发Photo-CORMs 分子中的电子跃迁,从而引发光化学反应。如图8 所示,在光激发过程中,3d 表现出强荧光并从最低激发的单重态经历相对低效的系间窜越到三重态,与此同时发生了从羧酸盐到BODIPY 发色团的光致电子转移,导致形成氧烯丙基型三重态双自由基5。随后5 再次发生系间窜越从三重态变为基态,且在单重态基态势能面上形成ɑ-内酯6,最后化合物6 经历非光化学裂解释放出CO。

图8 BODIPY 基Photo-CORMs 光响应释放CO 的机理图Fig. 8 Mechanism diagram of BODIPY chromophore light conversion and release of CO
在光源的选择上,商用紫外灯和可见光LED 等常见光源均可实现在Photo-CORMs 激发波长范围内提供光源来引发CO 的释放。然而,近年来也有一些研究进一步探索了Photo-CORMs 在近红外光区域的响应释放行为[18,34,35,41,42]。由于近红外光具有较长的波长和较低的能量,可以穿透较厚的材料和生物组织,且辐射危害相对较低的优势,在生物医学领域具有更大的潜在应用价值。此外,近红外光还可以与红外光谱分析技术相结合,用于光学传感和成像等技术,准确将药物递送至需要治疗的部位。
Photo-CORMs 的光稳定性决定了它们在光照下的稳定性和持久性,因此在设计Photo-CORMs 时,必需考虑其光稳定性是否良好,以确保它们可以在光照条件下稳定存储CO 并实现可控释放。由于不同类型Photo-CORMs 结构差异,其光稳定性也受到人们的关注。近年来,从光解离动力学角度,人们研究了不同光激发下Photo-CORMs 释放CO 时的一些参数,表1 是部分Photo-CORMs 的光谱性质、量子产率等关键数据。

表1 Photo-CORMs 的光谱性质和量子产率Table 1 Spectral properties and quantum yields of some Photo-CORMs
鉴于气体信使浓度与时空间效应在分子生物学研究中处于重要地位,研究者们在开发Photo-CORMs的同时关注Photo-CORMs 作为荧光分子在细胞成像中的应用研究[26,44,55]。研究发现,成像功能Photo-CORMs 分子通常具有共轭结构,使得它们能够吸收光子并在激发态上产生电子激发,当这些电子返回基态时,会发出荧光信号,发光的波长通常在可见光区域。此外,一些Photo-CORM 甚至还具有磷光发光性质。与荧光不同,磷光发光是通过三重态激发态的电子返回基态而产生的。这种长寿命的磷光信号可以与周围环境的短寿命信号区分开来,在生物成像和传感器应用中具有重要意义。
2012 年,AGUSTIN E 等设计并合成了一种水溶性铼(I)络合物fac-[Re(bpy)(CO)3(thp)]+(1)[CF3SO3-盐;bpy=2,2'-联吡啶,thp=三(羟甲基)膦](如图9 所示),在405 nm 光的照射下释放CO[44]。该分子在室温水溶液中也具有强发光性,发射带中心位于515 nm 处,该谱带归属于来自三重MLCT 激发态的磷光,更值得注意的是光产物2 在水溶液中也具有强烈的发光性,发射最大值λmax红移至585 nm。同时为了测试其荧光成像性能,将PPC-1 细胞与50 μmol/L 的1 在37 ℃下在黑暗中孵育60 min,结果显示蓝色荧光的1积累在细胞质中,但没有穿透PPC-1 细胞的核膜,在405 nm 光的照射下,15 min 后收集到2 的绿色荧光图像,证明了1 到2 的转化。
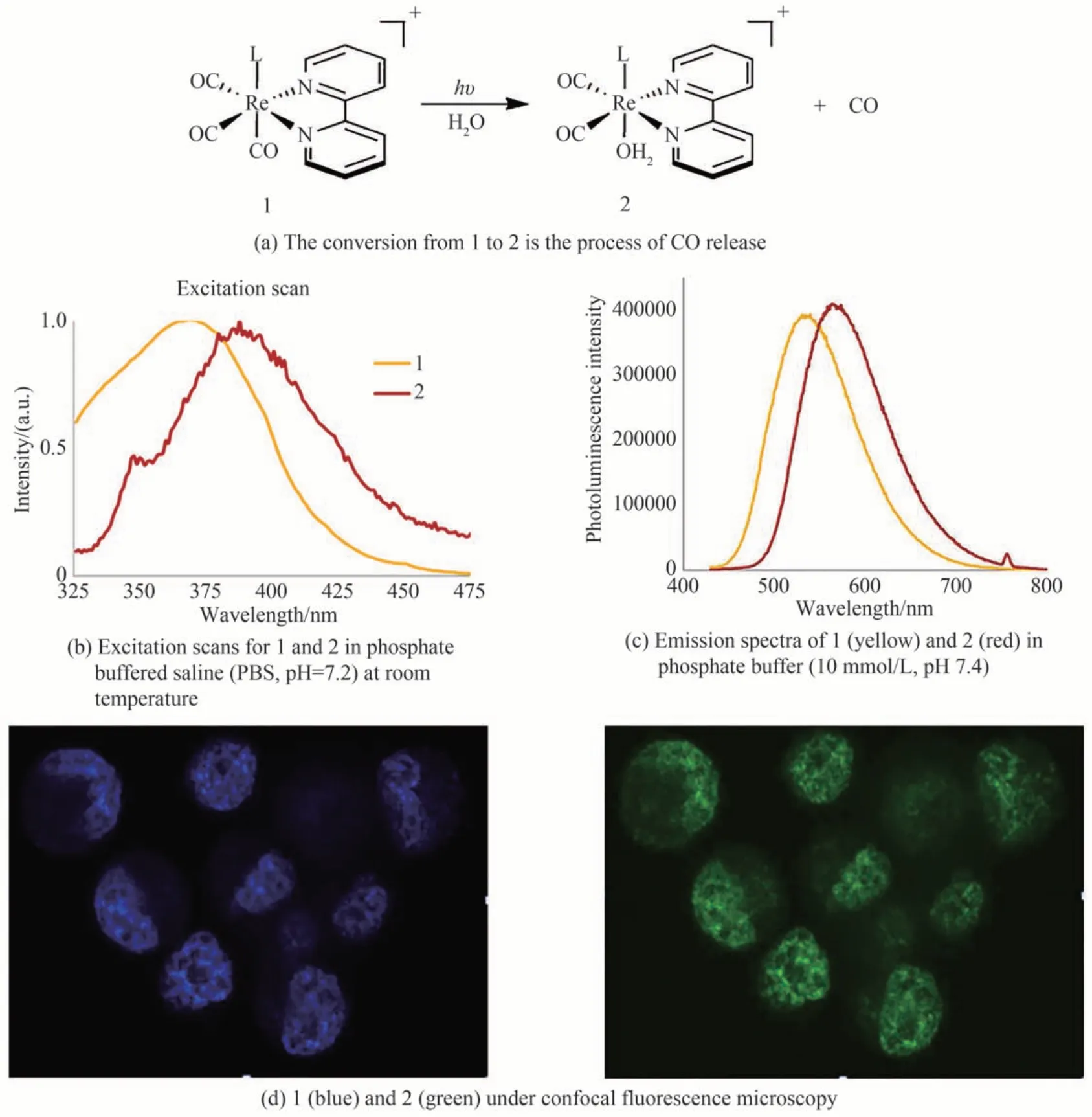
图9 CO 释放过程,激发和发射光谱及细胞内荧光成像Fig. 9 CO release process, excitation and emission spectra, and intracellular fluorescence imaging
综上所述,研究Photo-CORMs 的光物理性质对于理解和优化这些分子的光响应CO 释放行为和应用具有重要的意义。加强对Photo-CORMs 发光性质的研究为其在分子探针、成像和生物传感器等应用中提供了重要的思路,在未来也可以实现对CO 释放行为的更加精确地控制和监测。
3 Photo-CORMs 的给药方式及治疗作用
Photo-CORMs 可以通过直接原位注射方式给药,也可以制备成纳米材料或大分子药物经过注射或口服的方式给药,再通过激光处理实现CO 的光控释放。纳米材料及大分子给药手段可以有效延长Photo-CORMs 在体循环时间以及释放时效,进而降低其潜在毒副作用。根据Photo-CORMs 供体分子结构特征,其给药方式及治疗效果也是不同的。
金属中心的Photo-CORMs 通常需要通过静脉注射等方式进行给药,以确保化合物能够有效地进入生物体内并分布到目标组织。这种给药方式可以提供较高的药物浓度,从而实现更快速和有效的治疗效果。金属中心的Photo-CORMs 在治疗肿瘤、炎症和心血管疾病等方面表现出良好的疗效,特别是在光动力疗法中的应用效果显著。相比之下,无金属有机Photo-CORMs 由于其较好的生物相容性和稳定性,可以通过口服或皮下注射等更为便捷的给药方式进行治疗。这种给药方式更适合长期治疗或自我管理的情况,同时也减少了患者的不适感。无金属有机Photo-CORMs 在治疗炎症、神经退行性疾病和缺氧症等方面也显示出潜在的治疗效果,尤其是在神经系统疾病的治疗中具有一定的优势。
2021 年,蔡开勇教授团队设计了一种近红外光(NIR)-可活化脱氧核糖核酸酶(DNase)-一氧化碳(CO)@介孔聚多巴胺复合纳米材料(DNase-CO@MPDA NPs)[18]用于消除耐甲氧西林金黄色葡萄球菌(MRSA)生物膜。在近红外照射下,DNase-CO@MPDA NPs 显示出良好的光热能力,并进一步触发按需传递杀菌CO 气体,从而充分渗透受损的生物膜。研究结果表明通过注射这样一个纳米颗粒来实现给药,在体内实现了MRSA 生物膜的有效消除,根据体外抗炎实验发现NIR 辐照的CO@MPDA 和DNase-CO@MPDA NPs 具有高水平的抗炎因子和低水平的促炎因子,表明CO 释放纳米颗粒具有潜在的抗炎效果。由于这些有利的特性,NIR 照射后的DNase-CO@MPDA NP 也可以用于促进组织再生及伤口愈合。
2023 年,董晓臣教授团队通过在黄酮醇的3-羟基位置上引入生物硫醇响应丙烯基,并利用聚磷脂酰丝氨酸聚乙二醇(PS-mPEG)大分子对其进行包覆,提高了Photo-CORMs 的在体循环稳定性,构建了生物矿化光敏生态释放纳米材料(Ca-Flav NPs),通过静电相互作用将其生物矿化[56]。研究中通过注射实现了靶向给药,在氙灯照射下,Ca-Flav NPs 能有效释放CO 气体分子,CO 可以靶向输送到线粒体呼吸链上的细胞色素C,增加电子漏,最终诱导细胞内氧化应激,并通过Ca3(PO4)2酸解产生Ca2+破坏细胞内钙稳态,联合触发内质网应激,导致细胞凋亡,在体外实验中表现出优良的抗肿瘤作用。红细胞融血实验表明Ca-Flav NPs 具有良好的血液相容性。基于Ca-Flav NPs 优异的体外抗肿瘤性能及其高生物相容性,选择小鼠乳腺癌细胞(4T1 细胞)构建肿瘤小鼠模型,体内实验表明FlavAc NPs+氙灯和Ca Flav NPs+氙气灯处理对肿瘤表现出显著的抑制作用,表明黄酮类化合物具有内在的抗肿瘤特性。同时,在不同的组中没有观察到明显的体重波动,主要器官的病理组织学图像显示出清晰的细胞间边界和细胞核,表明治疗的副作用可以忽略不计。
上述物理包覆法制备的纳米CO 释放材料在体内循环的稳定性仍有待进行深入研究。2021 年,胡进明教授团队利用可逆加成-断裂链转移(RAFT)聚合以及将3-羟基黄酮衍生物和四苯基卟啉(TPP)片段共轭偶联的方式制备了TPP-HF、TPP-CHF 聚合物胶束用于大分子Photo-CORMs,实现了一个更加稳定精确的光控CO 释放手段。该研究通过3-羟基黄酮衍生物的光氧化机制开发了非金属CO 释放胶束,使CO 在红光(650 nm)照射下释放[57]。与非特异性内化到革兰氏阳性和革兰氏阴性细菌中的金属羰基不同,非金属胶束对金黄色葡萄球菌而不是大肠杆菌细胞,发挥选择性杀菌作用,证明了CO 的抗菌效果。研究中还发现金黄色葡萄球菌和大肠杆菌细胞在饱和CO 溶液中(约1 mmol/L) (远高于释放CO 含量),无论是否用650 nm光照射30 min,都不会诱导细菌死亡。相互矛盾的结果表明,与直接给药相比,局部给药CO 产生了不同的抗菌效果。此外,体外抗菌实验表明,TPP-HF 胶束(0.1 gL-1)在照射30min 后,可清除约97%的MRSA细胞。CO 释放胶束可以有效地根除耐甲氧西林金黄色葡萄球菌(MRSA)细菌。此外,体外划痕实验进一步表明在全层皮肤伤口模型中, 在光激发后,注射TPP-HF 胶束加速了MRSA 感染伤口愈合(如图10所示)。
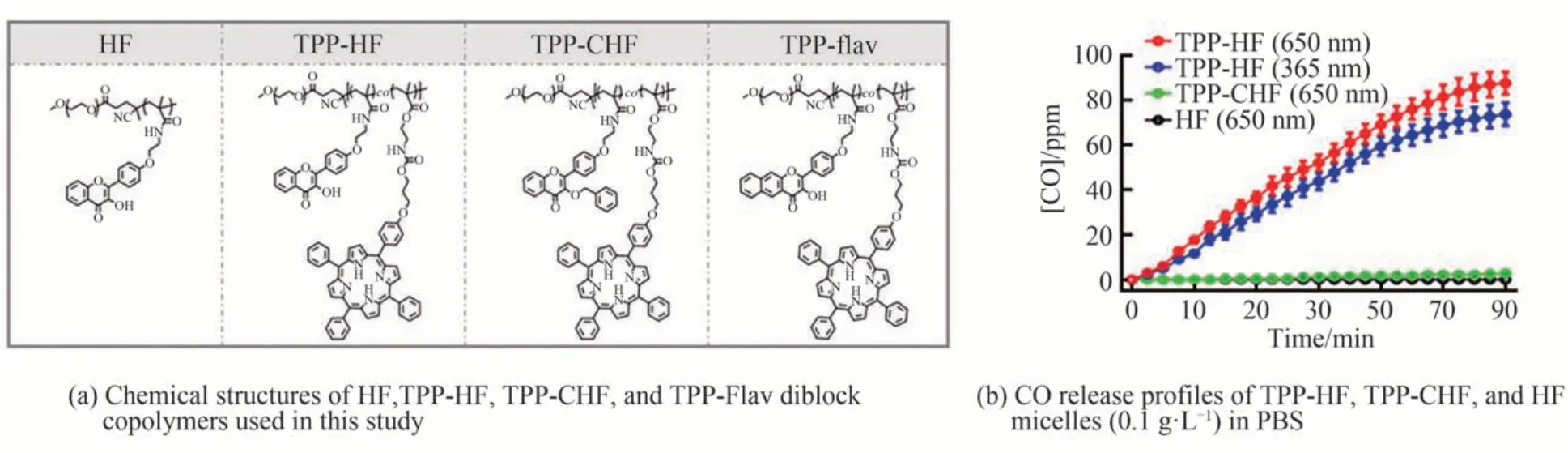
图10 研究中使用的结构及其光响应CO 释放能力曲线,细胞和伤口实验Fig. 10 The structures used in the study and their photoresponse CO release ability curves, as well as cell and wound experiments
除此之外由于CO 还具有抗炎、抗氧化等功能,通过合理设计,未来Photo-CORMs 能更好更精确地实现对炎症的调控及对氧化应激进行有效治疗。
4 总结与展望
目前,有机Photo-CORMs 的研究主要集中在分子的设计与合成、光物理性质研究以及给药及治疗作用的研究等领域。在有机Photo-CORMs 的合成方面,研究人员通过有机合成的化学手段设计和合成了多种具有光致CO 释放能力的分子,这不仅有助于研究构效关系,还可以优化CO 气体疗法在不同临床疾病中的应用。光物理性质研究方面,作为Photo-CORMs 应具有良好的光稳定性和光响应性能。通过调节其结构和光激发条件,可以实现在不同波段的光响应性能的调控。同时已有许多研究人员对光激发CO 释放的机制进行了深入研究,通过系统实验和理论计算,揭示了光激发过程中的关键步骤,包括电子转移、能量传递和化学反应等。例如,研究人员通过深入研究光激发过程中的电子转移机制,可以揭示光是如何激发有机Photo-CORMs 中的分子结构,从而促使释放CO 的过程。同时,对能量传递和化学反应的研究可以帮助研究人员优化有机Photo-CORMs 的结构和性能,提高其释放CO 的效率和速度。这些研究为进一步优化和设计有机Photo-CORMs 提供了一定的理论基础。在给药方式及其治疗作用的研究方面,有机Photo-CORMs 相较与金属羰基类Photo-CORMs 更具安全性和有效性,使得其在生物医学领域具有更广泛的应用潜力。且研究人员已经通过原位注射、口服给药以及纳米药物与大分子偶联等方式证明了Photo-CORMs 在肿瘤治疗、炎症调控、抗感染及氧化应激治疗等方面的应用价值,这些研究也将为开发新型的光治疗方法提供了新的思路。
随着有机Photo-CORMs研究的不断深入,相信未来有机Photo-CORMs 有望在以下几个方面得到拓展。
首先,目前对有机Photo-CORMs 激发光波长选择停留在可见光和近红外光范围内,这主要是因为近红外光具有较好的穿透性,可以穿透皮肤和组织,适用于医疗诊断和治疗等。然而,将有机光响应一氧化碳释放分子的响应波段拓展到X 光范围也具有一定的潜在优势和应用前景。X 光响应的Photo-CORMs 具有空间分辨率高、深度穿透性强、可控性好等潜在优势,为生物医学领域的治疗和疾病诊断带来了新的可能性。例如:通过X 光响应,Photo-CORMs 能够实现在深层组织中释放一氧化碳。且通过X 光成像引导,X 光响应CORMs 能够提供更精准的治疗定位,有助于减少药物对健康组织的损伤,提高治疗的精确性。此外在神经科学研究中,X 光响应的Photo-CORMs 能被设计成通过X 光刺激释放CO 用于神经元的刺激和调控。通过调节X 光照射的时间和强度,实现对神经元活动的精准控制,有助于研究神经系统的功能和疾病机制。这些优势将为未来精准医学领域带来更多创新和进步。
其次,柔性电子技术已经成为一种备受关注的新兴领域,它可以制造出柔软、弯曲和可拉伸的电子设备,有望在医疗、可穿戴电子产品、智能传感器等领域发挥重要作用。截至目前,研究人员已报道了基于光响应NO 释放材料的柔性电子治疗器件[58]。在该系统中,通过将自驱动、可穿戴、可伸缩的单电极模式摩擦纳米发电机(wsTENG)附着在人体(手指、手臂、腿等)上,以收集来自身体运动的能量用于电能供应。再将一种可植入的NO 释放装置(NO-LED)经颅植入脑中靠近肿瘤组织的位置。在NO-LED 器件中,蓝色LED 嵌入在具有并入的光响应NO 释放材料的中心。当wsTENG 通过无线控制点亮LED 时,设备可以持续释放NO 进行气体治疗。基于wsTENG 的供电系统具有结构灵活可变形、重量轻、佩戴舒适、稳定性好、可长期供电、与其他能源相比无需反复更换等优点。治疗过程可以由患者通过智能手机无线操纵,具有预先定制的治疗方案,用于控制NO 释放的时机、持续时间和剂量。基于此类先例,若有机Photo-CORMs 在未来被设计集成到柔性电子器件中,通过对其结构和材料的优化,可以实现在柔性基板上制备出柔性有机Photo-CORMs 器件,如柔性有机Photo-CORMs 微针阵列等,可以在受光照的情况下释放CO,从而促进伤口愈合或者抑制炎症和细菌生长。此外柔性有机Photo-CORMs 的出现将进一步实现对CO 释放的精确控制,从而在环境监测、医疗治疗等领域发挥重要作用。
总的来说,有机Photo-CORMs 作为一种极具潜力的化合物,具有十分广泛的应用前景。相信随着研究的不断深入,未来也将设计出响应波长更长,释放机制更加精准的Photo-CORMs,为将来的医学诊断、治疗和柔性电子研究领域带来新的突破和机遇。