人类婆罗双树样基因4作为口腔鳞状细胞癌肿瘤标记物的研究
2024-04-15焉妍于建新
文/焉妍,于建新
口腔鳞状细胞癌是口腔颌面外科最常见的恶性肿瘤,大约占整个口腔恶性肿瘤的80%[1]。目前的治疗方法,短期效果尚可,但是肿瘤细胞在缓解一段时间后仍会复发转移,患者的5 年生存率较低。一些学者认为,这种不良结果可能与口腔鳞癌的发病机理不清和肿瘤细胞的特殊性有关[2]。临床研究显示,肿瘤干细胞是肿瘤发生发展的关键因素。SALL4 是SALL4 家族中的一员,它可以调控肿瘤干细胞,异常表达可导致肝癌、急性慢性粒细胞白血病、胃肠道等肿瘤的发生,突变可导致Duane-Radial 射线综合征(DRSS)、Hoot-Oruam 综合征(HOS)等遗传性疾病[3]。那么SALL4 在口腔鳞癌中的表达是怎么样的,能否为口腔鳞癌的临床治疗提供指导,本文进行了研究和探讨。
1 数据和方法
在烟台山医院口腔科随机抽取2017 年9 月至2018 年6 月接受治疗的52 例口腔鳞癌患者为观察组,这52 例患者的肿瘤旁组织为对照组,经两名病理科医生诊断,在我院道德伦理委员会审核同意的情况下(批准号:烟山伦准2017015 号),参与实验的患者均只进行了手术治疗,未进行放化疗,从癌旁组织到病灶的距离大于5mm,且无肿瘤侵扰。其中男性24 例,女性28 例,年龄在52~66 岁之间,平均年龄(59.51±6.41)岁,肿瘤>5cm 者27 例,肿瘤≤5cm 者25 例,中/高分化者36 例,低分化者16 例,淋巴结转移者22 例,无转移者30 例;临床TNM I-II期37 例,III-IV 期15 例。两组标本经10%中性缓冲福尔马林固定,常规石蜡包埋。免疫组织化学方法检测SALL4 蛋白的表达。
免疫组化法操作步骤及判断标准:常规切4μm石蜡切片采用Roche 全自动免疫组化染色仪进行操作,采用免疫组化EnVision 方法检测抗体表达。以清洗液替代1 抗体作阴性对照,以已知的阳性组织作阳性对照。SALL4 蛋白定位于细胞核,弥漫性或≥70%细胞核呈黄色或棕褐色判定为阳性表达。统计分析数据处理采用SPSSv.23.0,计量资料分别用卡方检定和卡方检定,用Kaplan-Meier 方法进行生存分析,用对数据检验两组之间的差异。用Cox 比例风险回归模型评价预后因素的独立性。(P<0.05)表示差异有统计学意义。
2 结果
2.1 SALL4在癌旁组织和口腔鳞癌组织中的表达
SALL4 在口腔鳞癌组织中的阳性表达率为 63.46%,明显高于对照组的15.38%(P<0.05),见表1、图1。

表1 口腔鳞癌组织及癌旁组织中SALL4 的表达[n(%)]

图1 SALL4 在癌旁组织和口腔鳞癌组织中的病理学表达
A:SALL4 在口腔鳞癌组织中染色显示细胞核阴性表达 En Vision 法 中倍放大;
B:SALL4 在口腔鳞癌旁组织中染色显示细胞核阳性表达En Vision 法 中倍放大。
2.2 SALL4高阳性表达和口腔鳞状细胞癌患者临床病理参数之间的关系
SALL4 的表达水平与有无淋巴结转移和TNM 分期有关(P<0.05) 。SALL4 的表达水平与年龄、性别、肿瘤大小、组织分化无关 (P>0.05) 。见表2。
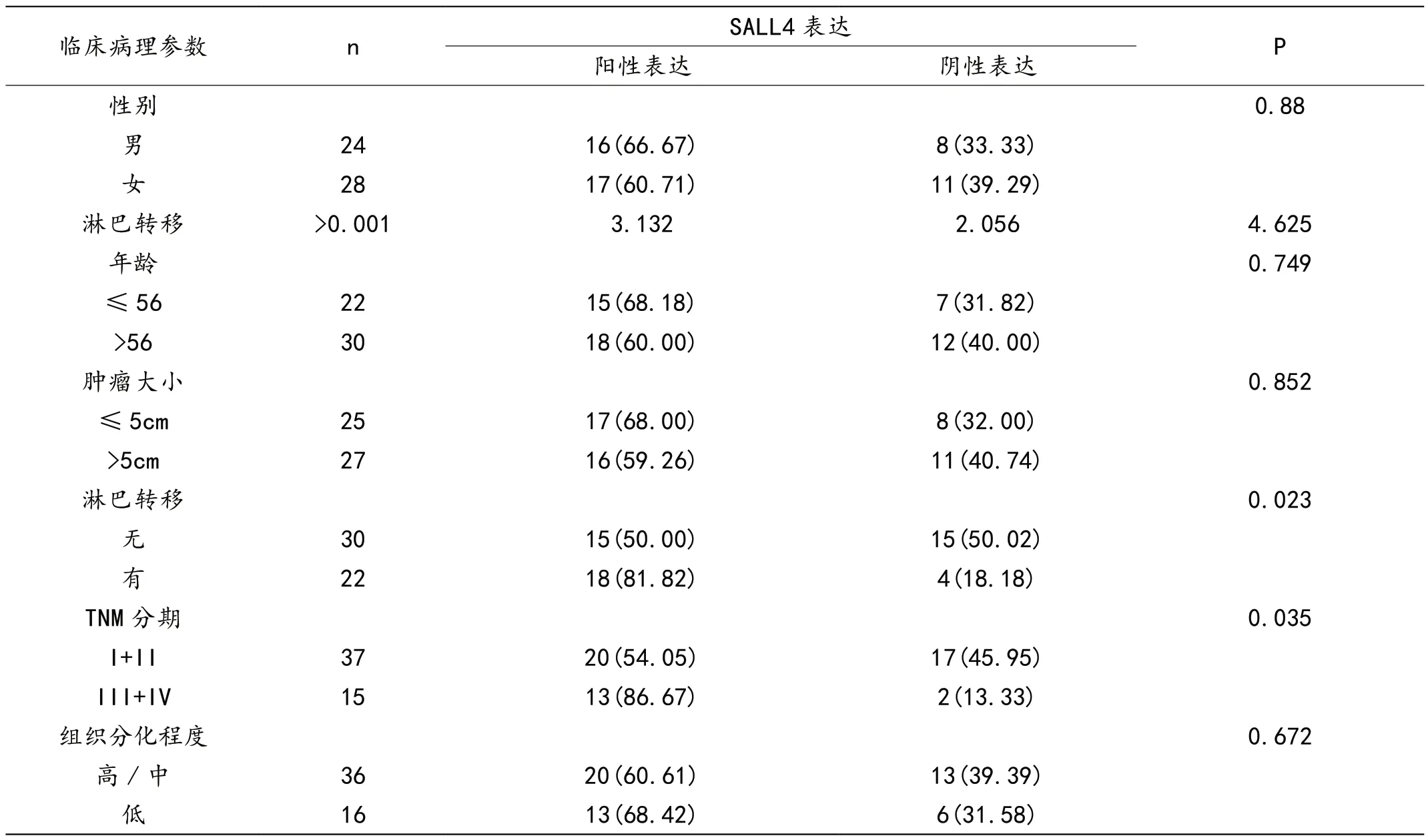
表2 SALL4 高表达与其病理学特征的关系[n(%)]
2.3 SALL4高阳性表达与口腔鳞状细胞癌患者生存时间的关系
回访的52 例患者中,随访截止日期2022 年3月,随访时间为4 年,20 例患者因口腔鳞状细胞癌复发去世(均为Ⅲ、Ⅳ患者),32 例存活,Kaplan-Meier 检验结果表明,实验组、对照组平均生存期为(26.31±1.37)个月(P<0.05),SALL4 高表达的实验组患者的平均生存期为(26.31±2.48)个月,明显低于对照组患者的(34.16±1.37)个月(P<0.05),表明SALL4 的高表达对患者的生存时间有明显的影响。如图2。

图2 SALL4 高阳性表达与口腔鳞状细胞癌患者生存时间的关系
2.4 影响口腔鳞癌患者预后的独立危险因素分析
淋巴结是否有转移、TNM 分期和SALL4 等危险因素是影响口腔鳞癌患者预后的因素。见表3。

表3 Cox 比例风险模型分析。
3 讨论
据有关资料显示,我国每年约有26 万例新增口腔鳞癌患者和约12 万例死亡患者。大多数患者有长年抽烟或饮酒的习惯,同时伴有口腔保健意识差,溃疡和营养不良等。当前精准的手术治疗、术后结合化疗仍是口腔鳞癌的治疗手段,但由于口腔鳞癌的自身特点使得其治疗效果不佳,因此在治疗上存在较大的缺陷[4]。目前学者们对各种恶性肿瘤的发病机制进行了研究,口腔鳞状细胞癌也在其中,研究发现肿瘤干细胞在细胞迁移、侵袭、血管生成、抗凋亡和免疫逃逸等过程中发挥着重要作用,SALL4 又可以调控肿瘤干细胞。加之近些年来,一些肿瘤干细胞的相关基因作为肿瘤标志物应用于临床治疗,就使得SALL4 作为口腔鳞癌标记物成为可能。
SALL4 是SALL 家族的成员,其表达的高峰是在胚胎期,随后表达逐渐减弱,成年后该基因在大多数组织器官中不表达[5],SALL4 的研究开始于肺部的恶性肿瘤,研究数据显示SALL4 因其特有的性质可以作为一种敏感而有效的肿瘤标志物[6]。 Ma 等[7]研究发现SALL4 在遗传病DRRS 综合征中显著表达,显示它是一个含有多个C2H2 锌指状结构的原癌基因。Farawela 也提出SALL4 可以作为一种良好的肿瘤标志物,它在各种肿瘤中的表达具有致癌作用[8]。还有研究表明SALL4 是一些途径(如Wnt 途径和BMP 途径)的关键媒介,SALL4 可通过这些途径调控肿瘤的发生发展[9]。Pan 等人[10]发现SALL4 可以区分生殖细胞肿瘤、转移性癌症和恶性黑色素瘤,可作为肿瘤诊断的标志物。Ommati 等人[11]也通过研究表明SALL4 是一种高度敏感有效的肿瘤标记物。Zheng 等人[12]发现SALL4 可能是肝癌预后的独立危险因素,但其与临床病理特征的关系不明显,SALL4 主要作用于细胞核中的某些基因,从而发挥作用。上述研究为SALL4 可以作为口腔鳞状细胞癌的标志物提供了理论基础。
本研究结果表明,SALL4 在切取的口腔鳞状细胞癌组织中,阳性表达率高达63.46%,明显高于对照组(P<0.05)。本研究还分析了SALL4 表达的临床病理特征,发现SALL4 的高表达水平与有无淋巴结转移和TNM 分期有关(P<0.05)。SALL4 的表达水平与肿瘤的大小、年龄、性别、组织分化程度等并不相关(P<0.05),结果提示SALL4 可能参与了肿瘤的转移过程。SALL4 阳性表达患者的平均生存时间明显短于SALL4 阴性表达患者(P<0.05),提示SALL4高表达患者预后欠佳。
4 结论
SALL4 在 口腔鳞癌组织中呈明显高表达,表明口腔鳞癌组织中可能存在肿瘤干细胞,SALL4 对肿瘤干细胞的调节与口腔鳞癌的发生发展密切相关,SALL4 有望成为口腔鳞癌的一个灵敏性、特异性良好的标志物,用于口腔鳞癌的临床病理诊断和鉴别诊断。
