杭白菊不同溶剂提取物中总酚和总黄酮的含量及抗氧化活性比较
2024-04-14周玉波马铭研曹雯严爱娟
周玉波 马铭研 曹雯 严爱娟


【摘 要】 分别采用水、70%乙醇、70%甲醇三种提取溶剂对杭白菊进行超声波提取,测定各种溶剂提取物中总酚和总黄酮的含量,比较提取物的体外抗氧化活性。结果发现,不同溶剂提取物中总酚和总黄酮含量存在显著性差异(P<0.05)。其中,70%乙醇作为提取溶剂提取的总酚和总黄酮含量最高,分别为6.66 mg GAE/g和15.64 mg RE/g,70%甲醇次之,而水作为溶剂提取效率是最低的。抗氧化活性结果表明,70%乙醇提取物的DPPH自由基清除能力、ABTS自由基清除能力和FRAP铁离子还原能力均为最高,分别为30.93 μmol TE/g、113.30 μmol TE/g和120.23 μmol TE/g,水提物的最低,三种提取物总酚和总黄酮的含量与ABTS自由基清除能力和FRAP铁离子还原能力之间存在显著正相关性(P<0.05)。杭白菊具有很高的营养价值和药用价值,本研究将为进一步开发利用杭白菊提供一定的理论基础和科学依据。
【关键词】 杭白菊;提取;总酚;总黃酮;抗氧化
【中图分类号】R285.5 【文献标志码】 A 【文章编号】1007-8517(2024)02-0018-06
DOI:10.3969/j.issn.1007-8517.2024.02.zgmzmjyyzz202402005
Content Compare of Total Phenols,Flavonoids and Its Antioxidant
Activities of Hangzhou White Chrysanthemum Extracts by Different Solvent
ZHOU Yubo MA Minyan CAO Wen YAN Aijuan
College of Pharmacy,Zhejiang Pharmaceutical College,Ningbo 315500,China
Abstract:The contents of total phenols and total flavonoids were determined in Hangzhou White chrysanthemum.Three different solvent were used in the extraction of Hangzhou white Chrysanthemum,namely ultrasonic assisted water extraction,ultrasonic assisted 70% ethanol extraction and ultrasonic assisted 70% methanol extraction.The contents of total phenols,total flavonoids in the extracts were determined,and their antioxidant activities of the extracts were also measured and compared.The results showed that the contents of total phenols,total flavonoids in different solvent extracts were significantly different(P<0.05),and the contents of total phenol and total flavonoids in the extracts when 70% ethanol was used as solvent were the highest,which were 6.66 mg GAE/g and 15.64 mg RE/g respectively,then 70% methanol followed,while water was the lowest.The results of antioxidant activity showed that the 70% ethanol extract of Chrysanthemum has the highest scavenging ability of DPPH free radical,ABTS free radical and FRAP,which were 30.93 μmol TE/g,113.30 μmol TE/g and 120.23 μmol TE/g respectively,while water extract has the lowest ability.There was a significant positive correlation between the contents of total phenols and total flavonoids of the three extracts and the free radical scavenging ability of ABTS and the iron ion reducing ability of FRAP (P<0.05).Chrysanthemum has high nutritional value and medicinal value,and the study here will provide certain theoretical basis and scientific basis for further development and utilization of chrysanthemum.
Keywords:Hangzhou White Chrysanthemum;Extraction;Total Phenol;Total Favonoid;Antioxidant Activity
杭白菊主产于浙江省桐乡市,是“浙八味”之一[1],属菊科植物菊(Chrysanthemum morifolium)的干燥头状花序,是2020年版《中国药典》收载的中药菊花中的一个重要品种[2],菊花的功效为散风清热、平肝明目,具有降血压、降血脂、抗菌、抗病毒、抗氧化、抗肿瘤、抗衰老等多种药理活性[3]。杭白菊的成分十分复杂,主要含有黄酮类、酚类、多糖类、挥发油类等多种生物活性物质,其中酚类、黄酮类是杭白菊中含量较多的有效物质,是发挥抗氧化功能的重要成分。
化学合成的抗氧化剂因其潜在毒性和致癌作用等安全性问题在使用上受到了越来越多的限制,而来源于植物的抗氧化剂具有取材广、高效、安全无毒等优点,已得到越来越多的应用[4],开发天然抗氧化剂代替化学合成抗氧化剂具有非常重要的意义。多酚是一类广泛存在于植物的天然抗氧化剂,植物多酚提取率主要受提取方法和溶剂的影响,可通过改变溶剂,提高多酚类的提取效率,甲醇、乙醇是极性较大的亲水性有机溶剂,常常与水混合进行提取,一定体积分数的醇由于易破坏多酚类与多糖、蛋白质等之间形成的氢键及疏水键,提取效果更好,在很多研究中发现体积分数为70%左右的提取率更高[5-7]。杭白菊作为药食同源的药材,含有丰富的多酚类,其提取物可作为天然抗氧化剂的来源加以利用,但目前关于杭白菊的研究多集中于化学成分分析和生物活性的研究,而对不同溶剂提取的多酚类含量及其抗氧化活性的研究报道较少,因此,本研究通过对杭白菊的提取,探讨不同提取溶剂(70%乙醇、70%甲醇、水)对其中总酚、总黄酮含量以及抗氧化活性的影响,为合理开发杭白菊提供一定的理论基础和科学依据。
1 材料
1.1 试剂与试药 杭白菊(产地浙江)购于浙江宁波同仁堂药店,经鉴定为菊科植物菊(Chrysanthemum morifolium Ramat.)的干燥头状花序。芦丁对照品(中国食品药品检定研究院,批号:100080–201811),没食子酸对照品(中国食品药品检定研究院,批号:110831-201906),亚硝酸钠、乙醇、甲醇、氢氧化钠、碳酸钠、九水硝酸铝、福林酚试剂、浓盐酸、乙酸钠、冰醋酸、六水三氯化铁均为分析纯,购自国药集团化学试剂有限公司,DPPH(1,1-二苯基-2-三硝基苯肼)、ABTS(2,2′-氨基-二(3-乙基-苯并噻唑啉磺酸-6)铵盐)、TPTZ(2,4,6-三吡啶基三嗪)、Trolox(水溶性维生素E)均购自阿拉丁生化科技股份有限公司。
1.2 仪器 FZ102型粉粹机(北京市永光明医疗仪器厂);超声波清洗机(KQ-50B,昆山超声仪器有限公司)、METTLER XS205型分析天平(Mettler Toled公司,瑞士);80-2台式低速离心机(上海手术器械厂);紫外-可见分光光度计(UV1600,美普达仪器有限公司);移液器(德国艾本德)。
2 方法
2.1 杭白菊提取物的制备 杭白菊烘干,研磨后密封保存,采用以下溶剂进行超声方法提取。
水提取:精密称取杭白菊粉末2.0106 g于50 mL密封玻璃瓶中,加20 mL水搖匀,浸泡20 min,再用超声波清洗机提取 30 min(参数为40 kHz,90 W,45 ℃),重复提取3次,滤液合并后恒温50 ℃旋转蒸发浓缩至10 mL。
70%乙醇提取:精密称取杭白菊粉末2.0091 g于50 mL密封玻璃瓶中,加入20 mL70%乙醇,按上述水提取步骤得到10 mL提取浓缩液。
70%甲醇提取:精密称取杭白菊粉末2.0091 g于50 mL密封玻璃瓶中,加入20 mL70%甲醇,按上述水提取步骤得到10 mL提取浓缩液。
2.2 总酚含量的测定
2.2.1 标准曲线的绘制 采用福林酚法[8],以没食子酸为对照品,取1 mL不同浓度没食子酸对照品溶液(0 μg/mL、4.50 μg/mL、9.00 μg/mL、18.0 μg/mL、36.0 μg/mL、54.0 μg/mL),分别加入0.2 moL/L福林酚试剂2.5 mL,混合均匀后避光静置4 min,再加入10%Na2CO3溶液2.5 mL,定容至10 mL,放置45 ℃恒温水浴中15 min,于波长为765 nm处测定吸光度。以没食子酸浓度为横坐标,吸光度为纵坐标,得到标准曲线:y=0.0195x+0.0238(R2=0.9998)。
2.2.2 精密度试验 精密量取6份1.0 mL没食子酸对照品溶液,加水定容到10 mL,精密移取1 mL,按照2.2.1项操作测定吸光度,计算RSD为1.4%。
2.2.3 稳定性试验 精密量取0.3 mL杭白菊水提取液,加水定容至10 mL,再从中移取1 mL,按照2.2.1项操作,待溶液显色后,每隔15 min,测定吸光度,测定6次,RSD值为0.6%,表明显色液在1.5 h内稳定。
2.2.4 重复性试验 取同一批次杭白菊6份,按2.1项方法制备水提取液,分别精密量取0.3 mL,按照2.2.1项操作测定吸光度,计算RSD值为2.8%(n=6)。
2.2.5 加样回收率试验 取6份杭白菊1.0 g,分别加入5 mg没食子酸对照品,按2.1项方法制备水提取液,分别精密移取0.3mL,加水定容至10 mL,再从中移取1 mL,按照2.2.1项操作测定,计算加样回收率,见表1,平均回收率为98.2%,RSD值为4.3%(n=6)。
2.2.6 杭白菊各提取物总黄酮含量测定 将上述2.1中的提取液,各移取0.30 mL,分别用相应的提取溶剂稀释定容至10 mL,再从中移取1 mL,按照2.2.1项操作测定,根据标准曲线方程计算各提取液的总酚含量,结果以每1克杭白菊粉末中所含没食子酸当量表示(mg GAE /g)。
2.3 总黄酮含量的测定
2.3.1 标准曲线的绘制 采用NaNO2-Al(NO3)3比色法,参照文献[9],以芦丁作为对照品,分别精密移取芦丁对照品溶液(0.110 mg/mL)0.0 mL、0.25 mL、0.5 mL、1.0 mL、2.0 mL、3.0 mL,各加入0.3 mL的5% NaNO2溶液,混匀后静置6 min,再加入0.3 mL 的10% Al(NO3)3溶液,混匀后静置6 min,最后加入4 mL 4%NaOH溶液,用蒸馏水定容至10 mL,静置15 min后,在510 nm波长处测定吸光度。以芦丁浓度为横坐标,吸光度为纵坐标,得到标准曲线:y=0.028x-0.0005(R2=0.9995)。
2.3.2 精密度试验 精密量取6份1.0 mL芦丁对照品溶液,按照2.3.1项操作测定吸光度,计算RSD为1.1%。
2.3.3 稳定性试验 精密量取0.1 mL杭白菊水提取液,按照2.3.1项操作,待溶液显色后,每隔15 min,测定吸光度,测定6次,RSD值为1.3%,表明显色液在1.5 h内稳定。
2.3.4 重复性试验 取同一批次杭白菊6份,按2.1项方法制备水提取液,分别精密量取0.1 mL,按照2.3.1项操作测定吸光度,计算RSD值为2.9%(n=6)。
2.3.5 加样回收率试验 取6份杭白菊1.0 g,分别加入10 mg芦丁对照品,按2.1项方法制备水提取液,分别精密移取0.1 mL,按照2.3.1项操作测定,计算加样回收率,见表2,平均回收率为103.1%,RSD值为4.4%(n=6)。
2.3.6 杭白菊各提取物总黄酮含量测定 将上述2.1中的提取液,各移取0.10 mL,按照2.3.1项操作测定,根据标准曲线方程计算各提取液的总黄酮含量,结果以每1 g杭白菊粉末中所含芦丁当量表示(mg RE/g)。
2.4 DPPH自由基清除能力 参照文献[10],精密移取2.1项下提取液各40 μL,补甲醇至200 μL,分别加入0.132 mmol/L的DPPH自由基甲醇溶液 7 mL,混匀后避光静置30 min,以甲醇做空白,517 nm下测定吸光度,同时测定不加提取液的空白试剂的吸光度,计算差值。将Trolox(水溶性维生素E)作对照品,以其浓度为横坐标,吸光度差值A(AB-AS,其中AB为未添加Trolox标准液的样品吸光度,AS为添加不同体积Trolox标准液的样品吸光度)为纵坐标,绘制标准曲线:y=0.5505x+0.0002(R2=0.9954),根据标准曲线方程计算各提取液的DPPH自由基清除能力,结果以每1克杭白菊粉末中的Trolox当量表示(μmol TE/g)。
2.5 ABTS自由基清除能力 将7.4 mmoL/L ABTS溶液与2.6 mmol/L的K2S2O8溶液等量混合后,避光反应16 h,取其中2.55 mL甲醇稀释至100 mL,在734 nm波长处测定吸收度为0.955,即得ABTS自由基工作液。
参照文献[11],精密移取2.1项下提取液各5 μL,补甲醇至100 μL,分别加入5.00 mL ABTS工作液,涡旋混匀后置避光处30 min,以甲醇做空白,在734 nm处测吸光值,同时测定不加提取液的空白试剂的吸光度,計算差值。将Trolox(水溶性维生素E)作对照品,以其浓度为横坐标,吸光度差值A(AB-AS,其中AB为未添加Trolox标准液的样品吸光度,AS为添加不同体积Trolox标准液的样品吸光度)为纵坐标,绘制标准曲线:y=0.5695x-0.0392(R2=0.9986),根据标准曲线方程计算各提取液的ABTS自由基清除能力,结果以每1 g杭白菊粉末中的Trolox当量表示(μmol TE/g)。
2.6 FRAP(铁离子还原能力) 将10 mmol/L TPTZ溶液、20 mmoL/L FeCl3·6H2O和0.3 mol/L的醋酸缓冲液(pH3.6)按1∶1∶10的体积比混合均匀,37 ℃预热30 min,即得FRAP工作液。
参照文献[12],精密移取2.1项下提取液各5 μL,补甲醇至150 μL,分别加入2.85 mL FRAP工作液,涡旋混匀后显紫色,置避光处30 min,以试剂空白作参比,于593 nm处测定吸光度。将Trolox作对照品,以其浓度为横坐标,吸光度为纵坐标,绘制标准曲线: y=1.7664x+0.0517 (R2=0.9981),以标准曲线方程计算各提取液的铁离子还原能力,结果以每1 g杭白菊粉末中的Trolox当量表示(μmol TE/g)。
2.7 数据分析 所有重复测量的数据均以“平均加减标准偏差”表示,应用SPSS 26.0进行统计分析,用Least Significant Difference (LSD)和Student-Newman-Keuls (S-N-K)检验来进行差异显著性分析,用Pearson相关系数来衡量相关性,P<0.05表示显著性差异。
3 结果与分析
3.1 总酚和总黄酮的含量 杭白菊经不同溶剂超声提取后,其总酚含量和总黄酮含量见表3。
三种提取物之间总酚、总黄酮含量均呈现显著差异(P<0.05),其中70%乙醇作为提取溶剂提取的总酚、总黄酮含量均为最高,分别为(6.66±0.52)mg GAE/g和(15.64±0.56)mg RE/g,70%甲醇次之,而水作为溶剂提取效率是最低的,这与酚类物质在不同溶剂中的溶解度不同有关[13],说明对于提取杭白菊中的多酚类物质,70%乙醇作为溶剂其提取效率是三者中最高的。
3.2 DPPH自由基清除能力 DPPH自由基加入自由基清除剂时,在最大吸收波长处的吸收度变小,变小程度与自由基清除能力相关,因此,被广泛用于衡量各种天然产物的自由基清除能力[10]。由表4可知,杭白菊三种提取物都具有一定的DPPH自由基清除能力,大小顺序依次为:70%乙醇提取物 > 70%甲醇提取物 >水提取物,70%乙醇提取物对DPPH自由基清除能力是最强的,水提取物是最弱的,但与70%甲醇提取物的DPPH自由基清除能力接近,三种提取物的DPPH自由基清除能力不存在显著性差异(P>0.05)。
3.3 ABTS自由基清除能力 ABTS呈蓝绿色,加入抗氧化物质后,发生褪色,颜色越浅,在最大吸收波长处的吸收度变得越小,说明该抗氧化物质的自由基清除能力越强[11]。表4中,杭白菊三种提取物对ABTS自由基的清除能力由高到低依次为: 70%乙醇提取物 > 70%甲醇提取物 >水提取物,并存在显著性差异(P<0.05)。三种提取物中,70%乙醇提取物对ABTS自由基的清除效果明显是最好的,而水提取效果最差。
3.4 FRAP铁离子还原能力 FRAP法作为一种简单有效的方法常用于测定植物提取物中抗氧化成分的还原铁离子的能力[12]。表4显示,杭白菊三种提取物对铁离子还原能力大小顺序和以上两种测定方法一致,其中,70%乙醇提取物的铁离子还原能力虽然大于70%甲醇提取物,但无显著性差异(P>0.05),而水提物明显是最弱的(P<0.05)。以上三种抗氧化能力测定结果也进一步说明70%乙醇是提取杭白菊抗氧化活性物质较好的溶剂。
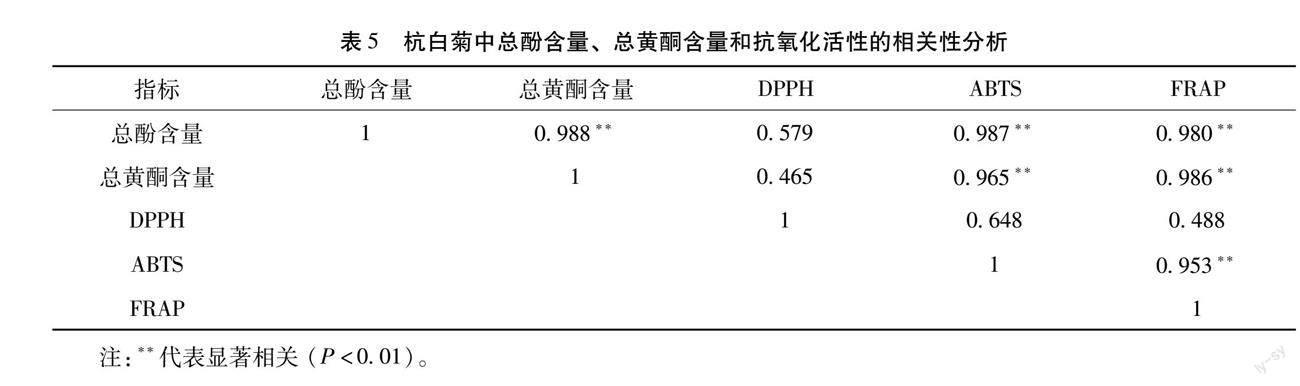
3.5 相关性分析 对杭白菊不同溶剂提取物中总酚、总黄酮含量和抗氧化能力进行相关性分析(见表5)。
其中总酚和总黄酮含量与ABTS自由基清除能力和FRAP铁离子还原能力呈现显著正相关,相关系数也很高,说明杭白菊中多酚类物质和黄酮类物质对其表现出的ABTS自由基清除能力和FRAP铁离子还原能力起着重要的作用,但总酚和总黄酮的含量与DPPH自由基清除能力的相关性却不高,可能杭白菊提取物抗氧化能力的强弱还与其中物质的种类和组成有关[14]。
4 结论
本研究测定了杭白菊不同溶剂超声提取物中总酚和总黄酮的含量,结果显示,三种提取物中总酚、总黄酮的含量大小顺序为:70%乙醇提取物 > 70%甲醇提取物 >水提取物,70%乙醇作为提取溶剂提取的总酚和总黄酮含量均为最高,说明在同样的超声波提取条件下,三种溶剂中70%乙醇是提取杭白菊酚类、黄酮类物质效率最高的溶剂。
本研究采用了三种方法(DPPH自由基清除能力、ABTS自由基清除能力和FRAP铁离子还原能力)对杭白菊提取物的体外抗氧化活性进行了测定,发现各提取物呈现不同程度的抗氧化活性,70%乙醇提取物的活性最强,其中总酚和总黄酮含量与ABTS自由基清除能力和FRAP铁离子还原能力呈现显著正相关,本研究结果可为进一步开发利用杭白菊提供一定的理论基础和科学依据。此外,提取物的抗氧化活性不能只关注其总酚、总黄酮含量,还应考虑提取物中主要物质的化学组成、含量和化学结构,这也是影响抗氧化活性的重要因素,因此也需要进一步对提取物中单个酚类、黄酮类化合物进行分析和鉴定,以便更好地研究它们的抗氧化作用机制。
参考文献
[1]
潘辉.桐乡杭白菊[J].开卷有益—求医问药,2016(1):69.
[2]国家药典委员会.中国药典(一部)[S].北京:中国医药科技出版社,2020:323.
[3]金建忠,闻鸣,申屠超.杭白菊化学成分最新研究进展[J].食品工业科技,2014,35(15):386-389,394.
[4]NIZAM I,MUSHFIQ M.Antioxidant activity of five different solvent extracts of the edible fruits of Ficus racemosa [J].Oriental Pharmacy and Experimental Medicine,2012,12(3):189-195.
[5]华艳宏,庞春花,张永清,等.藜麦种子不同溶剂提取物及其抗氧化活性[J].江苏农业科学,2018,46(20):225-228.
[6]王纪辉,耿阳阳,刘亚娜,等..不同溶剂浸提下核桃果实不同部位多酚物质响应及其组成[J].南京师大学报(自然科学版),2022,45(3):35-45.
[7]宋慧,成军.梨皮多酚的乙醇提取及抗氧化性研究[J].徐州工程学院学报(自然科学版),2019,34(4):28-31.
[8]CHAVAN J J,GAIKUAD N B,KSHIRSAGAR P R,et al.Total phenolics,flavonoidsandantioxidant propertiesof three Ceropegia species fromWestern Ghats of India [J].South African journal of Botany,2013,88(5): 273-277.
[9]韩志萍,崔海燕,张志琪.响应曲面法优化甜杏仁皮总黄酮提取工艺[J].安徽农业科学,2015,43(28): 278-281,284.
[10]GORDON M H,PAIVA-MARTINS F,ALMEIDA M.Antioxidant activity of hydroxytyrosol acetate compared with that of other olive oil polyphenols [J].Journal of agricultural and food chemistry,2001,49(5): 2480-2485.
[11]RE R,PELLEGRINI N,PROTEGGENTE A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay [J].Free Radical Biology & Medicine.1999,26(9/10):1231-1237
[12]BENZIE I F,STRAIN J J.The ferric reducing ability of plasma(FRAP)as a measure of “Antioxidant Power”: The FRAP assay [J].Analytical Biochemistry,1996,239(1):70-76.
[13]CHAN P T,MATANJUN P,YASIR S M,et al.Antioxidant activities and polyphenolics of various solvent extracts of red seaweed,Gracilaria changii [J].Journal of Applied Phycology,2014,27(6):2377-2386.
[14]ZHENG W,WANG S Y.Oxygen radical absorbing capacity of phenolics in blueberries,cranberries,chokeberries,and lingonberries [J].Journal of agricultural and food chemistry,2003,51(2):502-509.
(收稿日期:2023-04-06 編辑:刘斌)
