脂溶性迷迭香提取物微胶囊的制备及其抗氧化性研究
2024-04-13邵爽颜硕李朝杰鲍小根张秀苹谷大海
邵爽,颜硕,李朝杰,鲍小根,张秀苹,谷大海
1.云南农业大学食品科学技术学院(昆明 650000);2.山东聚鸿生物科技研究院有限公司(威海 264200);3.寻甸县伊泰食品有限公司(昆明 650000)
亚灌木芳香植物迷迭香(Rosmarinus of ficinalis L.)原产于欧洲地区及非洲地中海沿岸,其生物活性丰富,常被用作药材及烹饪原料进行使用[1-2]。在模拟动物细胞环境的体外试验中发现,迷迭香的多酚提取物可使癌细胞内的ROS含量急剧增加,使其逐渐死亡,最终由于无法增殖而停止扩散[3]。脂溶性迷迭香提取物,其主要活性物质为鼠尾草酸和鼠尾草酚,主要通过中断自由基链式反应,清除自由基以起到抗氧化的作用[4],其抗氧化效果较好[5-8]。迷迭香来源天然、安全无毒、稳定性好且无不良反应[9]。吕雯雯等[4]向新鲜猪肉中添加脂溶性迷迭香提取物,结果发现它不仅能有效减缓猪肉脂肪的氧化,还能防止猪肉pH的降低,抑制微生物的生长和繁殖,延缓生鲜猪肉的货架期。霍晓娜等[10]研究表明脂溶性抗氧化剂相比于水溶性抗氧化剂,可以较好抑制猪肉的脂肪氧化和细菌繁殖,从而延长其货架期。Gordon等[11]发现在80 ℃和100 ℃条件下,迷迭香提取物对菜籽油的保护作用优于丁基羟基茴香醚(BHA)和2,6-二叔丁基对苯酚(BHT)。
微胶囊技术在很多领域得到非常广泛使用,近年来更是在食品领域受到广泛青睐。微胶囊技术在食品中的应用主要是对油脂、酶、微生物及果蔬饮料等的包埋[12]。微胶囊具有将流质体粉末化、隔离活性组分、保护敏感的食品组分以及控制定向释放等功能[13]。天然环糊精及其衍生物具有外亲水的刚性空腔结构,可使小分子物质进入空腔内形成主客体包合物,从而提高客体分子的稳定性和水溶性,并控制客体小分子的释放量[14-15]。羟丙基-β-环糊精(HP-β-CD)是由环糊精与环氧丙烷缩合得到的亲水性衍生物,羟丙基破坏环糊精分子内的氢键,不仅提高HP-β-CD的水溶性,还保留β-CD的包合能力[16],应用非常广泛。其水溶性比β-环糊精更好,常温下其溶解程度达50%以上,由于性质优良,其在医药和食品等领域的应用非常广泛[17]。杨伟培等[18]利用HP-β-CD对水飞蓟素进行包埋,结果发现其在大鼠体内的生物利用度较未包埋组显著提高。王晴晴等[19]将白藜芦醇用HP-β-CD包埋成微胶囊,结果发现可以显著提高白藜芦醇的溶解度,提高其生物利用价值。此次试验利用HP-β-CD对脂溶性迷迭香提取物进行包埋,考察微胶囊包埋的最佳条件和微胶囊化对其抗氧化性的影响,旨在为脂溶性抗氧化剂的微胶囊化提供理论依据和数据参考。
1 材料与方法
1.1 材料与仪器
脂溶性迷迭香提取物(食品级,河南森源本草天然产物股份有限公司);羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HP-β-CD,食品级,河北汪优生物科技有限公司);福林酚(分析纯,北京酷来搏科技有限公司);无水碳酸钠(分析纯,天津市风船化学试剂科技有限公司);三氯乙酸(分析纯,广东光华科技股份有限公司);2-硫代巴比妥酸(优级纯,国药集团化学试剂有限公司);乙二胺四乙酸二钠(EDTA-2Na,分析纯,西陇科学股份有限公司);没食子酸标准品(HPLC≥98%,上海麦克林生化科技有限公司)。
L1611030紫外-可见光分光光度计(上海菁华科技仪器有限公司);XHF-D高速分散器(宁波新芝生物科技股份有限公司);H2-16KR台式离心机(河南可成仪器设备有限公司);ZD-85气浴恒温振荡器(江苏金坛市环宇科学仪器厂);BS224S分析天平(北京赛多利斯仪器系统有限公司);JJ500型电子天平[美国双杰兄弟(集团)有限公司];Scientz-18N真空冷冻干燥机(宁波新芝生物科技股份有限公司)。
1.2 试验方法
1.2.1 微胶囊制备工艺
试验以HP-β-CD为包合材料,脂溶性迷迭香提取物为芯材制备脂溶性迷迭香提取物微胶囊。配制10%的HP-β-CD溶液,放置8 h备用。加入一定量脂溶性迷迭香提取物,放置在气浴恒温振荡器上振荡一定的时间。将振荡后的溶液取出冷却,在8 000 r/min条件下离心15 min,上清液即为脂溶性迷迭香提取物微胶囊溶液。将上清液通过冷冻干燥,即可获得脂溶性迷迭香提取物微胶囊。以包埋率为评价指标,考察形成微胶囊的最适条件。
1.2.2 单因素试验
1.2.2.1 芯壁比对包埋率的影响
选择振荡时间40 min、振荡温度45 ℃,以包埋率为评价指标,考察不同芯壁比(1∶13,1∶12,1∶11,1∶10和1∶9)对微胶囊包埋率的影响。
1.2.2.2 振荡时间对包埋率的影响
选择芯壁比1∶12、振荡温度45 ℃,以包埋率为评价指标,考察不同振荡时间(20,40,60,80和100 min)对微胶囊包埋率的影响。
1.2.2.3 振荡温度对包埋率的影响
选择芯壁比1∶12、振荡时间40 min,以包埋率为评价指标,考察不同振荡温度(35,40,45,50和55℃)对微胶囊包埋率的影响。
1.2.3 正交试验
在单因素试验结果的基础上,进行正交试验设计分析。根据单因素试验结果,运用Design Expert8.0.6,取芯壁比(脂溶性迷迭香提取物与HP-β-CD比例1∶13,1∶12和1∶11)、振荡时间(20,40和60 min)、振荡温度(40,45和50 ℃)3个因素,设计正交试验的因素水平,选取L9(33)正交表进行试验,如表1所示。

表1 L9(33)正交试验因素水平表
1.2.4 微胶囊包埋率和缓释率的计算
1.2.4.1 没食子酸标曲的制作
参照GB/T 31740.2—2015《茶制品第2部分:茶多酚》中多酚含量的测定方法[20],按照福林酚法测定多酚含量。精密称取一定量的没食子酸对照品溶于纯水中,将质量浓度分别稀释成10,20,30,40和50 μg/mL,以纯水为空白对照,分别移取测试液各1 mL于刻度试管内,加入5.0 mL 10%福林酚试剂,摇匀,反应3~8 min,加入4.0 mL 7.5%的Na2CO3溶液,摇匀后室温下放置60 min。在765 nm波长下测定吸光度(A)。作线性回归,得到标准曲线为y=0.011x+0.011 5,R2=0.999 5。
1.2.4.2 微胶囊包埋率的计算
称取一定量的脂溶性迷迭香提取物溶于10%HP-β-CD水溶液中,分别测定包埋前溶液中脂溶性迷迭香提取物的含量和包埋后离心上清液中脂溶性迷迭香提取物的含量,按照没食子酸法测定溶液中的多酚含量,按式(1)计算微胶囊包埋率。
式中:W为微胶囊包埋率,%;A为上清液中脂溶性迷迭香提取物含量,g/mL;B为包埋前脂溶性迷迭香提取物含量,g/mL。
1.2.4.3 微胶囊载物量的计算
分别精密称取相同质量(精确至0.000 1 g)的脂溶性迷迭香提取物和脂溶性迷迭香提取物微胶囊溶于纯水中,按照没食子酸法测定溶液中的多酚含量,计算微胶囊载物量,按式(2)计算。
式中:S为微胶囊载物量,%;C为微胶囊中脂溶性迷迭香提取物含量,g/mL;D为脂溶性迷迭香提取物含量,g/mL。
1.2.4.4 微胶囊缓释率的测定
精密称取0.100 0 g脂溶性迷迭香提取物微胶囊,分散于100 mL超纯水中,进行溶出试验,每隔24 h取0.5 mL溶液。取出的样品于5 000 r/min离心15 min,取100 μL上清液于试管中,按照没食子酸法测定脂溶性迷迭香提取物含量,通过测定显色后的吸光度,计算微胶囊芯材的释放量,绘制释放曲线。
1.2.5 脂溶性迷迭香提取物微胶囊抗氧化能力的测定
1.2.5.1 丙二醛标曲的制作
参照GB 5009.181—2016《食品中丙二醛的测定》[21],采用分光光度法测定丙二醛含量。准确配制质量浓度分别为0.01,0.05,0.10,0.15和0.25 μg/mL的丙二醛标准溶液,以样品空白调节零点,于波长352 nm处测定吸光度。作线性回归,得到标准曲线y=1.164 4x+0.006 2,R2=0.999 1。
1.2.5.2 牛肉处理方法
取新鲜的黄牛后腿肉,加入3%的食盐绞碎,将肉糜分成A、B、C、D组,每组3份,每份100 g,备用,按照表2添加抗氧化剂。其中A组为空白组,B组为阳性对照组。每份肉样平铺于锡箔纸上,放于4 ℃条件下冰箱中腌制,在腌制第1,第4,第7,第10,第13和第16天测定其硫代巴比妥酸值(TBARs),观察将脂溶性迷迭香提取物微胶囊化对其抗氧化能力的影响。

表2 样品处理 单位:%
1.2.5.3 牛肉TBARs含量的测定
准确称取5 g(精确到0.01 g)牛肉样品置于100 mL具塞锥形瓶中,加入50 mL三氯乙酸混合液摇匀,加塞密封,置于恒温振荡器上50 ℃振摇30 min,取出冷却至室温,用双层定量慢速滤纸过滤,弃去初滤液,续滤液备用。
准确移取5 mL上述滤液,置于25 mL具塞比色管中,另取5 mL三氯乙酸混合液作为样品空白,分别加入5 mL硫代巴比妥酸(TBA)水溶液,加塞混匀,置于90 ℃水浴内反应30 min,取出冷却至室温。以样品空白调节零点,于波长352 nm处测定吸光度。
1.3 数据处理
所有数据均采用Excel 2010软件进行数据初步处理分析,所有样品均做3次平行,采用SPSS 19.0软件进行数据统计分析对各组进行One-Way ANOVA方差分析和Duncan’s多重比较,P<0.05水平做显著差异检验的标准;用SIMCA 14.1(瑞典Umetrics AB公司)进行多元统计学分析,采用Origin 2017进行绘图。
2 结果分析
2.1 脂溶性迷迭香提取物微胶囊单因素试验结果
2.1.1 脂溶性迷迭香提取物与HP-β-CD的比例对包埋率的影响
试验结果如图1所示。一开始随着脂溶性迷迭香提取物用量的增加,微胶囊包埋率呈现上升的趋势。脂溶性迷迭香提取物与HP-β-CD比例1∶12时,包埋率最高,当两者比例超过1∶12时,微胶囊的包埋率开始下降。因此选择芯壁比1∶12进行后续的正交试验。
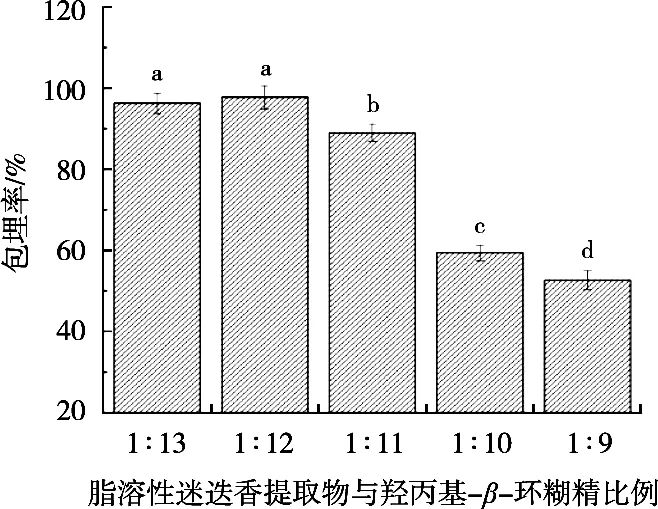
图1 迷迭香提取物与羟丙基-β-环糊精的比例对包埋率的影响
2.1.2 振荡时间对包埋率的影响
试验结果如图2所示。一开始随着振荡时间的增加,包埋率也随之增加。振荡时间40 min时,包埋率达到最大。随着振荡时间继续延长,包埋率又随着时间的增加而降低。因此选择振荡时间40 min进行后续的正交试验。
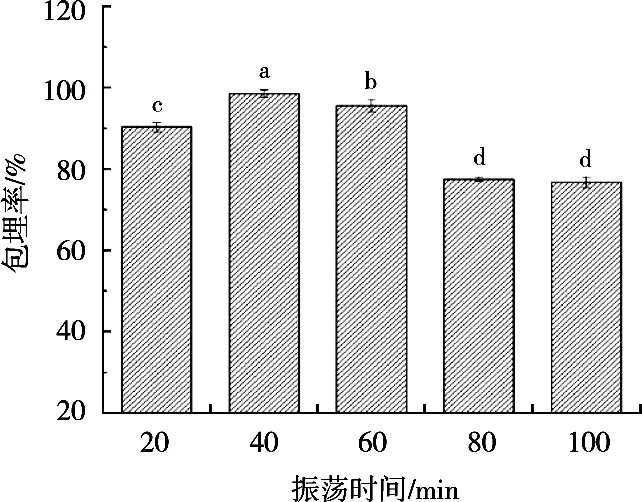
图2 振荡时间对包埋率的影响
2.1.3 振荡温度对包埋率的影响
试验结果如图3所示。温度在35~45 ℃范围内时,脂溶性迷迭香提取物微胶囊的包埋率随着温度的升高而升高,温度达到45 ℃时,包埋率达到最高,而后包埋率随着温度的升高而降低。因此选择振荡温度45 ℃进行后续的正交试验。

图3 振荡温度对包埋率的影响
2.2 正交试验结果
基于单因素试验中影响脂溶性迷迭香提取物微胶囊形成的因素,选取芯壁比、振荡时间、振荡温度这3个因素分别作为正交试验的A、B、C这3个因素。采用正交试验进行三因素三水平试验,以包埋率为最终评价指标,试验结果见表3。

表3 迷迭香提取物微胶囊正交试验结果
利用Excel 2019、Design Expert 8.0.6进行数据处理,在P<0.05和P<0.01水平下进行检测。从表3可以看出,制备迷迭香提取物微胶囊的最优组合为A1B3C3,即芯壁比1∶13,振荡时间60 min,振荡温度50 ℃。根据极差结果分析得到RC>RB>RA,因此影响包埋率因素的主次顺序为振荡温度>振荡时间>芯壁比。振荡温度对微胶囊的包埋率影响最大,温度50 ℃时,包埋效果最好;其次是振荡时间,时间为40 min时,包埋效果最佳;最后是迷迭香提取物与HP-β-CD的比例,方差分析结果如表4所示。

表4 方差分析表
由表4结果直观分析可见,3个因素对脂溶性迷迭香提取物微胶囊包埋率 的影响程度依次为C>B>A。方差分析表明,因素C影响最为显著,其次是因素B,差异有统计学意义(P<0.05)。因素A对试验影响较小(P>0.05)。
2.3 验证试验
为确认上述工艺的稳定性,按照表4极差分析结果,选取芯壁比1∶13、振荡时间60 min、振荡温度50℃进行验证试验,重复测定3次。测得微胶囊的包埋率如表5所示。

表5 验证试验结果
由表5所示,当芯壁比1∶13、振荡时间60 min、振荡温度50 ℃时,微胶囊包埋率为97.48%±0.74%。试验结果表明,该工艺稳定可行,并且重复性良好。杨玉婷等[22]以HP-β-CD壁材对川芎挥发油进行包埋,结果发现川芎挥发油的溶解度得到显著提高,而且在60 ℃下贮藏10 d,包合物表现出良好稳定性,该方法操作简单、包埋率高,能显著改善川芎挥发油的溶解度及稳定性。范珊珊等[23]利用HP-β-CD对氯雷他定进行包埋,包埋率为97.67%。付丽娜等[24]将茉莉精油制成微胶囊后,其水溶性大幅提高,同时也保护其贮存及使用过程中活性,提高精油的稳定性。相关结论皆与试验结果一致。
2.4 微胶囊载物量测定结果
采用紫外-可见分光光度法,通过脂溶性迷迭香提取物在紫外-可见光区的特定波长光的吸收度,对其进行定性和定量分析。分别测定脂溶性迷迭香提取物包埋前后的吸光度,微胶囊的载物量为7.50%±0.89%。苏行等[25]利用HP-β-CD对丹参二萜醌进行包埋,其载药量为5.44%。王天琦[26]通过冷冻干燥法制备柠檬醛/羟丙基-β-环糊精包合物,其含油率为5.9%,皆与试验结果相近。
2.5 微胶囊缓释率测定结果
采用紫外-可见分光光度法,通过脂溶性迷迭香提取物在紫外-可见光区的特定波长光的吸收度,对该物质进行定性和定量分析。每隔24 h测定脂溶性迷迭香提取物微胶囊的缓释率。脂溶性迷迭香提取物微胶囊在第0天时,缓释率为74.21%,随着时间的延长,微胶囊的缓释率逐渐升高,到第4天时,缓释率达95.68%。可能是微胶囊在高负载状态下,释放率呈现显著上升趋势[27]。其缓释率如图4所示。说明将脂溶性迷迭香提取物微胶囊化可以起到一定缓释作用,并且可以很好地保护迷迭香提取物的活性。Julaeha等[28]研究发现微胶囊可以提高活性物质的稳定性,调节其释放速率,从而延长产品的保质期,表明微胶囊具有一定缓释作用。
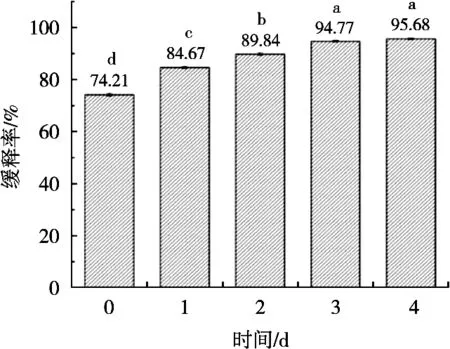
图4 迷迭香提取物微胶囊缓释率曲线
2.6 牛肉糜腌制过程中TBARs值测定结果
从表6可以看出,在腌制过程中,4组均维持在良质肉的水平,其中空白组在腌制过程中氧化最严重,TBARs值显著高于其他组(P<0.05),说明异VC钠、脂溶性迷迭香提取物和脂溶性迷迭香提取物微胶囊能够很好地抑制脂肪氧化。在腌制第1天,B、C、D组的TBARs值没有显著性差异(P>0.05)。说明在腌制第1天,脂溶性迷迭香提取物、脂溶性迷迭香提取物微胶囊和异VC钠的抗氧化效果相当。在腌制第4天,B组TBARs值显著低于C、D组(P<0.05),C、D组之间没有显著性差异。说明在腌制初期,脂溶性迷迭香提取物和脂溶性迷迭香提取物微胶囊的抗氧化效果相当。

表6 牛肉糜腌制过程中TBARs值的变化
在腌制第7~第13天,B、D组的TBARs值没有显著性差异,但显著低于C组(P<0.05),在腌制第16天,D组TBARs值显著低于B、C组。综合试验结果说明将脂溶性迷迭香提取物微胶囊化可以明显提高其抗氧化能力,还能起到一定缓释作用。Christaki等[29]将精油微胶囊添加到奶酪中,结果发现其可以有效控制奶酪的水分和质量损失,延长奶酪的保质期,与此次试验结论一致。
3 结论
试验探究不同芯壁比、振荡时间及振荡温度对微胶囊包埋效果的影响。结果表明,当芯壁比1∶13、振荡时间60 min、振荡温度50 ℃时,脂溶性迷迭香提取物微胶囊的包埋效果最佳,包埋率达97.48%,载物量为7.50%。另外,脂溶性迷迭香提取物微胶囊后期的抗氧化能力显著高于脂溶性迷迭香提取物(P<0.05),说明将其微胶囊化可以保护脂溶性迷迭香提取物的活性,还有一定缓释作用,为进一步研究天然抗氧化剂的微胶囊化提供理论依据。
