发酵食品中具有潜在降尿酸功能乳酸菌的筛选及特性分析
2024-04-12李杰李霜张鹏霞祝丽玲周健孙雪微宋丽新
李杰,李霜,张鹏霞,祝丽玲,周健,孙雪微,宋丽新
(1.佳木斯大学 公共卫生学院黑龙江省痛风研究重点实验室,黑龙江 佳木斯 154000;2.佳木斯大学附属第一医院 急诊科,黑龙江 佳木斯 154000;3.佳木斯大学 基础医学院 黑龙江省微生态-免疫调控网络与相关疾病重点实验室,黑龙江 佳木斯 154000;4.包头市疾病预防控制中心,内蒙古 包头 014030)
随着经济的快速发展和人们生活方式的改变,高蛋白和高嘌呤食物的摄入量不断增加,致使世界范围内高尿酸血症的人群患病率逐年攀升[1]。高尿酸血症是一种因嘌呤代谢紊乱和尿酸形成与分泌失衡引发的代谢性疾病,也是导致痛风、动脉硬化和心血管等疾病发生的重要危险因素之一[2-3]。目前,针对该病的治疗方法主要包括饮食干预和药物治疗,但由于人群饮食控制难度较大,且药物所产生的副作用偏多[4-5],因此,寻找温和、无毒副作用的方式有效降低高尿酸血症患者的血清尿酸水平已成为目前该领域研究的热点问题。
近几年相关研究发现益生菌对高尿酸血症和痛风具有积极的调控作用[6],乳酸菌作为一类重要的益生菌其对高尿酸血症的作用功效及途径被陆续报道。麻菊美等[7]从泡菜中分离筛选出一株能够高效降解嘌呤核苷的弯曲乳杆菌,该菌株对肌苷和鸟苷的降解率均在89% 以上,且在人工胃肠液中表现出一定的耐受性,具有良好的益生特性。Wu 等[8]从浆水中分离了一株发酵乳杆菌JL-3,发现该菌株可以有效降低小鼠血清中尿酸水平,并且对小鼠体内因高尿酸血症诱导所引发的氧化胁迫应答、炎症反应以及肠道菌群失衡现象等进行调节。除此之外,García-Arroyo 等[9]研究发现,乳酸菌KB27 和KB79 可以降低高尿酸血症大鼠血清中尿酸水平,有效改善其肾部损伤以及产生的高血压症状,对高尿酸血症起到一定预防作用。目前,有关乳酸菌在高尿酸血症中的应用研究尚不全面,且迄今所报道的对高尿酸血症有益生作用的乳酸菌种仍相对较少,更多研究亟待深入。
本研究利用高效液相色谱(high performance liquid chromatography,HPLC)法[10-11]测定乳酸菌核苷降解能力,通过分析菌株对黄嘌呤氧化酶(xanthine oxidase,XOD)的抑制作用、在胃肠道中的转运能力、耐酸和耐胆盐能力以及对抗生素的敏感性等,初步判断菌株益生特性,选择出对高尿酸血症具有潜在预防和辅助治疗作用的乳酸菌,以期为今后利用益生菌对高尿酸血症进行靶向治疗提供理论基础和菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种来源
本试验所用的30 株菌株分离自东北传统发酵大酱以及朝鲜族农家自制泡菜中。
1.1.2 药品及试剂
MRS 培养基:青岛海博生物技术有限公司;肌苷标准品、鸟苷标准品(色谱纯)、黄嘌呤氧化酶活性检测试剂盒、黄嘌呤氧化酶标准品(色谱纯)、胃蛋白酶(≥250 U/mg)、胰蛋白酶(250 N.FU/mg)、胆盐:北京索莱宝科技有限公司;药敏纸片:常德比克曼生物科技有限公司。
1.2 仪器与设备
高效液相色谱仪(LC-20A):日本岛津公司;高速冷冻低温离心机(multifuge X1R)、恒温振荡培养箱(BPH-9272):美国Thermo Fisher 公司;恒温振荡水浴装置(Julabo SW22):优莱博技术(北京)有限公司;可见分光光度计(VIS-7220N):北京瑞利分析仪器公司;基质辅助电离解析飞行时间质谱仪(MBT smart):布鲁克(北京)科技有限公司。
1.3 试验方法
1.3.1 菌种的分离与纯化
将25 mL 4 ℃保存的泡菜汤汁加入225 mL 无菌生理盐水中,并将其进行10 倍浓度梯度稀释(10-1~10-7),吸取100 μL 的样品稀释液涂布于MRS 琼脂培养基上,于37 ℃静置培养48 h 后,根据乳酸菌菌落颜色及形态学特征挑取单菌落,利用平板划线法进行分离和纯化。
1.3.2 肌苷和鸟苷标准曲线的制作
将16.90 mg 肌苷和22.88 mg 鸟苷标准品溶于1 mol/L K3PO4溶液中,配制成浓度为1.26 mmol/L 的肌苷-鸟苷混合标准溶液。分别吸取0.25、0.5、1.0、2.5 mL和5 mL 肌苷-鸟苷混合标准溶液,加入1 mol/L K3PO4溶液定容至5 mL,混匀。以浓度为横坐标,峰面积为纵坐标制备肌苷-鸟苷标准曲线。
1.3.3 降解肌苷和鸟苷乳酸菌的筛选
参照Tsuboi 等[12]的方法筛选能够降解核苷的乳酸菌:将经充分活化的菌液以体积分数为1% 的接种量接种到新鲜的MRS 培养基中,37 ℃静置培养48 h后,取2 mL 培养液,于4 ℃、4 000 r/min 条件下离心10 min,收集菌体,并用无菌的0.9% NaCl 溶液清洗2 次后,重悬于750 μL 肌苷和鸟苷磷酸盐反应液中,重悬菌体后置于37 ℃、120 r/min 孵育1 h,于4 ℃、4 000 r/min 条件下离心10 min 后取上清液,按体积比9∶1 加入0.1 mol/L HClO4终止反应。用微孔滤膜过滤上清液,用HPLC 法测定其中肌苷和鸟苷的含量。色谱条件为柱温30 ℃、流速1 mL/min、测定波长260 nm。流动相组成为水∶色谱甲醇=95∶5(体积比)。
按公式(1)计算菌株对肌苷和鸟苷的降解率(J,%)。
式中:C0为母液质量浓度,g/L;C1为残留液质量浓度,g/L。
1.3.4 乳酸菌对XOD 的抑制作用
将菌体培养液以5%(体积分数)的接种量接种于MRS 肉汤培养基中,37 ℃静置培养24 h 后,于4 ℃、10 000 r/min 离心10 min 收集菌体沉淀。用pH6.8 无菌磷酸缓冲盐溶液(phosphate buffered saline,PBS)冲洗2~3 次并重悬沉淀,将菌浓度调整至1×109CFU/mL,在超声条件(200 W、工作5 s 停5 s)下进行10 min 的脉冲破碎,所得液体于10 000 r/min 离心10 min,取离心后的上清液得到细胞内容物。利用XOD 活性检测试剂盒对XOD 活性进行测定。XOD 催化次黄嘌呤产生黄嘌呤和超氧阴离子,超氧阴离子与盐酸羟胺反应生成NO2-,NO2-在氨基苯磺酰胺和萘乙二胺盐酸盐的作用下,生成紫红色的偶氮化合物,在530 nm 有特征吸收峰[13],其生成量可反映XOD 活性大小。首先对XOD氧化酶活性(A,U/mg)进行测定,之后将菌的细胞内容物与酶液进行孵育后测定XOD 氧化酶液的活性(B,U/mg)。各菌株对XOD 抑制率(X,%)按公式(2)进行计算。
1.3.5 乳酸菌的鉴定
将筛选得到的菌体接种于MRS 液体培养基中活化24 h 后,提取菌体总基因组DNA,并利用通用引物对菌株16S rDNA 序列进行扩增,并将扩增产物送至华大基因股份有限公司(北京)测序,将测序结果在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)进行BLAST 比对分析,从而对菌株类别进行鉴定。
1.3.6 乳酸菌对酸耐受性测定
将所筛选的菌株培养液以体积分数为5%的接种量接种于pH 值为2.0、3.0 和4.0 的MRS 肉汤培养基中,37 ℃下培养4 h 后取样进行平板活菌计数和存活率计算。各菌株存活率(C,%)按公式(3)进行计算。
式中:x为处理后活菌数,CFU/mL;y为对照组活菌数,CFU/mL。
1.3.7 乳酸菌对胆盐耐受性测定
将所筛选的菌株培养液以体积分数为5%的接种量接种于无胆盐和含0.3% 胆盐的MRS 肉汤培养基中,37 ℃下培养5 h,并分别于0、1、3、5 h 取样进行平板活菌计数和通过公式(3)计算存活率。
1.3.8 乳酸菌对人工模拟胃肠液耐受性测定
将3 mL 活化后的菌液于4 ℃、4 000 r/min 离心10 min,用0.85% 生理盐水洗涤3 次后,重悬于3 mL人工胃液(pH3.0,3g/L 胃蛋白酶)中,37 ℃培养3 h。取处理3 h 后的菌液1 mL 转移至9 mL 人工模拟肠液(pH6.8,1 g/L 胃蛋白酶、0.3%胆盐)中,37 ℃培养4 h。依据GB 4789.2—2022《食品安全国家标准食品微物学检验菌落总数测定》计算菌株在胃肠液环境中的活菌数,通过公式(3)计算存活率。
1.3.9 乳酸菌耐药性测定
将200 μL 的菌液涂布于MRS 培养基上,在每个培养基中放置一种抗生素药敏纸片,置于37 ℃培养24 h 后,用游标卡尺测量抑菌圈直径,并根据李艳莉[14]的方法对乳酸菌的耐药性进行判定。
1.4 数据处理与分析
本试验数据利用SPSS 29.0 进行统计分析,数据以平均值±标准差表示。采用单因素方差分析和Duncan多重比较组间差异显著性(P<0.05)。
2 结果与分析
2.1 鸟苷和肌苷标准曲线的制作
鸟苷和肌苷标准品色谱图如图1 所示。
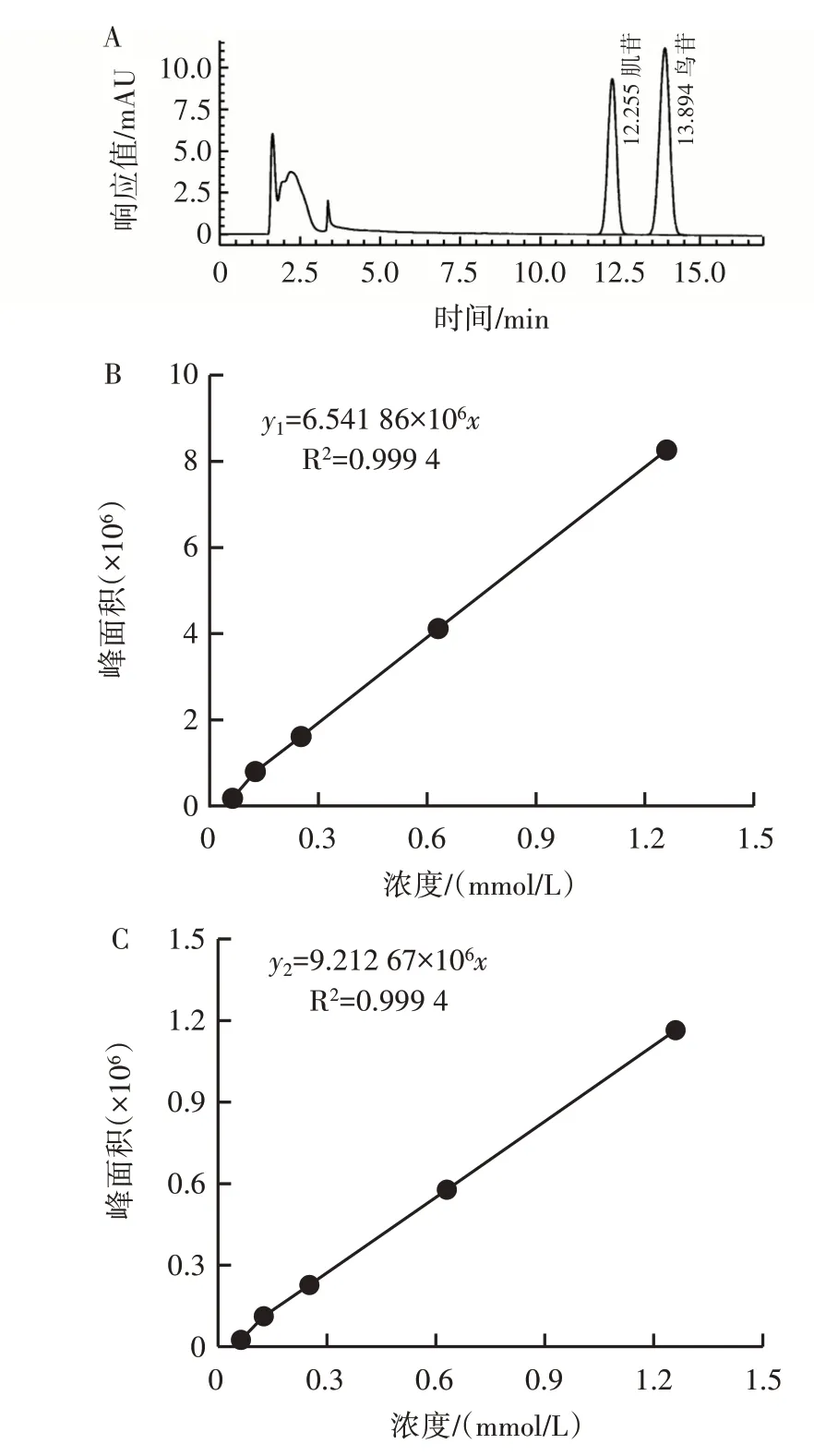
图1 鸟苷和肌苷标准品色谱图Fig.1 Chromatogram of guanosine and inosine standards
由图1 可知,肌苷在本色谱条件下的保留时间为12.255 min,鸟苷的保留时间为13.894 min。以溶液浓度(mmol/L)为横坐标,峰面积为纵坐标,绘制标准曲线,肌苷和鸟苷的方程分别为y1=6.541 86×106x,R2=0.999 4;y2=9.212 67×106x,R2=0.999 4,该色谱条件可以用于肌苷和鸟苷的测定。
2.2 高效降解核苷乳酸菌的筛选
本研究从发酵大酱以及泡菜中分离到乳酸菌共计30 株,其中有18 株对核苷的降解率可达50% 以上。菌株对肌苷和鸟苷的降解能力如表1 所示。
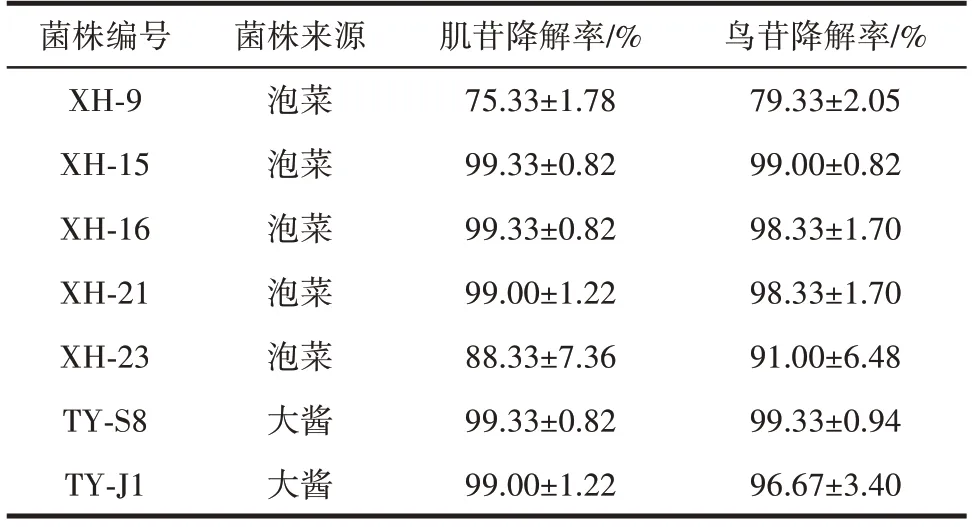
表1 菌株对肌苷和鸟苷的降解能力Table 1 Degradation of inosine and guanosine by strains
由表1 可知,泡菜中共有5 株乳酸菌株对肌苷和鸟苷的降解率达到75% 以上,而大酱中较少,仅有2 株菌株对核苷具有较高降解能力。其中XH-15、XH-16、XH-21、XH-23、TY-S8 和TY-J1 对两种核苷的降解率均能达85%以上,而菌株XH-15 和TY-S8 对核苷降解率均可高至99%。此外,试验结果发现,对肌苷具有强降解能力的菌株同样可以高效降解鸟苷。通过比较不同菌株降解核苷的效果,选择XH-15、XH-16、XH-21、XH-23、TY-S8 和TY-J1 6 株菌株进行后续试验。
2.3 乳酸菌株的鉴定
不同乳酸菌鉴定结果如表2 所示。

表2 不同乳酸菌鉴定结果Table 2 Identification of selected lactic acid bacteria
由表2 可知,泡菜中所分离得到的XH-15、XH-16和XH-21 菌株均为短乳杆菌(Levilactobacillusbrevis),仅有菌株XH-23 为植物乳杆菌(Lactobacillusplantarum),而大酱中所分离得到的TY-S8 和TY-J1 菌株均为植物乳杆菌(Lactobacillusplantarum)。
2.4 乳酸菌对XOD 的抑制活性
不同乳酸菌株对XOD 的抑制能力如图2 所示。
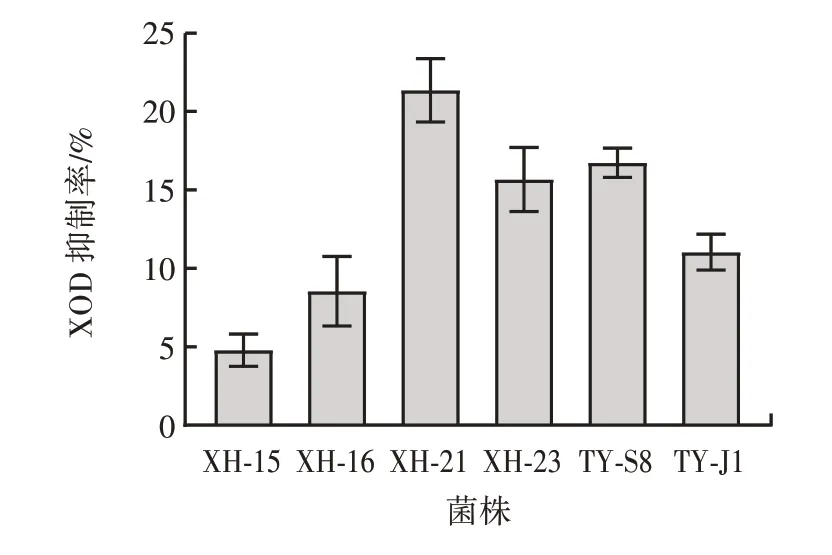
图2 不同乳酸菌株对XOD 的抑制能力Fig.2 Inhibitory capacity of different lactic acid bacteria strains on xanthine oxidase
由图2 可知,所筛选得到的6 株菌株除对核苷具有较好的降解能力,对XOD 同样具有一定的抑制作用。其中泡菜中短乳杆菌XH-21 和植物乳杆菌XH-23 两个菌株对XOD 抑制率分别高达21.35% 和15.66%;大酱中植物乳杆菌TY-S8 和TY-J1 对XOD 的抑制率高达16.73% 和11.05%,而短乳杆菌XH-15 和XH-16 的XOD 抑制率相对较低,分别为4.63% 和8.54%。可见,虽然不同菌株内容物对XOD 的抑制活性存在差异,但均具有一定的抑制能力。根据菌株对XOD 抑制活性,最终选择抑制率高于10% 的菌株即XH-21、XH-23、TY-S8 和TY-J1 进行后续试验。
2.5 乳酸菌的耐酸能力
乳酸菌要通过胃部至肠道发挥益生功能,首先要耐受胃部酸性条件。人体胃部pH 值一般在2.0~4.0范围变化。不同乳酸菌的耐酸能力如表3 所示。

表3 不同乳酸菌的耐酸能力Table 3 Acid tolerance of different lactic acid bacteria
由表3 可知,pH2.0 条件在一定程度上抑制了菌群的生长,但所有菌株的存活率均在90.00%以上,其中大酱中的植物乳杆菌TY-S8 的存活率可达96.92%,而TY-J1 存活率相对较低,为93.99%。pH 值为2.0~3.0 时,除短乳杆菌XH-21 外,其余3 个菌株活菌数随着pH 值的增加,均呈现上升趋势,且存活率均在95%以上,而菌株XH-21 的存活率降至93.22%。然而,在pH4.0 条件下,4 株菌株活菌数量均呈现不同程度下降趋势,菌株XH-21 和XH-23 存活率分别降至92.48%和91.92%,而大酱中的植物乳杆菌TY-S8 和TY-J1 存活率相对较高,分别为98.62% 和97.12%。结合菌株对核苷的降解率、对XOD 抑制作用以及耐酸能力,将大酱中植物乳杆菌TY-S8 作为优选菌株进行后续特性分析。
2.6 植物乳杆菌TY-S8 的耐胆盐能力
乳酸菌能够在肠道中发挥益生功能还依赖于其对胆盐的耐受性。植物乳杆菌TY-S8 耐胆盐能力如图3所示。

图3 植物乳杆菌TY-S8 耐胆盐能力Fig.3 Bile salt tolerance of Lactobacillus plantarum TY-S8
由图3 可知,植物乳杆菌TY-S8 在胆盐浓度为3.0 g/L 的条件下培养1 h 后,活菌数由9.21 lg(CFU/mL)下降至8.59 lg(CFU/mL),而处理3 h 后活菌数增长至9.06 lg(CFU/mL),处理5 h 后活菌数为8.88 lg(CFU/mL)。因此,胆盐处理对菌株生长具有一定影响,但菌株TYS8 在不同的处理时间内其存活率均高于90%,处理3 h 后菌株存活率可达98%。综上,植物乳杆菌TY-S8对胆盐具有一定耐受性。
2.7 植物乳杆菌TY-S8 胃肠道的耐受能力
为了进一步分析乳酸菌在消化道环境中的耐受力,本研究检测了菌株在人体胃肠液模拟环境中的存活情况。植物乳杆菌TY-S8 对胃肠液耐受能力如图4所示。

图4 植物乳杆菌TY-S8 对胃肠液耐受能力Fig.4 Tolerance of Lactobacillus plantarum TY-S8 in artificial gastrointestinal fluid
由图4 可知,植物乳杆菌TY-S8 在人工胃液中处理3 h 后活菌数可达到9.74 lg(CFU/mL),且菌株存活率可达99%;在人工肠液中处理4 h 后活菌数呈下降趋势,但仍可达到8.08 lg(CFU/mL),菌株存活率为82%。综上,植物乳杆菌TY-S8 对胃肠道环境具有一定耐受性,菌株存活率较高。
2.8 植物乳杆菌TY-S8 抗生素耐受能力
为保证植物乳杆菌TY-S8 可以在安全范围内使用,本研究对该菌株开展了药敏性试验。植物乳杆菌TY-S8 对不同抗生素的敏感性如表4 所示。

表4 植物乳杆菌TY-S8 对不同抗生素的敏感性Table 4 Sensitivity of Lactobacillus plantarum TY-S8 to different antibiotics
由表4 可知,TY-S8 对氨苄西林、红霉素以及头孢曲松具有较强敏感性,抑菌圈直径均在35.00 mm 以上,此外,对利福平、庆大霉素和四环素也具有一定敏感性。结果表明菌株对卡那霉素、链霉素、青霉素和环丙沙星不具有敏感性,其中对环丙沙星具有较强抗性,抑菌圈直径为0.00 mm。
3 讨论与结论
目前,多项研究发现益生菌对高尿酸血症具有缓解作用[15-17]。本研究以东北传统发酵大酱以及朝鲜族农家自制泡菜为原材料,对其中能够高效降解核苷的乳酸菌进行筛选和鉴定,并对其益生特性进行分析。
利用HPLC 法从两种发酵食品中共分离到18 株对核苷的降解率可达50%以上的乳酸菌,经筛选发现大酱中植物乳杆菌(Lactobacillusplantarum)TY-S8 具有潜在的降尿酸功能及良好的益生特性。核苷是尿酸形成的前体物质,而该菌株对两种核苷即肌苷和鸟苷的降解率均可达99.33%,降解效果远高于Lee 等[18]从发酵食品中所分离到的植物乳杆菌MJM60389,其对肌苷降解率仅为73%,而对鸟苷的降解率仅为82.1%;此外,Kuo 等[19]对两株植物乳杆菌即TSP05 和L-29 的核苷降解力分析发现,菌株TSP05 对肌苷和鸟苷的降解率低于60%,而菌株L-29 的降解率则低于20%。相较Cao 等[20]从发酵酸奶中分离得到的植物乳杆菌Q7对核苷的降解率虽可高达99.15%,但仍略低于本研究所分离到的植物乳杆菌TY-S8。可见,大酱中的TYS8 菌株具有较好的核苷降解效果。
XOD 是嘌呤核苷代谢途径的限速酶,也是尿酸产生过程中的关键酶[21]。王家彬等[22]研究发现,短乳杆菌LB1lac20 的活菌悬液和胞内提取物对XOD 具有良好的抑制活性,抑制率分别为21.27%和19.60%;呼静等[23]从奶豆腐中分离一株罗伊氏乳杆菌NL02,其细胞内容物对XOD 的抑制率在28.18%以上。本课题组前期从朝鲜族农家自制泡菜中分离得到一株短乳杆菌SLlac-18,其对核苷降解率虽可达97%以上,但其细胞内容物对XOD 的抑制率仅为4%[24],而本试验从大酱中分离得到的植物乳杆菌TY-S8,其对XOD 的抑制率为16.73%,远高于短乳杆菌SLlac-18,进一步证实菌株TY-S8 具有一定的降尿酸潜力。
为实现乳酸菌在胃肠道中存活并发挥益生功能,首先需确保菌株对人体消化道环境具有一定耐受力。本研究所筛选的植物乳杆菌TY-S8 在经pH2.0~4.0 酸性条件、3.0 g/L 胆盐条件以及人工胃肠液条件处理后,其活菌数均可高达6.00 lg(CFU/mL)以上,菌株存活率均在80%以上。任宇杰等[25]筛选出一株发酵乳杆菌SR2-6,在pH2.0 强酸性环境下培养4 h,活菌数降至6.48 lg(CFU/mL),存活率仅为76.51%;此外,在3.0 g/L 胆盐条件下培养5 h 后,其活菌数降至4.79 lg(CFU/mL),存活率仅为54.43%,而在饱腹肠道环境处理4 h 后,活菌数仅为6.85 lg(CFU/mL)。由此可见,大酱中植物乳杆菌TY-S8 具有较强的消化道环境耐受力。通过对该菌株进行药敏性试验发现,TY-S8 对氨苄西林、红霉素以及头孢曲松具有较强敏感性,可作为安全益生菌使用。综上,大酱中植物乳杆菌TY-S8 具有潜在的降尿酸功能和良好的益生特性,可以应用于高尿酸血症预防和辅助治疗中,具有一定应用价值。
