基于TREM2介导的炎症信号通路观察电针缓解2型糖尿病干眼大鼠眼表感觉异常的作用机制△
2024-04-12万咪咪傅张倚天何璐平孙心怡高卫萍
万咪咪 傅张倚天 何璐平 孙心怡 高卫萍
目前全球约41.5亿人患有2型糖尿病[1],其中约54.3%的患者合并干眼[2]。2型糖尿病干眼患者常表现出角膜敏感性下降的感觉异常症状[3],但临床常用抗炎滴眼液有不同程度的不良反应和局限性[4]。电针可有效改善2型糖尿病大鼠干眼[5],但其机制鲜有报道。因此,本研究探讨电针改善2型糖尿病干眼大鼠眼表感觉异常的疗效及机制,为电针治疗2型糖尿病干眼的临床应用提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
健康雄性SD大鼠,体重180~220 g[许可证号:SCXK(苏)2019-0001,南通大学],饲养于南京中医药大学附属医院基础药理实验室,自由饮食,明暗交替12 h,温度(21±2)℃,相对湿度40%~60%。动物实验符合国家实验动物福利伦理的相关规定,通过南京中医药大学附属医院伦理委员会批准(批号:2022NL-KS093)。实验方案符合中华人民共和国科技部颁布的《关于善待实验动物的指导性意见》。
1.1.2 主要试剂及仪器
链脲佐菌素(STZ,美国Sigma-Aldrich公司);1 g·L-1氟米龙滴眼液(日本参天制药株式会社);髓系细胞触发受体2(TREM2)抗体(武汉Abclonal公司);离子钙结合衔接分子1(Iba-1)抗体(武汉Servicebio公司);华佗牌SDZ-ⅡB型电针仪(苏州医疗用品有限公司);Cochet-Bonnet角膜知觉仪(法国Luneau公司);荧光定量PCR仪(杭州博日科技股份有限公司);荧光显微镜(日本Nikon公司)。
1.2 方法
1.2.1 造模及分组
40只大鼠予高糖高脂饲料、10只大鼠予普通饲料喂养。4周后,高糖高脂喂养的大鼠按30 mg·kg-1腹腔注射含10 g·L-1STZ的柠檬酸缓冲液。满足随机血糖≥16.7 mmol·L-1、泪液分泌量每20 s<7 mm、泪膜破裂时间(BUT)<5 s、角膜荧光素钠染色(FL)阳性即2型糖尿病干眼大鼠模型成功建立[6-7]。实验第12周,8只大鼠因未达标被剔除,5只大鼠死亡,最终27只大鼠造模成功(成功率67.5%,死亡率12.5%)。造模成功的大鼠随机选24只分为模型组、电针组、假针组和氟米龙组,每组6只,普通饲料喂养的大鼠随机挑选6只为空白组,其余4只剔除。
1.2.2 干预方法
干预从实验第13周开始,持续2周。电针组大鼠针刺双侧睛明、攒竹、丝竹空、太阳、瞳子髎,每侧一对电极连接攒竹和瞳子髎,电针仪采用疏密波,频率2 Hz/20 Hz,脉冲宽度0.2 ms,强度1 mA,留针15 min,每天1次[8]。假针组大鼠治疗穴位、时间同电针组,用钝头针点刺避免得气。氟米龙组大鼠每天8点、14点和17点予氟米龙滴眼液滴双眼,每次1滴。干预结束后(第14周结束)处死大鼠并取材。
1.2.3 大鼠眼表指标检测
造模前(实验第0周)、造模后(实验第12周结束)及干预后大鼠均行BUT、FL、酚红棉线试验(PRT)和角膜机械知觉(CTT)检测。BUT:角膜用荧光素钠染色后,裂隙灯观察睁眼到出现第一个干燥斑的时间。FL:裂隙灯观察角膜行荧光素钠染色后每个象限的评分并记录(0分:无染色;1分:≤30个染色点;2分:>30个染色点,染色无融合成片;3分:染色融合成片)[9]。PRT检测:将酚红棉线的末端放置在下眼睑结膜囊的外1/3处,测量20 s内棉线被浸湿的长度[10]。CTT:角膜知觉仪的尼龙丝从60 mm开始,尖端垂直轻触角膜中央,若3次中2次或以上无瞬目,则把丝缩短5 mm再次测量,直至3次中至少2次有瞬目,记录此时长度。
1.2.4 光镜观察大鼠三叉神经节和三叉神经脊核尾状核组织形态
实验第14周取材时,各组随机选取3只大鼠,经甲醛心脏固定后取三叉神经节(TG)和延髓进行脱水、包埋、切片、脱蜡至水,切片烘干后苏木精-伊红(HE)染色,光学显微镜观察TG和三叉神经脊核尾状核(SpⅤc)组织形态学的改变。
1.2.5 免疫荧光双标染色法观察大鼠TG和SpⅤc中TREM2的阳性表达部位
将模型组TG和延髓的切片抗原修复后封闭,Iba-1抗体(1:100)4 ℃孵育过夜。第2天PBS洗片后HRP标记山羊抗兔IgG(1:300)室温孵育50 min,荧光素酪胺(1:500)室温孵育10 min,TREM2抗体(1:100)4 ℃孵育过夜。第3天PBS洗片后加入山羊抗兔IgG(1:300)室温孵育50 min。封片后荧光显微镜拍照,ImageJ(v2.3.0)进行分析。
1.2.6 RT-PCR法检测大鼠TG和SpⅤc中TREM2、白细胞介素-18和白细胞介素-1β的mRNA表达
使用Trizol从TG和SpⅤc新鲜组织中提取RNA,逆转录为cDNA。将反应混合物(3.0 μL cDNA、10.0 μL 2×荧光定量预混试剂,0.5 μL正向、0.5 μL反向引物,6.0 μL无核酸酶水)变性3 min,扩增40个循环(95 ℃ 10 s和60 ℃ 60 s)。2-ΔΔCt法计算TREM2、白细胞介素-18(IL-18)和白细胞介素-1β(IL-1β)的mRNA相对表达水平。引物序列见表1。

表1 实验所用引物序列
1.3 统计学分析
2 结果
2.1 各组大鼠眼表相关指标检测结果
2.1.1 FL检测结果
造模前各组大鼠FL评分比较,差异均无统计学意义(均为P>0.05)。造模后、干预后各组大鼠FL评分比较,差异均有统计学意义(均为P<0.01)。造模后,与空白组比较,其余各组大鼠FL评分均显著升高,差异均有统计学意义(均为P<0.01);其他各组大鼠FL评分比较,差异均无统计学意义(均为P>0.05)。干预后,与空白组比较,其余各组大鼠FL评分均显著升高,差异均有统计学意义(均为P<0.01);与模型组比较,电针组及氟米龙组大鼠FL评分均显著降低,差异均有统计学意义(均为P<0.01),假针组大鼠FL评分差异无统计学意义(P>0.05);与电针组比较,假针组大鼠FL评分显著升高,差异有统计学意义(P<0.01),氟米龙组大鼠FL评分差异无统计学意义(P>0.05);与假针组比较,氟米龙组大鼠FL评分显著降低,差异有统计学意义(P<0.01)(图1A)。

注:与空白组比较,##P<0.01;与模型组比较,△△P<0.01;与电针组比较,**P<0.01;与假针组比较,▽P<0.05,▽▽P<0.01。图1 各组大鼠不同时段FL评分(A)、PRT(B)、BUT(C)、CTT(D)比较
2.1.2 PRT检测结果
造模前各组大鼠PRT比较,差异无统计学意义(P>0.05);造模后、干预后各组大鼠PRT比较,差异均有统计学意义(均为P<0.01)。造模后,与空白组比较,其余各组大鼠PRT均显著降低,差异均有统计学意义(均为P<0.01);其他各组大鼠PRT比较,差异均无统计学意义(均为P>0.05)。干预后,与空白组比较,其余各组大鼠PRT均显著降低,差异均有统计学意义(均为P<0.01);与模型组比较,电针组及氟米龙组大鼠PRT均显著升高,差异均有统计学意义(均为P<0.01),假针组大鼠PRT差异无统计学意义(P>0.05);与电针组比较,假针组和氟米龙组大鼠PRT均显著降低,差异均有统计学意义(均为P<0.01);与假针组比较,氟米龙组大鼠PRT显著升高,差异有统计学意义(P<0.01)(图1B)。
2.1.3 BUT检测结果
造模前各组大鼠BUT比较,差异无统计学意义(均为P>0.05);造模后、干预后各组大鼠BUT比较,差异均有统计学意义(均为P<0.01)。造模后,与空白组比较,其余各组大鼠BUT均显著降低,差异均有统计学意义(均为P<0.01);其他各组大鼠BUT比较,差异均无统计学意义(均为P>0.05)。干预后,与空白组比较,其余各组大鼠BUT均显著降低,差异均有统计学意义(均为P<0.01);与模型组比较,电针组及氟米龙组大鼠BUT均显著升高,差异均有统计学意义(均为P<0.01),假针组大鼠BUT差异无统计学意义(P>0.05);与电针组比较,假针组大鼠BUT显著降低,差异有统计学意义(P<0.01),氟米龙组大鼠BUT差异无统计学意义(P>0.05);与假针组比较,氟米龙组大鼠BUT显著升高,差异有统计学意义(P<0.01)(图1C)。
2.1.4 CTT检测结果
造模前各组大鼠CTT比较,差异均无统计学意义(均为P>0.05);造模后、干预后各组大鼠CTT比较,差异均有统计学意义(均为P<0.01)。造模后,与空白组比较,其余各组大鼠CTT均显著降低,差异均有统计学意义(均为P<0.01);其他各组大鼠CTT比较,差异均无统计学意义(均为P>0.05)。干预后,与空白组比较,其余各组大鼠CTT均显著降低,差异均有统计学意义(均为P<0.01);与模型组比较,电针组及氟米龙组大鼠CTT均显著升高,差异均有统计学意义(均为P<0.01),假针组大鼠CTT差异无统计学意义(P>0.05);与电针组比较,假针组和氟米龙组大鼠CTT均显著降低,差异均有统计学意义(均为P<0.01);与假针组比较,氟米龙组大鼠CTT升高,差异有统计学意义(P<0.05)(图1D)。
2.2 各组大鼠TG和SpⅤc组织形态比较
HE染色结果表明,空白组大鼠TG和SpⅤc中神经元排列规则,与空白组比较,模型组大鼠TG和SpⅤc神经元萎缩,核固缩,组织结构不连续、紊乱,其他各组大鼠TG和SpⅤc均可见不同程度神经元萎缩、细胞核固缩,神经元排列不规则。与模型组比较,电针组与氟米龙组大鼠TG和SpⅤc神经元结构显著改善,核固缩减轻,假针组大鼠神经元结构未见改善。与电针组比较,假针组、氟米龙组大鼠TG和SpⅤc均可见神经元胞质深染,核固缩。与假针组比较,氟米龙组大鼠TG和SpⅤc组织结构不连续、紊乱(图2)。
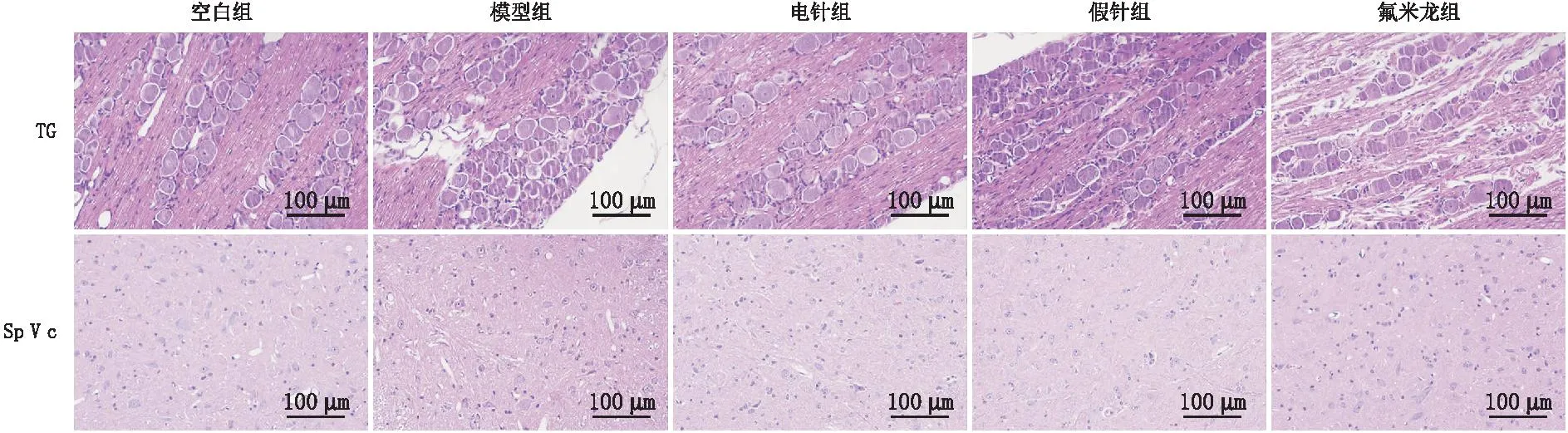
图2 各组大鼠TG和SpⅤc组织形态比较
2.3 模型组大鼠TG和SpⅤc中TREM2阳性表达位置
免疫荧光双标染色结果表明,模型组大鼠TG和SpⅤc中,TREM2和小胶质细胞标志物Iba-1存在共表达,可见TREM2在小胶质细胞上阳性表达。小胶质细胞激活状态,胞体增大、突起变短、细胞形态呈圆形或杆状(图3)。
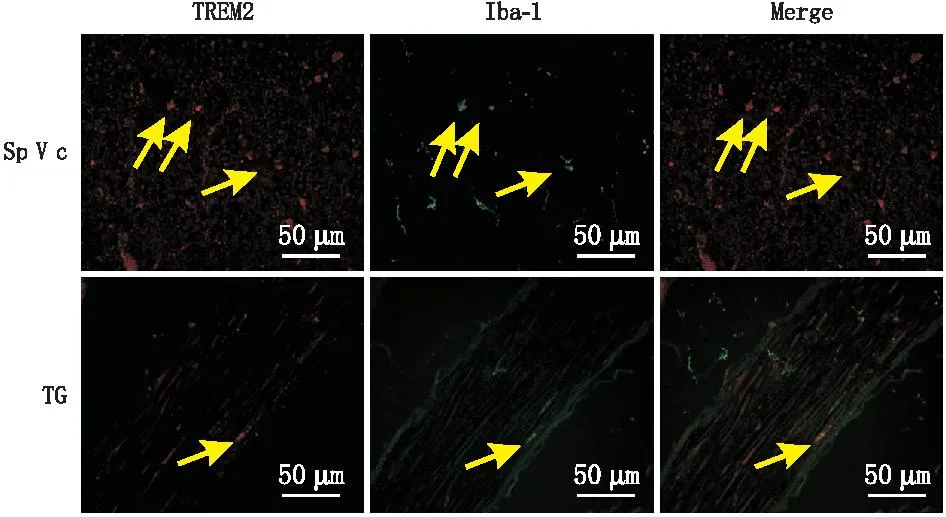
注:黄色箭头所指为TREM2与Iba-1共表达细胞。图3 模型组大鼠SpⅤc和TG中TREM2和Iba-1免疫荧光双标染色结果
2.4 各组大鼠TG和SpⅤc中TREM2、IL-1β和IL-18 mRNA表达比较
2.4.1 TG中TREM2、IL-1β和IL-18 mRNA的表达
TG的RT-PCR检测结果显示,各组大鼠TREM2、IL-1β和IL-18 mRNA表达比较,差异均有统计学意义(均为P<0.01)。与空白组比较,模型组、电针组、假针组和氟米龙组TREM2 mRNA表达均降低,模型组、假针组IL-18和IL-1β mRNA表达均增加,差异均有统计学意义(均为P<0.05);与空白组比较,电针组和氟米龙组IL-18、IL-1β mRNA表达差异均无统计学意义(均为P>0.05)。与模型组比较,电针组、氟米龙组TREM2 mRNA表达均增加,IL-1β和IL-18 mRNA表达均降低,差异均有统计学意义(均为P<0.05);与模型组比较,假针组TREM2、IL-1β和IL-18 mRNA表达差异均无统计学意义(均为P>0.05)。与电针组比较,假针组TREM2 mRNA表达降低,IL-1β和IL-18 mRNA表达均增加,差异均有统计学意义(均为P<0.05);与电针组比较,氟米龙组TREM2、IL-1β和IL-18 mRNA表达差异均无统计学意义(均为P>0.05)。与假针组比较,氟米龙组TREM2 mRNA表达增加,差异有统计学意义(P<0.05);与假针组比较,氟米龙组IL-1β和IL-18 mRNA表达差异均无统计学意义(均为P>0.05)(图4A)。

注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,△P<0.05,△△P<0.01;与电针组比较,*P<0.05,**P<0.01;与假针组比较,▽P<0.05。图4 各组大鼠TG(A)和SpⅤc(B)中TREM2、IL-1β和IL-18 mRNA表达比较
2.4.2 SpⅤc中TREM2、IL-1β和IL-18 mRNA的表达
SpⅤc的RT-PCR检测结果显示,各组大鼠TREM2、IL-1β和IL-18 mRNA表达比较,差异均有统计学意义(均为P<0.01)。与空白组比较,模型组、电针组、假针组、氟米龙组TREM2 mRNA表达均降低,模型组和假针组IL-18 mRNA、模型组IL-1β mRNA表达均增加,差异均有统计学意义(均为P<0.05);与空白组比较,电针组、氟米龙组IL-18、IL-1β mRNA表达差异均无统计学意义(均为P>0.05)。与模型组比较,电针组、氟米龙组TREM2 mRNA表达均增加,IL-18和IL-1β mRNA的表达均降低,假针组IL-18 mRNA表达降低,差异均有统计学意义(均为P<0.05),假针组TREM2、IL-1β mRNA表达差异均无统计学意义(均为P>0.05)。与电针组比较,假针组TREM2 mRNA表达均降低、IL-18和IL-1β mRNA表达均增加,差异均有统计学意义(均为P<0.05);与电针组比较,氟米龙组TREM2、IL-1β和IL-18 mRNA表达差异均无统计学意义(均为P>0.05)。与假针组比较,氟米龙组TREM2 mRNA表达增加,IL-18 mRNA表达降低,差异均有统计学意义(均为P<0.05);与假针组比较,氟米龙组IL-1β mRNA表达差异无统计学意义(P>0.05)(图4B)。
3 讨论
2017年TFOS DEWSⅡ和2020年中国干眼专家共识均指出,糖尿病是导致干眼的一个重要病因和危险因素。糖尿病干眼常表现出眼表感觉异常症状,这与三叉神经传导通路损伤有关[11],而炎症与损伤密不可分[12]。目前临床上治疗糖尿病干眼的常用抗炎药物为非甾体抗炎药和糖皮质激素。非甾体抗炎药滴眼被报道存在刺痛感、结膜充血、角膜上皮损伤等不良反应[13]。糖皮质激素抗炎效果显著,但是眼压升高、诱发白内障等副作用也限制了其用药周期[14]。电针治疗干眼具有良好的抗炎作用,可有效减轻角膜上皮炎性损伤,降低泪腺炎症反应[15],其因安全、有效的优势获得临床医师的青睐。
本研究发现,电针可以有效增加2型糖尿病干眼大鼠泪液分泌量及BUT,减少角膜损伤,这与Yang等[15]基于电针治疗干眼兔的研究结果类似。因此,电针对干眼及2型糖尿病干眼都有确切的治疗效果。本研究还观察了电针对2型糖尿病干眼大鼠CTT的影响,发现电针可以有效改善角膜知觉,这与Jin等[8]电针治疗干眼豚鼠的研究结果一致。眼表刺激的感知首先通过角膜上的感觉神经末梢接收信号,传递至TG的初级神经元,最终投射至SpⅤc的次级神经元和大脑皮层的感觉区。因此,上述三叉神经传导通路的炎性损伤严重影响着感觉信号的传递,最终导致眼表感觉异常[16]。
小胶质细胞被认为是神经系统的免疫屏障,介导了炎症的产生[17]。与本研究的发现一样,Zhao等[18]从干眼及糖尿病动物模型上也观察到小胶质细胞活化状态,是神经炎症激活的表现[19]。本研究中,TREM2在TG和SpⅤc小胶质细胞中表达,在TG和SpⅤc中TREM2呈低表达,下游IL-1β和IL-18呈高表达,这与Byambajav等[20]、Johanna等[21]在糖尿病干眼患者或模型动物的泪液、睑板腺发现炎症表达的结果一致,可见小胶质细胞中TREM2介导的炎症可能参与了糖尿病干眼的发病。高血糖状态下脂多糖释放增加,作用于眼表感觉传导神经,抑制小胶质细胞上TREM2的表达,并促进下游炎症的释放,导致神经损伤[22]。本研究发现电针可以提高TREM2,抑制IL-1β和IL-18的表达,其抗炎效果与Zhang等[23]所报道的一致。这也许与电针抑制小胶质细胞活化,上调TREM2表达,抑制下游炎症释放,从而改善神经炎症的作用机制有关[24]。
本研究中的阳性对照药物氟米龙滴眼液作为糖皮质激素药物,和电针在提高TREM2的表达并抑制炎症方面有类似的效果,但电针还可促进泪液分泌量,这是氟米龙滴眼液不具备的,且电针对改善角膜知觉的作用明显优于氟米龙滴眼液,在治疗眼表感觉异常方面更具优势。希望未来能使用睫状神经纤维电活动、角膜活体共聚焦显微镜等手段对神经形态、电生理做更直观的定量及分析,为电针如何治疗2型糖尿病干眼眼表感觉异常提供更确切的依据。
4 结论
本研究发现,电针能有效缓解2型糖尿病干眼模型大鼠的眼表感觉异常症状,其机制可能是通过调控TG和SpⅤc小胶质细胞中TREM2所介导的炎症通路所实现的。希望本研究能为制定电针治疗糖尿病干眼临床方案提供科学依据,推动电针治疗糖尿病干眼的医学转化。
