基于虚拟筛选-分子对接-活性评价技术探讨四逆汤抗抑郁的药效物质基础*
2024-04-12赵若岚董盛宋亚刚权伟马善波
赵若岚,董盛,宋亚刚,权伟,马善波
1.陕西中医药大学第一临床医学院,陕西 咸阳 712046; 2.河南中医药大学,河南 郑州 450046;3.空军军医大学第一附属医院,陕西 西安 710032
抑郁症属于中医“郁证”范畴,郁证主要是由情志不舒、气机郁滞引起的,以心情抑郁、情绪不宁、胸部满闷或易怒易哭等为主要表现[1]。名老中医李可辨治郁证,从中医阴阳观出发,运用《伤寒杂病论》经典方剂四逆汤,形成系统的治疗方案。四逆汤由甘草(炙)、干姜、附子(生用,去皮)三味药组成,基于此方,逐日增加附子用量,即可有效缓解抑郁症状[2-3],但其药效物质基础和作用机制尚不清楚。
中药药效物质是指能够反映中药临床疗效的化学成分群。这些成分是中药在进入机体后,作用于多个靶点并产生整体治疗效果的化学组分[4]。虚拟筛选和分子对接技术能够将已知的小分子活性物质与相关靶蛋白进行对接,从而在分子层面阐明中药效应成分与靶标之间的作用机制。目前,这项技术在揭示中药药效物质基础与心血管疾病、癌症等众多疾病的病理机制方面都发挥重要作用[5]。
药物靶点是药物发挥治疗作用的生物大分子,其中蛋白质是最重要的药物靶点[6]。目前,临床上使用的抗抑郁药物主要是基于“单胺神经递质假说”而研发,包括选择性5-羟色胺(5-hydroxytryptamine,5-HT)再摄取抑制剂、选择性去甲肾上腺素(norepinephrine,NA)再摄取抑制剂、选择性NA/5-HT再摄取抑制剂以及单胺氧化酶抑制剂(monoamine oxidase inhibitor,MAOI)等[7]。这些靶点不仅是抗抑郁药物的“可成药”靶点,也是研究相对成熟的靶点。中药作用靶点的发现对于阐明中药的作用机制具有重要意义。
因此,本研究首先检索四逆汤的化学成分,并结合类药五原则、口服生物利用度等参数进行筛选。然后,采用Discovery StudioTM2016软件,对化合物与抗抑郁药物作用靶点进行分子对接,探索两者的亲和力与结合模式。最后,采用小鼠海马神经元细胞系HT22细胞和小鼠抑郁模型,观察四逆汤活性成分的抗抑郁作用,初步阐明四逆汤抗抑郁的药效物质基础。
1 材料
1.1 动物清洁级健康C57BL/6雄性小鼠,体质量(20±1) g,购自陕西中医药大学实验动物中心,实验动物生产许可证号:SCXK(陕)2021-001,实验动物使用许可证号:SYXK(陕)2021-001。本实验经陕西中医药大学实验动物伦理委员会批准,伦理审批编号:SUCMDL20230620003。
1.2 细胞小鼠海马神经元HT22细胞,购自武汉梓杉生物技术有限公司,货号:STCC20011P。
1.4 仪器悬尾实验测试仪、强迫游泳实验测试仪(上海欣软信息科技有限公司,型号:XR-XX203、XR-XQ202);CO2细胞培养箱(上海一恒科学仪器有限公司,型号:BPN-80CRH);荧光显微镜(OLYMPUS 光学技术公司,型号:BX53M)。
2 方法
2.1 四逆汤抗抑郁的关键活性成分筛选
2.1.1 四逆汤活性成分筛选通过中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(https://old.tcmsp-e.com/tcmsp.php)[8]检索四逆汤三味中药(甘草、干姜、附子)的活性成分。根据类药五原则及相关条件进行二次筛选:(1)分子量<500;(2)脂水分配系数<5;(3)氢键给体数目<5;(4)氢键受体数目<10;(5)口服生物利用度>50%;(6)类药性>0.18,最终得到的化合物以mol2的格式保存备用。
2.1.2 抑郁症作用靶点筛选通过RCSB PDB数据库(http://www.rcsb.org/)[9]检索抑郁症相关靶点,分别以“serotonin transporter 5i71”“dopamine transporter 4m48”“monoamine oxidase A 2z5x”“histamine receptor H1 3rze”作为关键词,检查相应的靶蛋白并下载pdb格式的文件。
2.1.3 分子对接与关键活性成分筛选采用Discovery StudioTM2016分子对接软件,对靶蛋白进行预处理,将其作为受体分子;将四逆汤活性成分作为配体分子,设置配体所在位置为活性中心。将受体与配体进行分子对接,即可观察受体蛋白氨基酸残基与配体对接间的非键相互作用力,也可生成配体-蛋白相互作用的二维平面图,从而直观观察两者的相互作用及关键的氨基酸基团。同时,计算对接的Cdocker Energy,包含配体分子内能、与受体的相互作用能。为了避免高得分化合物的屏蔽作用,减少假阴性化合物的产生,选取与靶蛋白的亲和数、亲和力排名前15位的化合物作为关键活性成分。
(1)上消化道出血相关知识的掌握情况:采用自制调查表,了解干预前后两组患者对上消化道出血相关知识的掌握程度。共25题,每题4分,总分100分,得分≥90分,掌握程度为优;70~89分,掌握程度为中;<70分,掌握程度为差;(2)对两组患者的生活质量状况采用生活质量调查量表[5]进行评价,该量表共35个条目,分为日常生活能力、社会活动能力、焦虑心理状态、抑郁心理状态4个维度,每个条目1~4分,总分范围35~140分,总分越高意味着个体的生活质量越低。入院护理查体时和出院前进行出院指导时,以同样的方法和量表调查两组患者的生活质量状况。
2.2 四逆汤活性成分抗抑郁的实验研究
2.2.1 细胞实验
2.2.1.1 药物制备精密称取(R)-去甲乌头碱、甘草素、山柰酚及皮质酮适量,分别加入含10%胎牛血清的DMEM培养基,配置浓度为1 mol·L-1的药液。
2.2.1.2 HT22细胞培养HT22细胞采用含10%胎牛血清的DMEM培养基,在37 ℃、5%CO2的培养箱中培养。取对数期生长的细胞,以1×105mL-1的密度接种至24孔板,培养过夜后细胞贴壁生长,待细胞密度达到70%时,分为空白组、模型组、(R)-去甲乌头碱组、甘草素组和山柰酚组。除空白组外,其余各组细胞先加入皮质酮200 μL培养24 h,建立体外抑郁模型[10],随后加入相应药物100 μL干预 24 h,光学显微镜下观察各组细胞形态并拍照。
2.2.1.3 TUNEL染色观察细胞凋亡情况采用TUNEL试剂盒检测细胞凋亡情况,按照试剂盒说明书进行操作。收集HT22细胞,4%冷乙醇固定细胞30 min,洗涤后对细胞进行蛋白酶消化,以去除背景蛋白质干扰。将配置好的TUNEL溶液滴加到细胞上,反应1 h,加入终止液停止反应,倒置荧光显微镜下观察并拍照。
2.2.2 动物实验
2.2.2.1 药物制备精密称取(R)-去甲乌头碱、甘草素、山柰酚适量,分别加入生理盐水配成质量浓度为1 g·L-1、1.5 g·L-1、2 g·L-1的药液。
2.2.2.2 小鼠抑郁模型建立40只小鼠随机分为空白组、模型组、(R)-去甲乌头碱组(10 mg·kg-1)、甘草素组(15 mg·kg-1)、山柰酚组(20 mg·kg-1),每组8只。除空白组外,其余各组小鼠采用慢性不可预见性温和应激(chronic unpredictable mild stress,CUMS)结合孤养的方式建立抑郁模型。刺激因素包括:热水游泳5 min(45 ℃),夹尾5 min,冷水游泳5 min(6 ℃),人工水平震荡5 min,夜间强光照射 5 min,禁食24 h,禁水24 h。每天随机选取1种应激源,连续28 d[11]。造模首日开始给药,每日1次,空白组和模型组给予等体积生理盐水灌胃。
2.2.2.3 行为学检测方法(1)强迫游泳实验(forced swimming test,FST):将小鼠放入盛水的透明玻璃桶中,水温(22±1)℃,水深12 cm。通过高清数码摄像机记录小鼠6 min内的活动情况,然后采用双盲法计算第2—6 min小鼠不动行为的时间。不动行为的判断标准为:小鼠停止挣扎,呈漂浮直立状态,仅有偶而的肢体运动以保持头部浮在水面,身体无屈曲或扭动[12]。(2)悬尾实验(tail suspension test,TST):使用胶带固定小鼠尾巴,固定位置距离尾尖大约1 cm;悬挂小鼠,头部距离桌面约10 cm;高清数码摄像机采集图像,采用双盲法分析小鼠在6 min内的不动时间[13]。(3)糖水偏爱实验(sucrose preference test,SPT):末次灌胃后,小鼠禁食禁水24 h,每笼放置1%糖水和普通饮用水,为了避免小鼠产生位置偏好,每1 h交换水瓶位置,2 h后取下水瓶并称重,计算糖水偏爱度[14]。
糖水偏爱度 =糖水消耗量(g)/[糖水消耗量(g)+普通水消耗量(g)]×100%

3 结果
3.1 四逆汤抗抑郁的关键活性成分筛选
3.1.1 四逆汤活性成分与抑郁症靶点通过TCMSP数据库获取四逆汤活性成分493个,其中干姜148个,甘草280个,附子65个。根据类药五原则及相关条件筛选得到91个化合物,占总化合物的18.5%。通过RCSB PDB数据库检索得到抑郁症作用靶点4个,即单胺氧化酶A(monoamine oxidase A,MAO-A)、多巴胺转运体(dopamine transporter,DAT)、5-羟色胺转运体(serotonin transporter,SERT)、组胺H1受体(histamine H1 receptor,H1R)。
3.1.2 四逆汤抗抑郁症的关键活性成分通过Discovery StudioTM2016对91个活性成分与4个靶点进行分子对接,筛选出15个关键活性成分,包括(R)-去甲乌头碱、山柰酚、甘草素、甘草黄酮醇等,见表1。

表1 四逆汤抗抑郁的关键活性成分信息
3.1.3 关键活性成分与4个靶点的亲和力将15个关键活性成分与4个靶点进行分子对接,取Cdocker Energy排名前10位的结果予以展示,见表2。其中,MAO-A与(R)-去甲乌头碱、甘草黄酮醇A、山柰酚的亲和力最强;DAT与甘草素、异甘草素、(R)-去甲乌头碱的亲和力最强;H1R与山柰酚、甘草素、异甘草素的亲和力最强;SERT与(R)-去甲乌头碱、甘草黄酮醇A、山柰酚的亲和力最强。
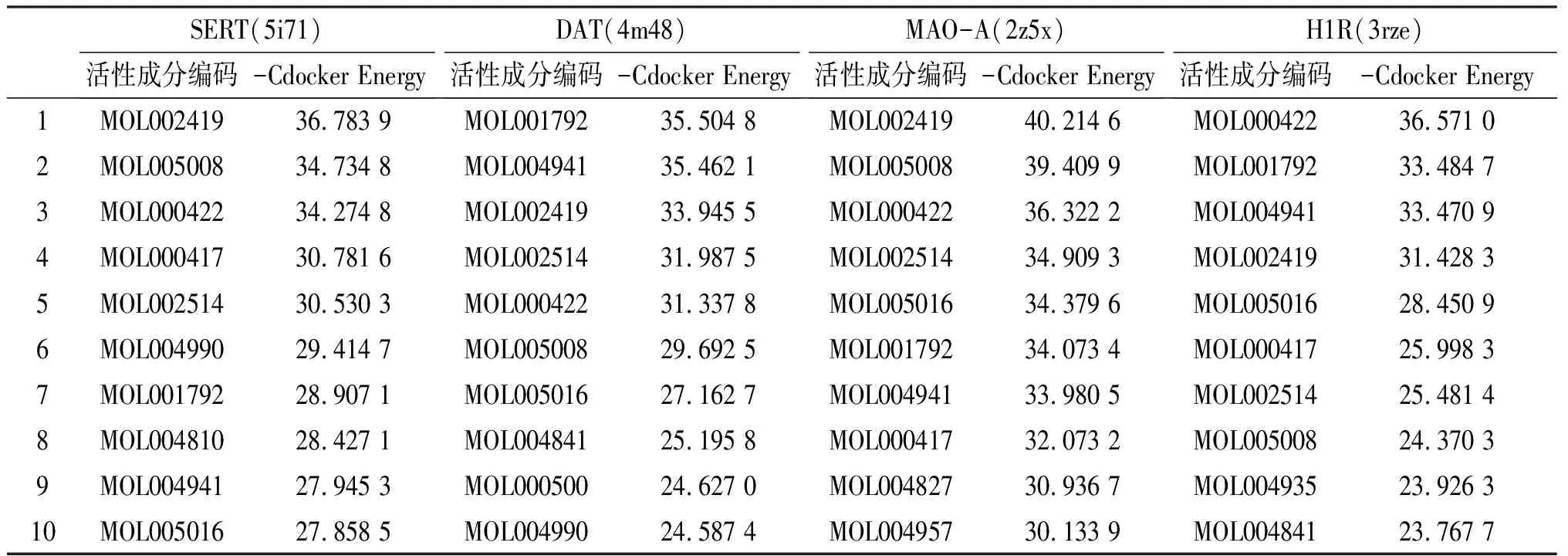
表2 分子对接结合能 (kcal·mol-1)
3.1.4 四逆汤关键成分与抑郁症靶点的结合模式选取与每个靶点亲和力最强的化合物,绘制活性成分与靶点结合图,可直观观察两者的结合模式以及与周围氨基酸残基的相互作用。SERT的活性空腔主要由Ile172、Ala173、Tyr176、Phe341、Phe335、Gly338、Ser438、Leu443等组成,(R)-去甲乌头碱占据了SERT的活性空腔,且与Phe335、Gly338、Ser438存在较好的疏水作用,与Ile172、Ala173、Phe341、Leu443存在较好的π-π共轭。(R)-去甲乌头碱占据了由残基Gly67、Asn180、Asn181、Gln215、Ile335、Tyr407和Met445形成的MAO-A活性空腔,其氨基与Asn181形成一个氢键,其环状结构与Tyr407形成π-π堆积作用。DAT的活性空腔Ala44、Asp121、Ser320、Ser422、Ser421均为疏水残基,推测疏水作用是甘草素与DAT结合的主要推动作用。另外,Val120存在疏水作用,且与Tyr431、Phe432存在T型的π-π堆积作用,见图1。

注:A:SERT与(R)-去甲乌头碱;B:MAO-A与(R)-去甲乌头碱;C:DAT与甘草素;D:H1R与山柰酚。
3.2 四逆汤活性成分的抗抑郁作用
3.2.1 (R)-去甲乌头碱、甘草素及山柰酚对HT22细胞形态的影响空白组细胞光泽度好,突起交错分布且相互连接,有较为明显的突起相连形态。模型组细胞光泽度较差,突起连接部分断裂消失,可见细胞变圆皱缩。与模型组比较,(R)-去甲乌头碱组细胞形态皱缩减轻,分布较为规则,有一定的突起连接形态;甘草素组细胞光泽度较好,形态皱缩减轻,存在突起相连形态;山柰酚组细胞形态皱缩减轻,存在突起连接形态,见图2。

注:A:空白组;B:模型组;C:(R)-去甲乌头碱组;D:甘草素组;E:山柰酚组。
3.2.2 (R)-去甲乌头碱、甘草素及山柰酚对HT22细胞凋亡的影响空白组基本未见细胞凋亡;与空白组比较,模型组细胞凋亡增加;与模型组比较,(R)-去甲乌头碱组、甘草素组及山柰酚组细胞凋亡减少,见图3。

注:A:空白组;B:模型组;C:(R)-去甲乌头碱组;D:甘草素组;E:山柰酚组。
3.2.3 (R)-去甲乌头碱、甘草素及山柰酚对CUMS小鼠行为学的影响与空白组比较,模型组小鼠糖水偏爱度降低(P<0.05);与模型组比较,(R)-去甲乌头碱组小鼠糖水偏爱度升高(P<0.05)。与空白组比较,模型组小鼠不动时间(TST和FST)均增加(P<0.05);与模型组比较,甘草素组小鼠TST不动时间减少(P<0.05),(R)-去甲乌头碱组、甘草素组小鼠FST不动时间减少(P<0.05),见图4。

注:A:糖水偏爱度;B:TST不动时间;C:FST不动时间;与空白组比较,#P<0.05;与模型组比较,*P<0.05。
4 讨论
名老中医李可将《伤寒杂病论》的六经辨证思想应用于临床遣方用药,尤善附子、乌头等峻药治疗危重患者。四逆汤是张仲景治疗心肾阳衰寒厥证的代表方剂,李可临床应用四逆汤不限于少阴病,还将其用于抑郁症、咳喘、足心发热等病[15]。本研究采用“虚拟筛选-分子对接-活性评价”的中药新药发现与评价新模式,深入挖掘四逆汤的药效物质基础,为该方的二次开发提供思路,这也是中药现代化研究的一个重要方向。
本研究发现四逆汤抗抑郁的15个关键活性成分,包括(R)-去甲乌头碱、山柰酚、甘草素、甘草黄酮醇A、3,4,5,7-四羟基-8-甲氧基黄酮、异甘草素等。这些化合物富含黄酮类成分,已有文献报道黄酮类化合物具有抗抑郁作用[16]。研究表明,山柰酚具有抗癌、抗癫痫、抗炎、抗氧化等作用[17]。王佳等[18]研究发现,山柰酚具有抗大鼠抑郁的作用,能提高抑郁大鼠脑内NA、多巴胺、5-HT水平,与本研究的虚拟筛选结果一致。(R)-去甲乌头碱是一种含氮原子的杂环化合物,广泛存在于药用植物中,具有多种药理活性,如抗炎、扩张血管、抗心律失常等[19]。本研究发现,(R)-去甲乌头碱与MAO-A、SERT具有较强的亲和力,可能是四逆汤抗抑郁的药效物质之一。此外,本研究发现甘草素与DAT、H1R具有很强的亲和力,甘草素或有可能开发成为具有抗抑郁活性的先导化合物。因此,四逆汤的活性成分可能通过抑制DA等神经递质代谢、减少5-HT摄取、抑制H1R活性等机制发挥抗抑郁作用。
分子对接结果表明,(R)-去甲乌头碱占据SERT的活性空腔,与Ile172、Ala173、Phe341、Leu443存在较好的π-π共轭。Henry等[20]通过定点突变实验发现,Ile172是SERT的关键残基,与本研究结果相符。(R)-去甲乌头碱占据MAO-A的活性空腔,其氨基与Asn181形成氢键,环状结构与Tyr407形成π-π堆积作用。Upadhyay等[21]研究表明,与Asn181、Tyr407的相互作用是决定化合物能否与MAO-A活性中心结合的关键,这与本研究的结果一致。另外,肉叶芸香碱与Tyr407也存在π-π堆积作用,这表明Tyr407可能是影响化合物与MAO-A结合的关键残基之一。DAT的活性空腔组成均为疏水残基,且与Val120存在较好的π-π共轭。Penmatsa等[22]研究表明,与Val120的相互作用是抗抑郁活性的关键。山柰酚的3号、7号、1号氧原子与Ser111、Thr194、Tyr431形成氢键,环状结构与Tyr108、Trp428、Phe432、Phe435、Ile454存在疏水作用,且与Tyr431、Phe432存在T型π-π堆积作用。Heifetz等[23]研究表明,Asp107、Tyr108、Ser111、Thr112、Phe432、Tyr458是H1R与化合物作用的关键残基。
分子对接技术尚存在诸多缺陷和局限性,其结果不能取代实验数据,在很多情况下需要结合其它方法加以验证[24]。本研究采用皮质酮刺激HT22细胞模拟体外抑郁状态,发现(R)-去甲乌头碱、甘草素及山柰酚能够有效保护皮质酮刺激下的HT22细胞。CUMS模型具有良好的抑郁症表面效度、结构效度和预测效度,主要模拟抑郁症的快感缺失症状。这种症状在造模成功后可持续数周,并被抗抑郁药物逆转[25]。本研究发现,(R)-去甲乌头碱、甘草素及山柰酚可有效缓解抑郁模型大鼠的抑郁情绪和绝望情绪。
综上所述,本研究采用中药新药发现与评价的新模式“虚拟筛选-分子对接-活性评价”,深入挖掘四逆汤抗抑郁的物质基础主要为(R)-去甲乌头碱、甘草素及山柰酚,为四逆汤的二次开发奠定基础。
