脓毒症的宿主反应标志物研究进展*
2024-04-12综述审校
康 萌 综述,曹 炬 审校
重庆医科大学附属第一医院检验科,重庆 400016
脓毒症被定义为机体对感染的反应失调而导致的威胁生命的器官功能障碍[1]。据统计,与脓毒症相关的死亡占全球总死亡人数的20%,脓毒症是危重症患者死亡的重要原因[2]。早期识别脓毒症及其严重程度,选择有针对性的治疗对提高脓毒症的生存率非常重要。然而,目前没有诊断脓毒症的金标准,传统的血培养方法通常需要大量时间,可能导致治疗延迟。生物标志物是一种可以快速测量的生物观测方法,可以帮助早期诊断脓毒症,评估脓毒症的严重程度和风险分层,指导治疗,并评估患者对治疗的反应[3]。目前,许多生物标志物已被证明有助于脓毒症的诊断、预后和治疗。本文旨在介绍脓毒症宿主反应生物标志物的研究进展。
1 脓毒症诊断生物标志物
除了广泛使用和研究的指标C反应蛋白(CRP)和降钙素原(PCT)之外,目前所发现的脓毒症诊断标志物中,有在超过300例患者的研究中评估了其诊断价值的标志物有10个,其中仅有3个生物标志物[α间抑制蛋白(IαI)、CD64、白细胞介素-6(IL-6)]经受试者工作特征(ROC)曲线评估显示有较高的诊断价值[4]。以下介绍对脓毒症诊断价值较高的宿主反应标志物见表1。

表1 脓毒症诊断生物标志物
1.1CRP CRP是一种急性期蛋白,其水平在炎症早期增加[17]。2019年的一项meta分析显示,CRP在脓毒症诊断中的总体受试者工作特征(SROC)曲线的AUC为0.73(95%CI:0.69~0.77),灵敏度和特异度分别为0.80(95%CI:0.63~0.90)和0.61(95%CI:0.50~0.72)[5]。这表明CRP对于诊断脓毒血症具有较高的灵敏度,但特异度较低。2023年的一项回顾性观察试验肯定了CRP的诊断价值,结果显示,CRP诊断脓毒症的AUC为0.816(95%CI:0.744~0.887),高于PCT及IL-6[6]。但是该结果与文献[5]的结论存在一定差异,需要进一步的验证。
1.2PCT PCT是目前美国食品和药物管理局(FDA)唯一批准用于脓毒血症诊断的生物标志物[18]。与CRP相比,PCT在脓毒症诊断中的SROC曲线的AUC为0.85(95%CI:0.82~0.88),其灵敏度和特异度分别为0.80(95%CI:0.69~0.87)和0.77(95%CI:0.60~0.88)[5],PCT在诊断脓毒症方面更具特异性,但PCT在许多非感染性疾病中也可能升高,这限制了其用于脓毒症的诊断价值。尽管如此,有研究指出细菌性脓毒血症患者的血清PCT水平显著高于无症状且不伴脓毒症的细菌感染者,特别是当血清PCT≥4.25 ng/mL时,血清PCT可作为序贯性器官功能衰竭(SOFA)评分的替代指标,对于快速筛查脓毒症具有一定帮助[7]。
1.3IαI IαI是一类抗炎相关蛋白,CHAABAN等[8]在2008年指出,IαI对新生儿脓毒症的诊断有极高的价值,其诊断新生儿脓毒症的AUC达0.94。脓毒症会导致全身炎症反应,也会引起患者血管内皮细胞损伤,有研究发现,在人类脓毒症患者中,血液IαI水平与血管细胞黏附分子1(VCAM-1)和细胞间黏附分子-1(ICAM-1)水平呈负相关,而VCAM-1和ICAM-1水平升高可反映内皮炎症的发生[11],提示IαI水平降低或许可以反映脓毒症的发生。近几年较少出现相关的文章验证IαI是否能够有效辨别成人脓毒症,但由于其在诊断新生儿脓毒症存在较高的价值,这一问题值得更多的研究去验证。
1.4CD64 CD64是一种高亲和力受体,感染时会被激活并上调。2021年的一项meta分析对比了nCD64、PCT及IL-6在诊断脓毒症中的效能,结果显示nCD64对脓毒症的诊断价值最高,其次是PCT和IL-6[9],表明nCD64具有诊断脓毒症的潜力。2023年的一项横断面研究显示,nCD64诊断脓毒证的AUC为0.920,高于PCT的0.872、WBC的0.637、nCD64联合WBC的0.906、nCD64联合WBC和PCT的0.919,低于nCD64联合PCT的0.924,表明nCD64可作为ICU患者脓毒症诊断的标志物,且其与PCT联合使用,对脓毒症的诊断效果更好[10]。以上研究显示,CD64对于脓毒症的诊断价值较高,但目前还尚缺乏关于CD64诊断脓毒症的多中心研究,需要更多的大型研究去验证CD64的诊断价值。
1.5IL-6 IL-6是一种介导免疫系统对损伤和感染的炎症细胞因子[19]。有研究收集确诊为脓毒症或感染性休克等患者在临床诊断后6 h内的血样,测量血清IL-6、PTX3和PCT水平,结果显示,IL-6诊断脓毒症的AUC为0.83~0.94(P<0.001),大于PTX3及PCT[19]。同时,一项近期的历史队列研究结果显示IL-6能很好地区分血流感染及局部细菌感染(P<0.05)[12],其对于诊断脓毒症具有一定的意义。
1.6presepsin presepsin是CD14的可溶性N末端片段,可以刺激先天免疫应答[20]。presepsin水平在细菌感染后2 h内增加,是检测感染和诊断脓毒症的有前途的早期指标[21]。2022年的一项系统评价指出presepsin是新生儿早发性脓毒症(EOS)的准确生物标志物[18]。在纳入的研究中有10项研究报道了presepsin诊断脓毒症的AUC为0.76~0.99,其合并灵敏度和特异度分别为0.93(95%CI:0.89~0.96)和0.91(95%CI:0.85~0.95),合并诊断比值比(DOR)为 131.69(95%CI:54.93~310.94)[13]。同时,也有学者纳入了40项研究进行meta分析,结果显示在诊断脓毒症方面,presepsin的AUC为0.90(95%CI:0.87~0.92),具有较高的准确性[14]。
1.7其他生物标志物 suPAR能识别是否发生感染,这能够帮助临床区分脓毒症与SIRS。2020年的一项系统评价显示,与既往meta分析确定的PCT对于脓毒症的诊断特异度的70%相比,suPAR对于诊断脓毒症具有更高的特异度(78%)[15]。因此,suPAR在脓毒症诊断中或许具有较高的潜力。
2021年一项包括11项研究的meta分析表明,MR-proADM在脓毒症诊断中具有很高的灵敏度和特异度[16],提示它是诊断脓毒症的优秀生物标志物。2023年的一项系统评价也验证了这一结论[14]。但目前可用的数据较少,需要进一步研究以验证该结论。
2 预后生物标志物
脓毒症病死率极高,早期预测脓毒症患者的死亡风险,从而更有针对性地分诊对于降低脓毒症病死率有一定帮助。在脓毒症预后方面有积极作用的宿主反应标志物也有很多,一些较有应用前途的生物标志物见表2。
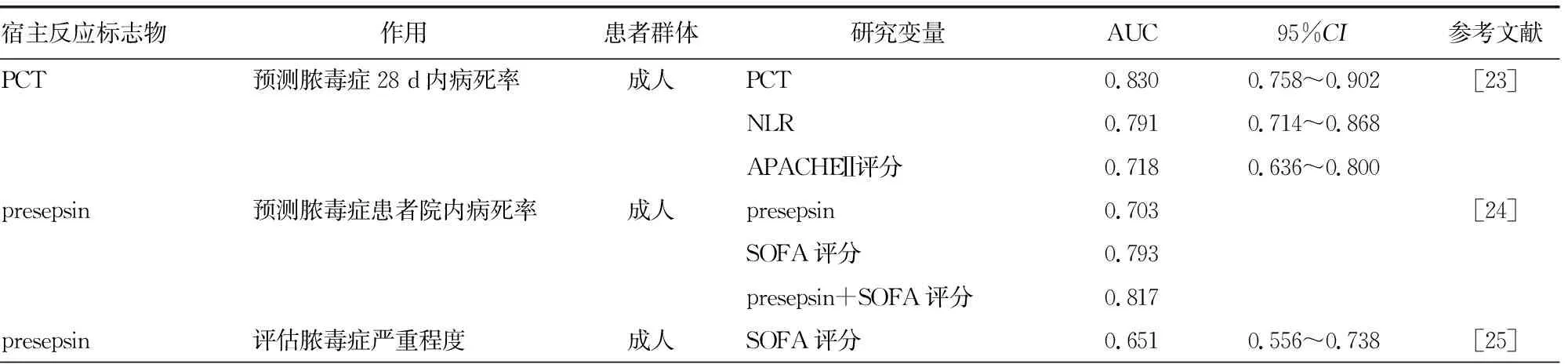
表2 脓毒症预后生物标志物
2.1PCT 通过连续测量入住ICU后5 d内的PCT水平发现PCT水平较第1天的测量值降低80%及以上的患者,将会大大改善其生存率,并COX回归分析证实,无法将降钙素原降低 80% 以上是脓毒症死亡的重要独立预测指标[22]。此外,血清PCT、CRP与急性生理学与慢性健康状况评分(APACHEⅡ)评分均呈正相关,APACHEⅡ评分是血流感染脓毒症28 d内死亡的独立危险因素,这说明血流CRP与PCT的水平均能反映脓毒症的不良预后[23];通过Pearson相关性分析发现,CRP和PCT水平与疾病严重程度呈正相关(r=0.456、0.670,均P<0.001),且较高的PCT往往代表较高的脓毒症病死率,CRP和PCT是预测血流感染脓毒症28 d内死亡的独立危险因素[23]。
2.2presepsin presepsin不仅可以用于诊断脓毒症,还可以用于分层脓毒症患者的预后。一项研究显示,presepsin水平与SOFA评分呈正相关(r=0.396,P<0.001),ROC曲线分析表明,presepsin水平对脓毒症患者不良结局具有较高的预测准确性[24]。2020年一项单中心前瞻性研究显示,脓毒症患者的presepsin水平显著升高(2 047 ng/mL),脓毒性休克患者的水平更高(2 538 ng/mL),非幸存者的水平最高(3 138 ng/mL),差异均有统计学意义(P<0.001);presepsin对脓毒症的死亡风险(AUC=0.861,95%CI:0.784~0.919)有较高的预测价值[25]。MIN等[26]的研究验证了presepsin作为脓毒症预后指标的价值,结果显示,presepsin预测脓毒症导致死亡的AUC为0.764,WBC为0.744;血清presepsin对脓毒症死亡预测的灵敏度和特异度分别为75.0%和87.5%,对脓毒症的预测准确性较高。presepsin对于脓毒症的死亡风险预测价值较高,但在不同的研究中AUC相差较大,或许需要多中心、大规模的研究验证presepsin的预后价值。
2.3IL-6 2013年的一项研究使用结扎盲肠和穿刺(CLP)诱导小鼠脓毒症的模型确认了IL-6对于脓毒症的预后价值[31]。2019年的一项前瞻性对照研究比较了IL-6、PTX3和PCT在预测脓毒症不良结果方面的价值,发现IL-6能更好地鉴别更具危险性的脓毒症休克,当与PTX3结合使用时,效果更佳[19]。2023年的一项前瞻性研究也肯定了IL-6的预后价值,研究结果显示,入住ICU的第1、3、7天所测量的血清IL-6水平对于脓毒症死亡的预测具有一定价值[32]。
2.4MR-proADM ADM是一种52个氨基酸的肽链,在各种组织和器官中广泛表达[33]。ADM非常不稳定,难以检测,MR-proADM可反映ADM水平[34]。MR-proADM由ADM的45~92氨基酸序列组成,比ADM更稳定。2021年的一项前瞻性试点研究虽然否认了MR-proADM与ICU入院时微血管血流指数(MFI)的直接相关性,但也肯定了MR-proADM、MFI和其他微血管变量的良好相关性,确认了MR-proADM具有良好的预后价值[35]。2023年的一项研究也证实了这一结论[27]。此研究回顾性纳入了301例脓毒症受试者(其中124例伴感染性休克)和126例局部感染受试者,该研究的数据显示MR-proADM的水平与器官损伤的严重程度呈正相关,能较好地预测脓毒症患者的不良预后[27],但该研究缺乏外部的验证队列。因此,需要进一步的验证以推进该研究结论应用于临床。
2.5其他生物标志物 一项2020年的系统评价显示suPAR在预测脓毒症病死率方面具有中等准确性,优于PCT[15]。NASR EL-DIN等[28]也证实了suPAR水平能够预测脓毒症患者的不良预后,对脓毒症患者28 d病死率的预测结果较为可靠。循环血中可溶性髓样细胞触发受体1(sTREM-1)在预测脓毒症28d病死率方面表现出很高的灵敏度(0.80,95%CI:0.66~0.89)和中等的特异度(0.75,95%CI:0.69~0.81)[36]。一项研究验证了sTREM-1、可溶性生长刺激表达基因2蛋白(sST2)及联合诊断因子(CDF)及其联合检测对脓毒症预后的影响,结果显示sTREM-1、sST2及CDF均对脓毒症的预后有较为有效的预测能力,二者联合判断结果更为可靠[29]。
一项前瞻性队列研究结果显示,入院时的nCD64和SOFA评分呈中度正相关(r=0.31,P=0.004),在幸存者组,nCD64水平在入院后的48 h内显著下降,这表明nCD64能够预测脓毒症的病死率,通过监测nCD64的水平变化也可以知晓患者的病情变化,从而改进治疗方式[30]。然而,目前关于CD64预测脓毒症不良结局的研究仍然有限,需要更多的研究去确认CD64在脓毒症预后中的作用。
3 治疗生物标志物
生物标志物不仅可以帮助诊断脓毒症,预测脓毒症的死亡风险,对于脓毒症的治疗,例如指导抗菌药物的使用,寻找治疗靶点以提高治疗效率等均有重要意义。
3.1PCT 研究显示,入院后连续测量血清PCT水平或许能够指导抗菌药物的使用[22],然而,在临床实践中,出于对经济和成本效益的考虑,拯救脓毒症运动(SCC)不建议使用PCT来指导抗菌药物的开始使用,但可以用于指导抗菌药物的停止,这有助于减少临床中抗菌药物的不当使用[37]。
3.2presepsin presepsin水平降低可以表示治疗的有效性,利用对presepsin的持续测量来评估患者病情的变化,这或许对于临床决定抗菌药物的停止时间有帮助[20]。
3.3TREM-1 TREM-1和Toll样受体4的联合激活可导致多种促炎细胞因子和趋化因子的释放,阻断TREM-1或可帮助减少炎症[38]。因此,通过研究TREM-1的结构和其信号通路,可能会得到一个新的脓毒症的治疗靶点[38]。
3.4IL-6 2023年的一项孟德尔随机化研究发现阻断IL-6受体(IL6R)或许能降低脓毒症发病率,需要进一步加大研究样本量以验证该结论[39]。同年,一项历史队列研究,通过建立血流感染小鼠模型发现:与革兰阳性菌感染小鼠对比,革兰阴性菌感染小鼠的IL-6水平显著升高,这一发现或许能够指导临床及时进行针对性的抗菌药物治疗[12]。
3.5BMP9 最近有研究在2个独立的脓毒症患者队列中量化了循环血中骨形态发生蛋白9(BMP9)的水平,与健康对照组相比,入院时脓毒症患者血清BMP9水平降低,进一步建立小鼠脓毒症模型,证实了补充BMP9能够对脓毒症小鼠发挥免疫治疗作用,该研究为脓毒症的精准治疗提供了免疫诊治靶点,可以作为脓毒症的定向疗法开发[40]。见表3。

表3 用于脓毒症诊断、预后与治疗的组学
4 组 学
近年来,越来越多的学者开始关注组学研究,以准确诊断、分层和治疗脓毒症。组学旨在通过对分子水平上的复杂数据集进行分析来区分患者的异质性。它包括基因组学、表观遗传学、转录组学、蛋白质组学和代谢组学。到目前为止,在转录组学方面取得了较多的研究成果,其次是蛋白质组学。
4.1转录组学 转录组学是对RNA水平上基因表达的研究,并寻找与病理生理学相关的转录标志。例如,SeptiCyteTMLAB 在区分脓毒症和SIRS方面具有优势。它是一种实时荧光定量PCR检测,可定量4个基因(CEACAM4、LAMP1、PLAC8、PLA2G7)的相对表达水平,其诊断脓毒症的AUC为0.88(95%CI:0.81~0.93),与PCT合并使用的AUC更大[41]。DENNY等[42]的研究验证了SeptiCyteTMLAB的诊断效能,其区分脓毒症及SIRS的AUC为0.80(95%CI:0.68~0.93)。SeptiCyteTMLAB已获得FDA的批准,是第一个被批准用于临床诊断的基因表达检测[49]。Sepsis MetaScore也可以判断脓毒症的发生,其诊断脓毒症的AUC为0.80(95%CI:0.67~0.92)[43]。MAYHEW等[44]开发了名为IMX-BVN-1的神经网络分类器,使用了29个预选宿主mRNA,可用于在入院时评估怀疑为感染或脓毒症的患者,对于判断有无细菌或病毒感染有较大价值。更新版本的IMX-BVN-2在区分有无细菌感染的患者方面的AUC为0.90(95%CI:0.85~0.95),略优于PCT(AUC为0.89,95%CI:0.84~0.94),此外,其对于排除病毒感染也有一定价值[45]。在脓毒症预后方面,转录组学也发挥着重要作用。一项前瞻性验证试验证明,包含29个宿主mRNA分类器的IMX-SEV-2能够评估感染的严重程度,在预测病死率方面的AUC为0.84(95%CI:0.76~0.93),高于乳酸(AUC=0.76,95%CI:0.64~0.87)、qSOFA评分(AUC=0.68,95%CI:0.57~0.79)和NEWS2评分(AUC=0.75,95%CI:0.65~0.85)[46]。研究显示,小儿脓毒症生物标志物风险模型(PERSEVERE)已被用于成人,以预测脓毒症的病死率[50]。PERSEVERE-XP将PERSEVERE与18种死亡风险评估基因网络相结合,在预测死亡方面的AUC优于PERSEVERE,为0.91(95%CI:0.87~0.95)[47]。基于转录组谱可以对细菌或病毒感染患者进行分类,相比于血细胞计数,在指导抗菌药物的使用中能发挥更大的作用[51]。最近的一项研究对单细胞RNA测序(scRNA-seq)进行了分析,鉴定发现了一类S100A家族基因高表达和人白细胞抗原 DR (HLA-DR)低表达的单核细胞亚群,这类细胞在脓毒症患者体内显著表达,可抑制免疫反应[52]。通过小鼠模型验证了该发现,同时使用帕奎莫德(paquinimod)阻断 S100A9 可以部分逆转脓毒症诱导的免疫抑制[52]。这或许是脓毒症治疗的新靶点。如今,PCR技术已得到迅速发展,转录组学或许会发展为一种更便捷且更具性价比的工具。
4.2蛋白组学与代谢组学 蛋白组学指的是对于基因组表达的全部蛋白质的研究,而代谢组学则指的是对于生物体内的所有代谢物的研究。借助色谱和质谱等技术的发展,通过蛋白组学和代谢组学,已经发现了几种用于脓毒症诊断和预后的新生标志物。一项研究表明酰基肉碱(C10:1)和甘油磷脂酰胆碱(PCaaC32:0)的水平在脓毒症中显著升高,这两种生物标志物可能有助于区分感染性脓毒症和非感染性全身性炎症[48]。同时,有研究鉴定了501种糖肽,其中66种是脓毒症幸存患者特有的,60种是脓毒症非幸存患者特有的,该研究结果提示了脓毒症患者存活的关键在于补体和凝血级联反应通过外在途径还是内在途径发挥作用[53]。另一项研究发现了73种不同表达的代谢物,可以帮助脓毒症的诊断和预后[54]。此外,该研究表明磷酸戊糖途径与脓毒症相关脑病有关,苯丙氨酸代谢产物可以预测脓毒症相关急性肾损伤[54]。这些代谢产物可以提示患者的不良预后,以便得到及时治疗。目前有发现血管炎症的几种代谢物标志,如纤连肽A、丙氨酸和组胺,它们的水平在左卡尼汀治疗的脓毒症非幸存者患者中升高,这提示可以使用特定代谢物来预测患者对治疗的反应,从而实现更精确的治疗[55]。总的来说,蛋白组学和代谢组学在脓毒症研究中也显示出巨大的潜力。
5 小 结
近年来,大量有关于脓毒症的宿主反应生物标志物被发现,然而,大多数生物标志物需要进一步得到验证,只有少数已被批准应用于临床实践,例如PCT与SeptiCyteTMLAB[18,43]。但在目前的研究中,在超过300例患者的研究中评估其诊断价值的生物标志物中,只有IαI、CD64、IL-6的AUC超过0.8,其中IαI诊断脓毒症的AUC最高,为0.94[4]。评估脓毒症预后的生物标志物中,目前发现的在入院后第7天收集的suPAR水平对于脓毒症病死率的预测价值最大,其预测脓毒症病死率的AUC已达0.998[29],但目前该结论没有在大型多中心队列研究中验证。在超过300例患者中验证了预后价值,并且AUC>0.8的仅有presepsin[4]。单个生物标志物在帮助诊治脓毒症时不能发挥最理想的作用,生物标志物的组合能够更好地辅助脓毒症的预后,例如,presepsin+SOFA评分预测脓毒症病死率的AUC大于presepsin或SOFA评分单独预测[24]。接下来,寻找更多的生物标志物的组合以确认最优组合或许能够提升脓毒症诊治的准确度。在治疗方面,目前研究有发现补充BMP9能够对脓毒症小鼠发挥免疫治疗作用,为开展基于生物标志物的脓毒症治疗提供了免疫治疗靶点。组学技术快速发展,基于分子生物学的研究能更好地辨别同质患者群,并实现个体化治疗。研究发现使用paquinimod阻断 S100A9 可以部分逆转脓毒症诱导的免疫抑制[53],这或许是脓毒症治疗的新靶点。组学技术目前在脓毒症领域具有极大潜力,能够帮助区分脓毒症的异质性,实现个体化治疗。此外,将组学技术与机器学习算法相结合用于预测特定类型的脓毒症以实现精准医疗,有助于脓毒症的及早诊断及治疗。
