射血分数保留的心力衰竭患者血清Myostatin、DLL1与心室重构指标和预后的关系研究*
2024-04-12苗艳丽李红净周海静吴海涛
苗艳丽,李红净,周海静,吴海涛
邯郸市第一医院心内科,河北邯郸 056002
心力衰竭(简称心衰)是各种心血管疾病的终末阶段,近年来随着人口老龄化的持续发展和各种心血管疾病患者生存期的延长,我国心衰发病率持续增加[1-2]。射血分数保留的心衰(HFpEF)是心衰常见类型,占所有心衰类型的50%,其病死率与左室射血分数(LVEF)降低的心衰相当[3],及时评估HFpEF患者预后对指导临床治疗和促进预后改善非常重要。心室重构是HFpEF发生发展的病理基础,骨骼肌代谢障碍、炎症反应和细胞外基质重塑在其中发挥重要作用[4-5]。肌肉生长抑制素(Myostatin)是一种肌肉蛋白,能负向调控肌肉细胞,抑制肌肉生长,进而降低骨骼肌质量[6]。有研究发现,Myostatin水平与慢性心衰患者虚弱密切相关[7]。Delta样缺口配体1(DLL1)是Notch信号通路的重要调节因子,能与Notch受体相互作用影响炎症和细胞外基质重塑过程[8]。有研究指出,血清DLL1能与扩张型心肌病程度和心功能指数有关[9]。本研究拟探讨HFpEF患者血清Myostatin、DLL1与心室重构指标和预后的关系,旨在为促进患者预后改善提供参考依据。
1 资料与方法
1.1一般资料 选取2021年1月至2022年1月邯郸市第一医院收治的117例HFpEF患者为HFpEF组。其中,女56例、男61例;年龄26~82岁、平均(67.51±9.42)岁。纳入标准:HFpEF符合《中国心力衰竭诊断和治疗指南2018》[10]诊断标准。(1)有心衰症状和(或)体征(活动受限、气促、疲乏或心悸);(2)LVEF≥50%;(3)利钠肽升高,N末端B型利钠肽前体(NT-proBNP)>125 ng/L和(或)B型利钠肽(BNP)>35 ng/L,并具备心脏舒张功能异常、左心室肥厚、左心房扩大中的任意一项。排除标准:(1)其他类型心衰;(2)合并其他心脏疾病;(3)妊娠及哺乳期女性;(4)合并恶性肿瘤;(5)合并自身免疫性疾病;(6)精神性疾病;(7)资料不完整。另选取同期100例体检健康者为对照组,女48例、男52例;年龄24~76岁、平均(67.69±8.42)岁。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经邯郸市第一医院医学伦理委员会批准。所有受试者或家属签署知情同意书。
1.2方法
1.2.1血清Myostatin、DLL1水平检测 采集HFpEF组入院次日和对照组体检时3 mL空腹静脉血,采用酶联免疫吸附试验法检测Myostatin、DLL1水平。Myostatin试剂盒购自上海西唐生物科技有限公司。DLL1试剂盒购自武汉华美生物工程有限公司。
1.2.2超声心动图 HFpEF组诊断时和对照组体检时行超声心动图检查,采用彩色多普勒超声诊断仪通过双平面法[11]测量左心室舒张末期内径(LVEDD)、左心室后壁厚度(LVPWT)、舒张末期室间隔厚度(IVST),并计算左心室心肌质量指数(LVMI)。彩色多普勒超声诊断仪购自美国GE公司(型号:VolusonS6)。
1.2.3资料收集 收集HFpEF患者性别、年龄、病程、合并症、纽约心脏协会(NYHA)心功能分级[10]、用药情况、LVEF和NT-proBNP等资料。
1.3预后分组 HFpEF患者入院后根据《中国心力衰竭诊断和治疗指南2018》[10]接受相关治疗,通过电话或门诊对患者随访1年,根据预后分为预后不良组和预后良好组,预后不良定义为再次心衰住院、发生心血管事件和全因死亡。

2 结 果
2.1HFpEF组与对照组血清Myostatin、DLL1水平和心室重构指标比较 HFpEF组血清Myostatin、DLL1水平和LVEDD、LVPWT、IVST、LVMI均高于对照组(P<0.05)。见表1。

表1 HFpEF组与对照组血清Myostatin、DLL1水平和心室重构指标比较
2.2HFpEF患者血清Myostatin、DLL1与心室重构指标的相关性 Pearson相关性分析结果显示,HFpEF患者血清Myostatin、DLL1与LVEDD、LVPWT、IVST、LVMI均呈正相关(P<0.05)。见表2。
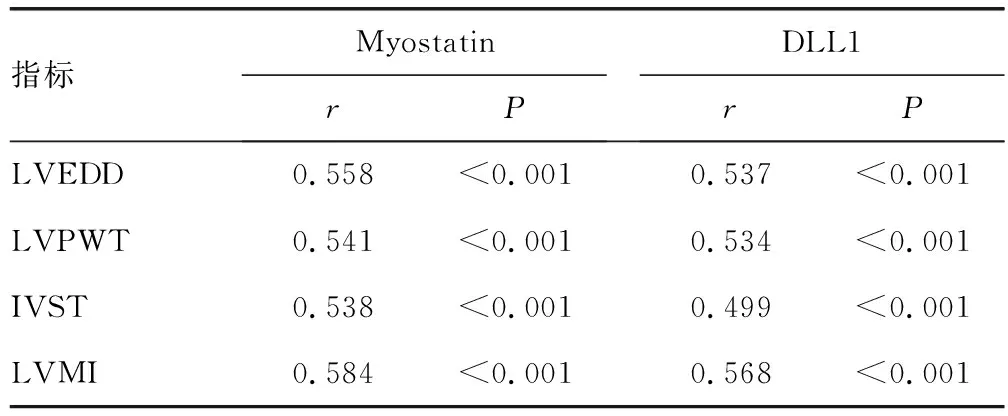
表2 HFpEF患者血清Myostatin、DLL1与心室重构指标的相关性
2.3HFpEF患者预后不良的单因素分析 随访1年,无失访病例,117例HFpEF患者预后不良39例(33.33%),其中再次心衰住院12例、发生心血管事件19例和全因死亡8例。单因素分析显示,预后不良组NYHA心功能分级≥Ⅲ级、高血压比例和LVEDD、LVPWT、IVST、LVMI、NT-proBNP、Myostatin、DLL1高于预后良好组(P<0.05),LVEF低于预后良好组(P<0.05),两组患者性别、年龄、病程、糖尿病、高脂血症、用药情况比较差异无统计学意义(P>0.05)。见表3。
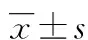
表3 HFpEF患者预后不良的单因素分析[n(%)或或M(P25,P75)]
2.4HFpEF患者预后不良的多因素Logistic回归分析 以表3中差异有统计学意义的因素NYHA心功能分级(≥Ⅲ级/<Ⅲ级=1/0)、高血压(有/无=1/0)、LVEF、LVEDD、LVPWT、IVST、LVMI、NT-proBNP、Myostatin、DLL1(均为连续性变量,原值输入)为自变量,预后(不良/良好=1/0)为因变量,建立多因素Logistic回归模型。多因素Logistic回归分析结果显示,NYHA心功能分级≥Ⅲ级、合并有高血压和LVEDD、NT-proBNP、Myostatin、DLL1升高为HFpEF患者预后不良的独立危险因素(P<0.05)。见表4。
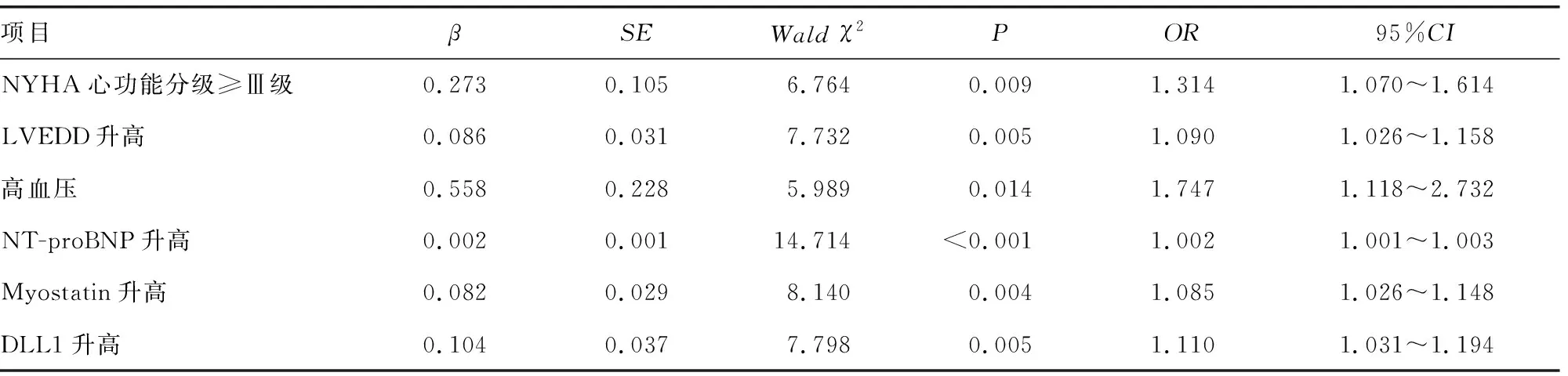
表4 HFpEF患者预后不良的多因素Logistic回归分析
2.5血清Myostatin、DLL1水平对HFpEF患者预后不良的评估价值 以预后不良组(n=39)为阳性样本,预后良好组(n=78)为阴性样本,行ROC曲线分析,结果显示,血清Myostatin、DLL1水平单独和联合评估HFpEF患者预后不良的曲线下面积(AUC)分别为0.782、0.724、0.808,血清Myostatin联合DLL1水平对HFpEF患者预后不良的评估价值高于各指标单独评估。见表5和图1。

图1 血清Myostatin、DLL1水平评估HFpEF患者预后不良的ROC曲线

表5 血清Myostatin、DLL1水平对HFpEF患者预后不良的评估价值
3 讨 论
HFpEF是一种以左心室舒张功能受损为主的高度异质性疾病,尽管近年来针对心衰的诊治和综合管理取得良好进展,但由于HFpEF认识时间相对较短,而且具有临床表现缺乏特异性、病因复杂多样等特点,导致HFpEF再住院率和病死率仍然居高不下[12-13]。目前临床主要使用B型利钠肽或NT-proBNP评估HFpEF患者预后,但受性别、年龄、肥胖、肾功能、药物、贫血等多种因素影响,其评估价值有限,还需寻找新的生物标志物[14]。
心室重构是HFpEF疾病进展的重要机制,心室重构可通过引起左心室舒张功能不全促进HFpEF发生发展[3]。研究HFpEF患者心室重构相关影响因素,有助于HFpEF患者预后评估。目前临床主要依靠超声心动图评估心衰患者心室重构[11]。本研究结果显示,HFpEF患者LVEDD、LVPWT、IVST、LVMI显著升高,说明HFpEF患者存在明显的心室重构,符合其病理变化。由于HFpEF患者心功能进行性恶化和运动不耐受,使机体能量代谢受到影响,进而导致降低肌肉质量和肌肉功能丧失,肌肉质量和功能丧失会增强系统性炎症反应和引起神经内分泌系统激活,通过增强血管收缩和引起心肌细胞凋亡导致心室重构,而随着肌肉质量和功能进一步下降还能引起心脏恶病质,导致预后不良[4]。Myostatin是骨骼肌分泌的一种肌肉蛋白,在肌肉组织中广泛表达,其主要功能是负向调控肌肉的生长发育以抑制肌肉生长,若缺乏Myostatin基因则会使肌肉不受控制生长而导致异常肥大[15]。心肌作为一种肌肉组织也广泛表达Myostatin,生理状态下能调控心肌生长,当心肌受损时Myostatin大量分泌能加剧心肌损伤[16]。LIM等[17]研究报道,敲除心肌梗死小鼠Myostatin基因,能抑制小鼠梗死后心肌胶原沉积和纤维化发展,进而改善心脏功能。有临床研究指出,血清Myostatin水平与心衰患者病情和心功能相关[18]。CHEN等[19]研究显示,血清Myostatin水平与慢性心力衰竭患者预后密切相关。然而,关于血清Myostatin与HFpEF患者心室重构和预后的关系尚未可知。本研究结果显示,HFpEF患者血清Myostatin水平升高,与LVEDD、LVPWT、IVST、LVMI呈正相关,是HFpEF患者预后不良的独立危险因素,说明血清Myostatin水平升高与HFpEF患者心室重构有关,并会增加患者预后不良风险。HFpEF患者血清Myostatin水平升高可能与其心肌细胞受损后Myostatin大量分泌有关。而Myostatin水平升高能抑制患者心肌和骨骼肌生长,增强系统性炎症反应和神经内分泌系统激活,导致心室重构[20]。同时,随着Myostatin水平升高,心肌质量和功能持续下降,引起心脏恶病质,使左心室舒张功能持续恶化,导致预后不良风险增加[21]。
炎症反应和细胞外基质重塑是心室重构发生发展的重要机制,炎症反应诱导心肌纤维化和凋亡导致心室重构,同时心肌纤维化过程中分泌的大量胶原蛋白能引起细胞外基质重塑,通过破坏心脏结构导致心室重构[3]。Notch信号通路在进化过程中高度保守,Notch受体(Notch1/2/3/4)通过结合其配体活化Notch信号通路,调节包括炎症反应、细胞外基质重塑在内的多种病理生理过程[8]。DLL1是一种Ⅰ型跨膜糖蛋白,可以通过多种去整合素和基质金属蛋白酶的蛋白水解酶从细胞表面释放到细胞外,与Notch受体相互作用,影响Notch信号通路蛋白活性[22]。既往研究表明,Notch信号通路能增强促炎因子分泌和诱导细胞外基质重塑导致心室重构,敲低Notch信号通路分子能抑制心衰进程[23-24]。NORUM等[25]研究发现,血清DLL1水平升高,与慢性心衰患者心脏舒张功能障碍、运动能力下降及预后不良相关。HFpEF是一种以左心室舒张功能受损为主的心衰,故推测DLL1可能参与HFpEF进程。本研究结果显示,HFpEF患者血清DLL1水平升高,与LVEDD、LVPWT、IVST、LVMI呈正相关,是HFpEF患者预后不良的独立危险因素,说明血清DLL1水平升高与HFpEF患者心室重构有关,并会增加患者预后不良风险。其机制可能是DLL1水平升高能结合Notch受体激活Notch信号通路,增强炎症反应和细胞外基质重塑导致心脏重塑,进而导致预后不良。
此外,本研究结果还显示,NYHA心功能分级≥Ⅲ级、合并有高血压也会增加HFpEF患者预后不良的风险,考虑与其分级越高反映患者心功能越差,而高血压会导致心肌功能降低,因此预后更差有关。本研究通过ROC曲线分析发现,血清Myostatin、DLL1水平联合评估HFpEF患者预后不良的AUC为0.808,灵敏度和特异度分别为0.795、0.821,灵敏度和特异度分别较Myostatin、DLL1单独评估有所提升,说明联合检测血清Myostatin、DLL1水平能提升HFpEF患者预后不良的评估价值。
综上所述,HFpEF患者血清Myostatin、DLL1水平升高,随着心室重构加重而升高,二者均是预后不良的独立危险因素,血清Myostatin、DLL1水平联合检测对HFpEF患者预后不良的评估价值较高。本研究不足在于样本量有限,需要多中心、大样本量研究进一步验证本研究结论,血清Myostatin、DLL1与心室重构间的具体作用机制还需进一步深入研究。
