玉米ACO基因家族生物信息学及表达模式分析
2024-04-11王程泽张燕付伟贾京哲董金皋申珅郝志敏
王程泽,张燕,付伟,贾京哲,董金皋,申珅,郝志敏
玉米基因家族生物信息学及表达模式分析

1河北农业大学生命科学学院/华北作物改良与调控国家重点实验室/河北省农业微生物生物信息利用技术创新中心/河北省植物生理与分子病理学重点实验室,河北保定 071000;2邯郸学院,河北邯郸 056005
【目的】对玉米1-氨基环丙烷-1-羧酸氧化酶基因家族进行全基因组鉴定,分析其在玉米不同器官和不同发育时期以及响应外源激素和病菌侵染中的表达模式,为明确玉米基因家族功能打下基础。【方法】利用生物信息学方法,在玉米B73自交系基因组中鉴定,对其基因结构、蛋白质理化性质、家族成员间的亲缘关系以及保守基序进行分析,利用实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)技术分析基因家族的表达模式。【结果】除ZmACO11外,ZmACO家族成员均具有Fe2+离子结合位点和底物抗坏血酸结合位点。系统发育分析显示,与在同一分支,亲缘关系较近,Bootstrap值达98。基因表达分析表明,、、、在各发育时期均活跃表达,且在叶片中呈优势表达,因此选择上述6个基因进行下一步检测。喷施乙烯利后,上述6个基因的表达均有所波动,其中的表达量受影响较大,变化幅度在8倍左右。在乙烯利处理的0—24 h内这6个基因的表达量存在波动,但在处理后24 h,6个基因的表达量均接近0。水杨酸处理后,的表达量受影响较大,变化倍数在2倍左右。其他基因的表达量在处理后24 h均接近0。、在3—12 h的表达量存在波动,、、表达量呈下调趋势。在响应生物胁迫方面,接种玉米大斑病菌()后,的表达量变化幅度最大,在接种后第10天,这两个基因的表达量分别升至对照组的50和60倍。接种玉米小斑病菌()后,的表达量变化幅度较大,变化倍数在40—90倍。接种立枯丝核菌()后,、表达量变化幅度最大,在病菌接种的第3天达到200倍。【结论】、、、在玉米生长发育过程中表达变化最活跃;施加外源乙烯利和水杨酸可以对的表达水平造成显著影响。病菌侵染玉米后的表达水平产生显著变化,与生物胁迫应答关系密切。
玉米基因家族;实时荧光定量PCR;基因表达;乙烯利;水杨酸;玉米大斑病菌;玉米小斑病菌;立枯丝核菌
0 引言
【研究意义】玉米()是世界上重要的粮食作物之一。生物与非生物胁迫是影响玉米健康生长的主要问题,提高其抗逆能力已成为玉米产业提质增效的迫切需求[1]。乙烯是在植物中第一个发现的气体激素,其调控植物种子休眠、萌发、开花、营养生长、果实成熟和叶片衰老等生理过程[2-3],在抵御生物和非生物胁迫中也发挥重要作用[4]。在高等植物中,乙烯的生物合成前体是甲硫氨酸,在S-腺苷甲硫氨酸合成酶(SAMS)催化下合成S-腺苷甲硫氨酸(SAM),在1-氨基环丙烷-1-羧酸合酶(ACS)作用下合成1-氨基环丙烷-1-羧酸(ACC),最后经过1-氨基环丙烷-1-羧酸氧化酶(ACO)催化生成乙烯[5]。ACO是非血红素铁离子氧化酶家族中的一员,是乙烯生物合成途径中的限速酶[6]。明确在玉米响应逆境胁迫中的表达模式,可加深对乙烯与玉米抗病性之间关系的理解,为挖掘玉米抗性资源打下基础。【前人研究进展】ACO最初由Mattoo等发现,并将其命名为乙烯形成酶(EFE)[7]。后续研究发现ACO起作用时需要抗坏血酸盐和O2作为辅助底物,同时还需要Fe2+和CO2作为辅助因子,所以更名为ACO(ACC氧化酶)[8]。首次被克隆是在番茄()中[9],随后,在桑树()、甜瓜()、烟草()、拟南芥()等多种植物中也被克隆,并开展了的全基因组鉴定、表达以及生物学特性的分析[10-11],但这些研究主要围绕果实开展。在杨树()中过表达可导致杨树幼苗变矮[12]。在棉花(spp.)中发现表达上调诱导棉花纤维细胞的伸长[13]。对旱柳()的研究证实,在林木茎的生长中发挥着至关重要的作用[14]。有研究表明,ACO是由多基因家族编码,不同成员在植物的时空表达、转录和翻译水平上呈现出差异[15]。菠萝()、蜻蜓凤梨()均可受外源乙烯利的诱导[16-17]。桑树的表达量可在NaCl、ABA和SA处理以及机械损伤后上调[18]。甜瓜和8在授粉后30 d的表达量比授粉后10 d明显上升[19]。烟草启动子区含有激素反应、低温反应、抗性和胁迫反应、损伤反应和干旱诱导等不同种类的顺式作用元件。玉米基因家族成员启动子区存在植物激素调控元件和逆境胁迫相关元件,黏虫取食玉米后,玉米基因家族成员的表达水平会产生变化[20]。烟草、西来稗()在二氯喹啉酸诱导后呈现不同程度的上调表达[21-22]。0.01 g·L-1的SA处理会抑制杏()果实贮藏期间的ACO活性[23]。灰葡萄孢()侵染番茄果实会使其乙烯产量快速增加,ACO活性升高,表达水平也会升高[24]。香蕉()被枯萎病菌侵染后,在感染初期(3 h)的表达量急剧升高,且抗病植株中的表达量比感病植株的低[25]。但目前关于玉米的家族基因功能,尤其是其在玉米响应生物胁迫中的作用仍知之甚少。【本研究切入点】大量研究表明,ACO蛋白是一个家族蛋白,同一植株中有多种ACO蛋白,它们存在时空差异性,在植物生长发育的不同时期行使着不同功能。的启动子区存在不同种类的顺式作用元件,包括激素反应、胁迫反应及损伤反应等。乙烯是植物响应生物胁迫的重要信号分子,植物在受到病菌侵害时,其体内与乙烯合成的相关酶基因表达水平也会产生变化[26-27]。目前对玉米基因家族与生物胁迫响应之间的关系未见系统研究。【拟解决的关键问题】利用生物信息学方法明确玉米B73自交系基因家族的组成及各基因与其编码产物的结构特征、理化性质;分析基因家族在玉米生长发育过程中的表达模式,明确外源信号物质以及病菌侵染对表达的影响,为解析基因家族在响应生物胁迫中的功能提供理论依据。
1 材料与方法
试验于2023年在河北农业大学生命科学学院/河北省植物生理与分子病理学重点实验室完成。
1.1 供试材料
玉米B73自交系、玉米大斑病菌()、小斑病菌()、立枯丝核菌()均由河北省植物生理与分子病理学实验室保存。
1.2 ZmACO家族基因生物信息学分析
从玉米基因组数据库(http://ensembl.gramene.org/ Zea_mays/Info/Index)提取家族基因信息,经过筛选鉴定其家族成员。利用NCBI进行同源比对,整理氨基酸序列。利用MEGA-X构建系统发育树。利用DNAMAN进行序列比对,对ZmACO蛋白进行保守基序分析。利用ExPASy(http://web.expasy.org/ protparam/)对ZmACO的分子量、理论等电点、氨基酸长度等进行预测分析。
1.3 ZmACO家族基因组织/器官表达分析
通过玉米基因组数据库查询玉米生长发育时期不同器官和组织中家族基因的表达量,其中包括授粉后20、38 d的胚,授粉后12 d的胚乳,授粉后27 d的胚乳顶端、果皮和糊粉层,2—4和6—8 mm的穗原基,6—7和7—8节间,16—19 d的营养分生组织,播种后2 d的萌发种子,叶片对称区,叶片气孔区,幼嫩叶片,成熟叶,5 d的初生根、根皮层、根伸长区和根分生区,7—8 d的次生根,成熟花粉,雌花小穗,穗丝,利用MeV 4.9.0绘制热图。
1.4 ZmACO家族基因在外源乙烯利和水杨酸处理下的表达分析
挑选颗粒饱满的玉米种子,种于花盆(蛭石﹕营养土=1﹕3),定期浇灌营养液。利用乙烯利和水杨酸处理玉米,其中乙烯利浓度为300 mg·L-1,水杨酸浓度为1.0 mmol·L-1。在玉米3—6叶期进行喷雾处理,分别在处理后3、6、12、24 h取玉米叶片,将样品在液氮中速冻,置于-80 ℃冰箱保存。利用Trizol试剂盒提取处理好的玉米样品总RNA,采用UEIrisII RT-PCR system for First-Strand cDNA Synthesis(with dsDNase)反转录试剂盒合成cDNA。
利用NEBuilder(https://nebuilderv1.neb.com/)设计引物(表1),选择作为内参基因,以经过乙烯利和水杨酸处理的玉米组织cDNA为模板,使用Super Eva Green® qPCR Master Mix试剂盒进行qRT-PCR扩增(表2),采用美国Bio-Rad CFX96 TouchTM型荧光定量PCR系统进行试验。每组重复3次,采用Excel 2010和GraphPad Peism8绘制图表。
1.5 病菌侵染过程中ZmACO家族基因的表达模式分析
玉米长至6叶期,分别将玉米大斑病菌、玉米小斑病菌、立枯丝核菌的菌盘置于玉米不同植株同一位置的叶片上,保湿24 h。分别取处理前(0 d)、处理后1、2、3、5、7和10 d的叶片,保存于-80 ℃冰箱中。参考方法1.4合成cDNA,进行表达模式分析。

表1 实时荧光定量PCR所用引物序列

表2 qRT-PCR反应体系
2 结果
2.1 ZmACO家族基因的获取
从玉米基因组数据库提取到16个。对其基因结构及蛋白质理化性质分析表明,该家族基因开放阅读框(ORF)长度介于372—1 599 bp,最短,最长,对应的编码产物长度为123—376 aa,蛋白相对分子质量为13 700.64—40 606.00 Da,不同成员的理论等电点介于4.89—9.52(表3)。
2.2 ZmACO基因家族的生物信息学分析
进化关系分析表明与、、的亲缘关系较近,、、、、、与亲缘关系较近。与在同一个分支中,亲缘关系很近。和的氨基酸序列相似度为100%(图1)。通过对ZmACO的结构域进行分析,发现除ZmACO11以外,其他蛋白均存在两个保守结构域,分别为Fe2+离子结合位点和底物抗坏血酸结合位点。
2.3 玉米不同发育时期、不同器官/组织中ZmACO家族基因的表达规律
利用玉米数据库搜集玉米不同发育时期的胚、胚乳、穗原基、节间、种子、叶、根等器官/组织中基因家族的表达量(图2),结果显示基因家族中的、、、在多个器官中均有不同程度表达,且表达量高于其他家族成员。在播种后2 d的萌发初期种子中表达量最高,在6—7、7—8节间、16—19 d的营养分生组织和幼嫩叶片中表达量较高,在穗原基和授粉后20 d的胚中表达量较高。在播种后2 d的种子、成熟叶和5 d的根皮层中表达量较高。在穗原基、授粉后27 d的果皮和糊粉层、雌花小穗和穗丝中表达量较高。在授粉后27 d的果皮和糊粉层、成熟的叶片和穗丝中表达量较高。在穗丝中表达量较高。在授粉后27 d的果皮和糊粉层和成熟叶片中表达量较高。在授粉后12 d的胚乳、授粉后27 d的胚乳顶端、果皮和糊粉层中存在表达。仅在根的不同发育阶段存在极微弱表达。在穗原基中存在很低的表达。

图1 ZmACO与其他植物ACO系统发育树
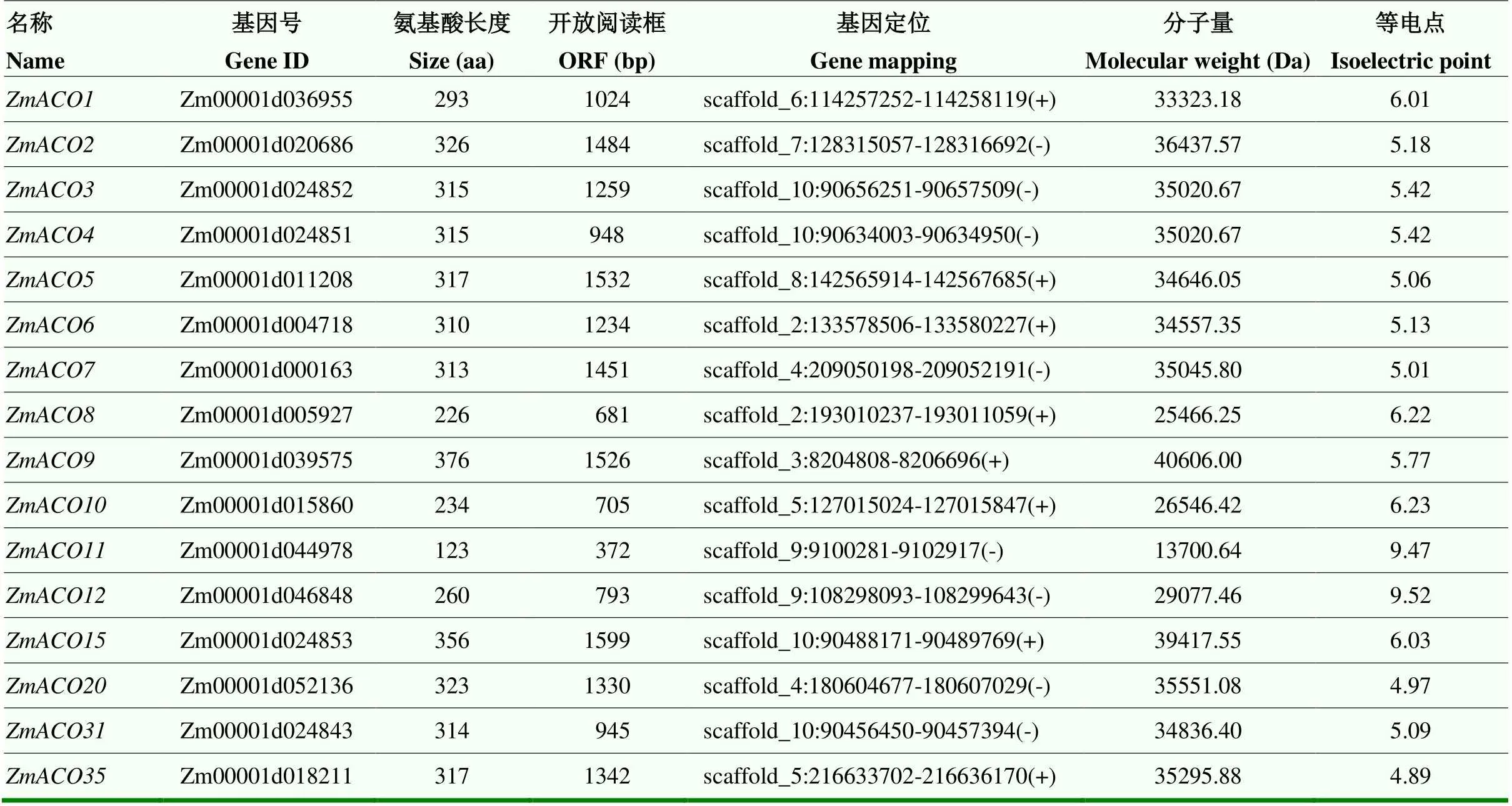
表3 ZmACO家族基因及编码产物信息

1:6—7节间6-7 Internode;2:7—8节间7-8 Internode;3:16—19 d的分生组织Meristem at 16-19 d;4:2—4 mm的穗原基Ear primordium of 2-4 mm;5:6—8 mm的穗原基Ear primordium of 6-8 mm;6:授粉后20 d的胚Embryo at 20 d after pollination;7:授粉后38 d的胚Embryo at 38 d after pollination;8:授粉后12 d的胚乳Endosperm at 12 d after pollination;9:授粉后27 d的胚乳顶端Endosperm crown at 27 d after pollination;10:播种后2 d的萌发种子Germination kernels at 2 d after seeding;11:授粉后27 d的果皮和糊粉层Pericarp/aleurone at 27 d after pollination;12:叶子对称区Leaf zone 1 (symmetrical);13:叶子气孔区Leaf zone 2 (stomatal);14:幼嫩叶片Leaf zone 3 (growth);15:成熟叶片Mature leaf 8;16:5日龄的初生根Primary root at 5-day-old;17:5日龄的根皮层Root cortex at 5-day-old;18:5日龄的根伸长区Root elongation zone at 5-day-old;19:5日龄的根分生区Root meristem zone at 5-day-old;20:7—8日龄的次生根Secondary root at 7-8-day-old;21:成熟花粉B73 mature pollen;22:雌花小穗Female spikelet;23:穗丝Silk
2.4 乙烯利和水杨酸处理下ZmACO家族基因表达量
使用乙烯利、水杨酸处理玉米,选择在玉米生长发育过程中表达较活跃的6个基因(、、、、、)进行表达模式分析(图3)。以处理后0 h的基因表达量为对照,在乙烯利处理下,在0—3 h表达量呈上调趋势,3—6 h显著下调,在6—12 h表达量呈现上调趋势,高于对照的表达量,在12—24 h表达量显著下调,达到最低;、在0—6 h表达量呈现上调趋势,之后6—24 h呈现下调趋势,在24 h时达到最低,接近0。、表达量在0—6 h呈现下调趋势,6—12 h上调,12—24 h下调,在24 h表达量接近0。在水杨酸处理下,、、的表达量呈下调趋势。、的表达量在3—12 h存在波动,但总体呈现下调趋势。的表达量在0—3 h上调,3—12 h下调,12—24 h上调。
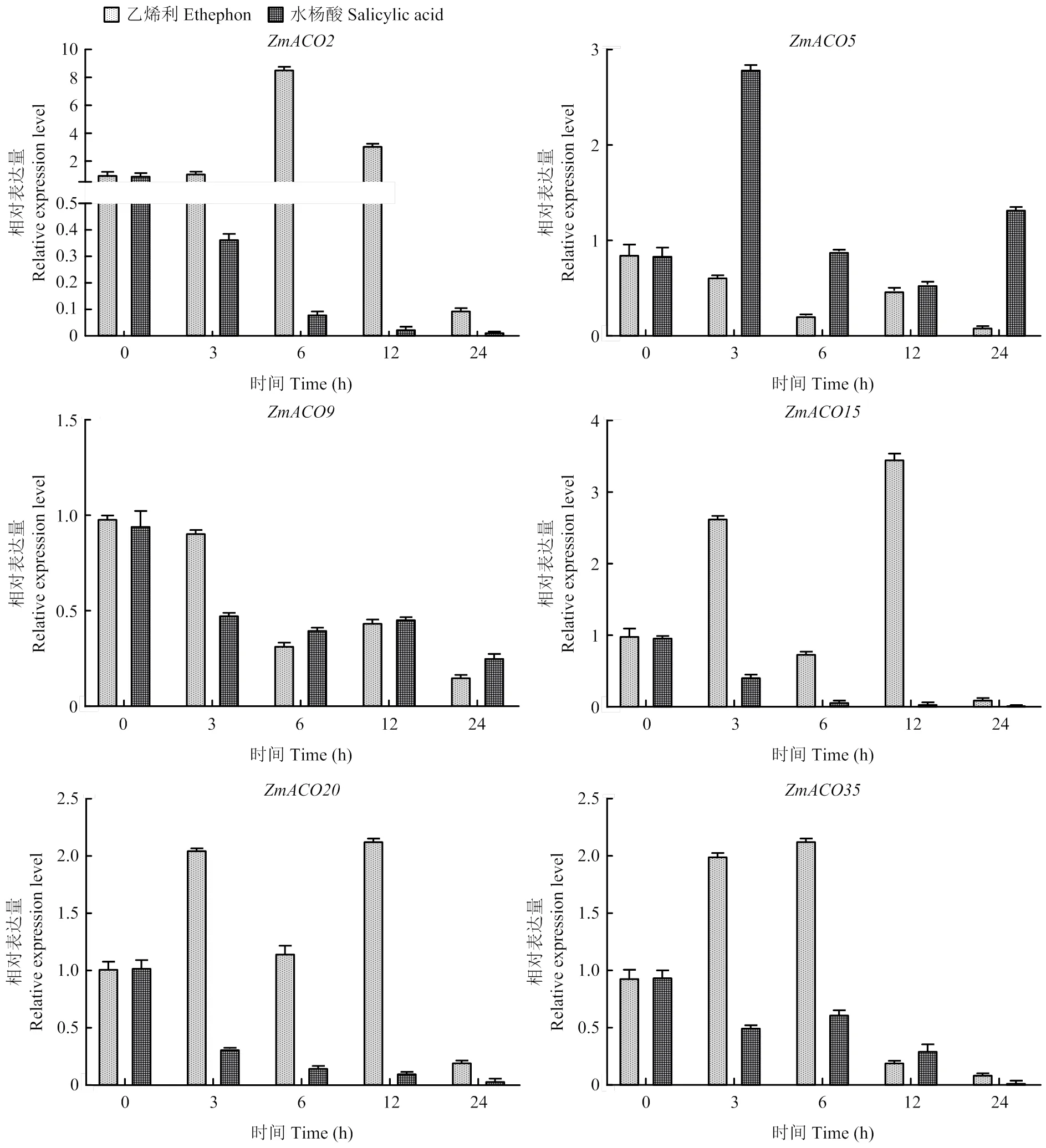
图3 乙烯利和水杨酸处理后ZmACO表达量变化
2.5 病菌侵染下ZmACO基因家族表达模式
根据病菌接种部位,选择在玉米叶片高表达的、、、、、进行实时荧光定量PCR分析(图4)。以处理后0 d的基因表达量为对照。接种大斑病菌后,、、、、的表达量波动幅度较大,均在接种1 d时表达量上升;在接种5 d时表达量较低,之后逐渐上升,在第10天达到最高水平;、在接种第3天表达量较低,然后开始上升,在第10天达到最高水平;的表达量变化趋势不明显,在接种后表达量便达到处理前的20倍,后续变化幅度不大。接种小斑病菌后,的表达量存在波动,无明显变化趋势,但病菌接种后表达量比对照组的表达量高9—90倍;的表达量在病菌接种后0—7 d呈上升趋势,第10天的表达量均降低,的降低程度极大;的表达量总体呈下降趋势,但在0—2和3—5 d呈微弱的上升趋势;的表达量在0—1 d呈上升趋势,之后的变化趋势与大斑病菌接种后的变化趋势相似,总体呈波动趋势但变化幅度不大。接种立枯丝核菌后、、、、、的变化趋势相似,在0—3 d呈上升趋势,3—10 d呈下降趋势,表达量均在第3天达到峰值。
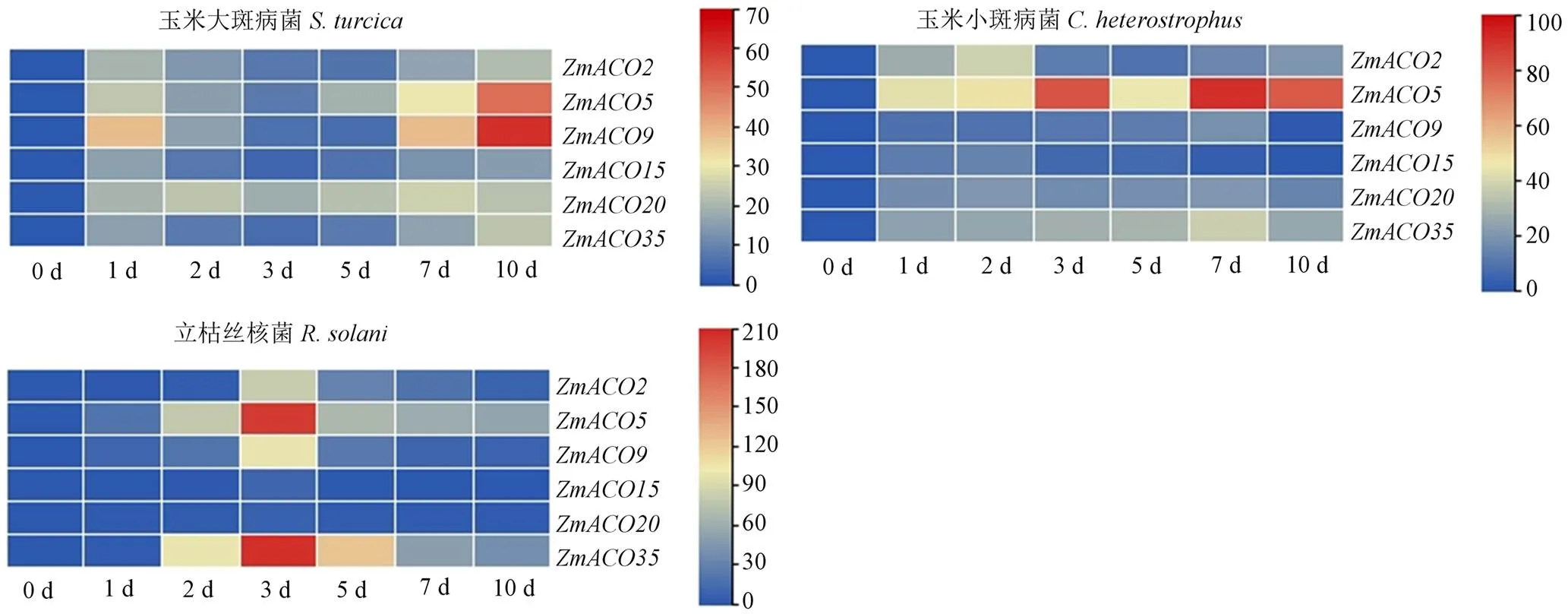
图4 病菌侵染后ZmACO表达量变化
3 讨论
3.1 ZmACO在不同组织和器官中的表达规律
是一个多基因家族,其表达具有时空特异性,在不同组织、器官以及不同生长发育时期,基因的表达量存在差异。通过研究基因的表达规律可以揭示生物体内在的生长发育规律和分子调控机制,为研究玉米抗病及生产调控提供帮助。
早期关于的研究多围绕植物的果实成熟调控开展。后续研究逐渐发现,的表达存在于植物整个生长发育周期。黄瓜存在5个,与性别分化相关,在花发育时期基本不表达[28-29]。在苹果中发现了3个家族成员,的表达局限于果实,在苹果的幼叶和幼芽中具有表达优势,在成熟果实中几乎不表达[30]。在桃的基因组中发现了2个,在成熟果实中表达量高,仅在果实发育初期表达[31]。在甘蔗中有3个,主要在根表达,在叶和根表达,主要在叶中表达[32]。对玉米进行编辑会导致发育的穗中乙烯产量减少,并促进分生组织和花的发育,从而使杂交系的每穗产量增加约13.4%[33]。上述研究表明基因家族成员的表达存在着明显的时空差异性,其在植物整个生长发育过程中均发挥着重要作用。本研究中,玉米B73自交系16个基因家族成员在不同组织和器官中表达量差异明显。其中大部分成员在玉米根的分生区、初生生长和次生生长的根中表达,以表达量较高,这3个基因还在授粉后的胚中表达活跃,推测其主要参与调控玉米幼嫩组织的发育成熟;则在穗原基和穗丝中表达量较高;主要在成熟叶片中表达。对这些基因表达的时空特点进行分析可为后续对其功能研究提供有力支持。
3.2 ZmACO对外源乙烯利和水杨酸处理的响应
乙烯利又称2-氯乙基磷酸,可以释放乙烯,从而发挥作用[34]。有研究表明,乙烯信号途径和水杨酸信号途径可以互相协同加速拟南芥叶片的衰老[35-36],并且乙烯和水杨酸信号途径在对植物抵抗生物胁迫和非生物胁迫中发挥重要作用[37-38]。和的表达受到乙烯利的诱导[17]。水杨酸处理后表达上调[18],但是在杏、苹果、桃中则表现为抑制ACO酶活性或基因表达[23,27,31]。对启动子区顺式作用元件分析显示,其含有植物激素调控元件和逆境胁迫相关元件[20]。因此,本研究分析了在乙烯利和水杨酸处理下的表达模式,发现乙烯利处理早期,可显著诱导表达,但随处理时间的延长,的表达量逐渐降低。而水杨酸处理后,、、、、的表达受到显著抑制,说明玉米中的水杨酸信号途径可能也对乙烯的生物合成具有抑制作用。
3.3 病菌侵染对ZmACO表达的影响
乙烯不仅是促进果实成熟、叶片衰老等一般的植物激素,更是重要的植物防卫激素。植物在受到病菌侵染时,会诱导乙烯的生物合成,进而通过信号传递,使下游抗病基因被诱导表达[39]。植物响应病菌侵染中的表现研究相对较少。水稻矮缩病毒会使过表达,导致水稻发病更加严重,而沉默水稻对矮缩病毒的抵抗能力变强。因为SAM为乙烯生物合成的底物,过表达使SAM含量增加,进而使水稻乙烯的产生量增加,从而使水稻抵抗矮缩病毒的能力减弱。将乙烯信号通路阻断,可显著增强水稻对矮缩病毒的耐受性[26]。这些证据表明的表达可以对生物胁迫作出响应。本研究采用的3种病菌均为半活体营养型真菌,被检测的6个基因在玉米响应病原真菌侵染过程中表达量均产生变化,其中表达量在3种病菌接种后均发生显著变化。而则在立枯丝核菌侵染中表达变化活跃,对玉米大斑病菌侵染有响应。此外,、对玉米大斑病菌侵染的响应相对滞后。推测参与玉米对病原真菌的响应过程,但可能存在不同的调控机制,后续将针对这些基因进行进一步的功能验证。
4 结论
在玉米B73自交系的基因组数据库中鉴定出16个。的表达具有明显的时空特异性。的表达受乙烯利影响最大,的表达受水杨酸影响最大。同时也参与玉米对病原真菌侵染的响应过程。
[1] 柳兵, 张辰, 王宇琪, 赵仁贵. 玉米自交系I18人工接种大斑病菌的mRNA表达分析. 东北农业科学, 2019, 44(5): 43-47.
Liu B, Zhang C, Wang Y Q, Zhao R G. Analysis of mRNA expression of maize inbred line I18 after artificial inoculating with. Journal of Northeast Agricultural Sciences, 2019, 44(5): 43-47. (in Chinese)
[2] BURG S P, BURG E A. Ethylene action and the ripening of fruits. Science, 1965, 148(3674): 1190-1196.
[3] Bleecker A B, KENDE H. Ethylene: A gaseous signal molecule in plants. Annual Review of Cell and Developmental Biology, 2000, 16: 1-18.
[4] Wen C K. Ethylene in plants. Netherlands: Springer, 2015.
[5] 刘畅宇, 陈勋, 龙雨青, 陈娅, 刘湘丹, 周日宝. 乙烯生物合成及信号转导途径中介导花衰老相关基因的研究进展. 生物技术通报, 2019, 35(3): 171-182.
Liu C Y, Chen X, Long Y Q, Chen Y, Liu X D, Zhou R B. research advances in genes involved in ethylene biosynthesis and signal transduction during flower senescence. Biotechnology Bulletin, 2019, 35(3): 171-182. (in Chinese)
[6] 李栀恩. 番茄ACC氧化酶家族基因的表达研究及其在果实乙烯合成过程中的功能分析[D]. 重庆: 重庆大学, 2012.
Li Z E. Characterization and function analysis of ACC oxidase gene family in ethylene biosynthesis in tomato fruit[D]. Chongqing: Chongqing University, 2012. (in Chinese)
[7] Mattoo A K, Achilea O, Fuchs Y, Chalutz E. Membrane association and some characteristics of the ethylene forming enzyme from etiolated pea seedlings. Biochemical and biophysical research communications, 1982, 105(1): 271-278.
[8] McGarvey D J, Christoffersen R E. Characterization and kinetic parameters of ethylene-forming enzyme from avocado fruit. The Journal of biological chemistry, 1992, 267(9): 5964-5967.
[9] Slater A, Maunders M J, Edwards K, Schuch W, Grierson D. Isolation and characterisation of cDNA clones for tomato polygalacturonase and other ripening-related proteins. Plant Molecular Biology, 1985, 5: 137-147.
[10] Pan G, Lou C F. Isolation of an 1-aminocyclopropane-1-carboxylate oxidase gene from mulberry (L) and analysis of the function of this gene in plant development and stresses response. Journal of plant physiology, 2008, 165(11): 1204-1213.
[11] 金太成, 郎晨婧, 孟大伟, 王悦, 吴艳菊, 杨丽萍. 非生物胁迫激活ABA途径基因的表达. 分子植物育种, 2020, 18(16): 5330-5334.
Jin T C, Lang C J, Meng D W, Wang Y, Wu Y J, Yang L P. Abiotic stress activate the expression ofgene in the ABA pathway. Molecular Plant Breeding, 2020, 18(16): 5330-5334. (in Chinese)
[12] Love J, Bjorklund S, Vahala J, Hertzberg M, KangasJARVI J, Sundberg B. Ethylene is an endogenous stimulator of cell division in the cambial meristem of. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(14): 5984-5989.
[13] Wei H L, Xue Y J, Chen P Y, Hao P B, Wei F, Sun L, Yang Y L. Genome-wide identification and functional investigation of 1-aminocyclopropane-1-carboxylic acid oxidase () genes in cotton. Plants, 2021, 10(8): 1699.
[14] 冯志聪, 邹航, 果弘毅, 钟非, 陈艳红, 余春梅, 连博琳, 张健, 刘国元. 旱柳、杞柳基因家族的全基因组鉴定及表达分析. 扬州大学学报(农业与生命科学版), 2022, 43(2): 10-19.
Feng Z C, Zou H, Guo H Y, Zhong F, Chen Y H, Yu C M, Lian B L, Zhang J, Liu G Y. Genome-wide identification and expression analysis ofgene family inand. Journal of Yangzhou University (Agricultural and Life Science Edition), 2022, 43(2): 10-19. (in Chinese)
[15] Woodson W R, Park K Y, Drory A, Larsen P B, Wang H. Expression of ethylene biosynthetic pathway transcripts in senescing carnation flowers. Plant physiology, 1992, 99(2): 526-532.
[16] 朱家红, 李超燕, 范鸿雁, 胡福初, 罗志文, 张治礼. 菠萝ACC氧化酶基因的克隆与表达分析. 基因组学与应用生物学, 2018, 37(1): 339-344.
Zhu J H, Li C Y, Fan H Y, Hu F C, Luo Z W, Zhang Z L. Cloning and expression analysis of ACC oxidase gene(L. Merr.). Genomics and Applied Biology, 2018, 37(1): 339-344. (in Chinese)
[17] 雷明, 王加宾, 李志英, 徐立. 蜻蜓凤梨基因的克隆及乙烯响应特性分析. 西北农业学报, 2018, 27(12): 1795-1803.
Lei M, Wang J B, Li Z Y, Xu L. Cloning and expression analysis ofresponse to exogenous ethephon treatment in. Acta Agriculturae Boreali-occidentalis Sinica, 2018, 27(12): 1795-1803. (in Chinese)
[18] 余建, 刘长英, 赵爱春, 王传宏, 蔡雨翔, 余茂德. 桑树1-氨基环丙烷-1-羧酸氧化酶基因()启动子功能分析. 作物学报, 2017, 43(6): 839-848.
Yu J, Liu C Y, Zhao A C, Wang C H, Cai Y X, Yu M D. Functional analysis of 1-aminocyclopropane-1-carboxylate oxidase gene’s promoter in mulberry. Acta Agronomica Sinica, 2017, 43(6): 839-848. (in Chinese)
[19] 金乌云. 甜瓜基因家族成员的鉴定及和基因的克隆[D]. 呼和浩特: 内蒙古大学, 2017.
Jin W Y. Identification ofgene family members and cloning ofandgene in melon[D]. Hohhot: Inner Mongolia University, 2017. (in Chinese)
[20] 杨利艳, 边璐, 史瑞翔, 王创云, 邓妍, 张丽光, 赵丽, 郭虹霞, 秦丽霞, 王美霞. 玉米ACO家族的全基因组鉴定与表达分析. 湖南师范大学自然科学学报, 2022, 45(3): 109-116.
Yang L Y, Bian L, Shi R X, Wang C Y, Deng Y, Zhang L G, Zhao L, Guo H X, Qin L X, Wang M X. Genome-wide identification and expression analysis of ACO family in maize. Journal of Natural Sciences of Hunan Normal University, 2022, 45(3): 109-116. (in Chinese)
[21] 朱丽颖, 陈凯, 汪耀富, 李泽锋, 谢小东, 潘婷, 杨小年, 蒲文宣, 曹培健, 杨军, 罗朝鹏. 烟草基因家族鉴定和二氯喹啉酸药害条件下的表达分析. 烟草科技, 2022, 55(9): 10-18.
Zhu L Y, Chen K, Wang Y F, Li Z F, Xie X D, Pan T, Yang X N, Pu W X, Cao P J, Yang J, Luo C P. Identification of tobaccogene family and its expression analysis under quinclorac phytotoxicity. Tobacco Technology, 2022, 55(9): 10-18. (in Chinese)
[22] Gao Y, Li J, Pan X K, Liu D R, Napier R, Dong L Y. Quinclorac resistance induced by the suppression of the expression of 1-aminocyclopropane-1-carboxylic acid (ACC) synthase and ACC oxidase genes invar. Pesticide Biochemistry and Physiology, 2018, 146: 25-32.
[23] 朱璇, 侯媛媛, 王英, 齐会楠. 水杨酸处理对杏果实呼吸速率和乙烯生物合成的影响. 食品研究与开发, 2013, 34(24): 251-253.
Zhu X, Hou Y Y, Wang Y, Qi H N. Effect of salicylic acid treatment on respiratory rate and ethylene biosynthesis of apricot fruits. Food Research and Development, 2013, 34(24): 251-253. (in Chinese)
[24] 田世平, 罗云波, 宫钦钦, 刘红. 病菌侵染对番茄果实乙烯生成, ACC合成酶和脂氧合酶活性的影响. 植物病理学报, 2002, 32(2): 159-164.
Tian S P, Luo Y B, Gong Q Q, Liu H. Effect of fungal infection on ethylene production, acc synthase and lipoxygenase activity in tomato fruits. Acta Phytopathologica Sinica, 2002, 32(2): 159-164. (in Chinese)
[25] 李文彬, 李春强, 孙建波, 彭明. 枯萎病菌侵染后香蕉乙烯形成酶基因及乙烯响应因子表达水平分析. 基因组学与应用生物学, 2014, 33(5): 1013-1018.
Li W B, Li C Q, Sun J B, Peng M. Expression analysis ofandf. sp.. Genomics and Applied Biology, 2014, 33(5): 1013-1018. (in Chinese)
[26] Zhao S S, Hong W, Wu J G, Wang Y, Ji S Y, Zhu S Y, Wei C H, Zhang J S, Li Y. A viral protein promotes host SAMS1 activity and ethylene production for the benefit of virus infection. eLife, 2017, 6: e27529.
[27] Fan X T, MATTHEIS J P, FELLMAN J K. Inhibition of apple fruit 1-aminocyclopropane-1-carboxylic acid oxidase activity and respiration by acetylsalicylic acid. Journal of Plant Physiology, 1996, 149(3/4): 469-471.
[28] Chen H M, Sun J J, Li S, Cui Q Z, Zhang H M, Xin F J, Wang H S, Lin T, Gao D L, Wang S H, Li X, Wang D H, Zhang Z H, Xu Z H, Huang S W. An ACC oxidase gene essential for cucumber carpel development. Molecular Plant, 2016, 9(9): 1315-1327.
[29] Kahana A, Silberstein L, Kessler N, Goldstein R S, Perl-Treves R. Expression of ACC oxidase genes differs among sex genotypes and sex phases in cucumber. Plant molecular biology, 1999, 41(4): 517-528.
[30] Binnie J E, Mcmanus M T. Characterization of the 1- aminocyclopropane-1-carboxylic acid (ACC) oxidase multigene family ofBorkh. Phytochemistry, 2009, 70(3): 348-360.
[31] Ruperti B, Bonghi C, Rasori A, Ramina A, Tonutti P. Characterization and expression of two members of the peach 1-aminocyclopropane-1-carboxylate oxidase gene family. Physiologia plantarum, 2001, 111(3): 336-344.
[32] 王爱勤, 杨丽涛, 王自章, 韦宇拓, 何龙飞, 李杨瑞. 甘蔗ACC氧化酶全长cDNA的克隆及序列分析. 广西植物, 2006, 26(2): 194-199.
Wang A Q, Yang L T, Wang Z Z, Wei Y T, He L F, Li Y R.Cloning and sequencing of full-length cDNA encoding ACC oxidase in sugarcane. Guihaia, 2006, 26(2): 194-199. (in Chinese)
[33] Ning Q, Jian Y N, Du Y F, Li Y F, Shen X M, Jia H t, Zhao R, Zhan J m, Yang F, Jackson D, Liu L, Zhang Z x. An ethylene biosynthesis enzyme controls quantitative variation in maize ear length and kernel yield. Nature communications, 2021, 12: 5832.
[34] 刘晓庆. 玉米籽粒响应乙烯利处理的生理及分子机制研究[D]. 北京: 中国农业大学, 2018.
Liu X Q. The physiological and molecular mechanism of maize kernel development after ethephon treatment[D]. Beijing: China Agricultural University, 2018. (in Chinese)
[35] Wang C Q, Dai S Y, Zhang Z L, Lao W Q, Wang R Y, Meng X Q, Zhou X. Ethylene and salicylic acid synergistically accelerate leaf senescence in. Journal of Integrative Plant Biology, 2021, 63(5): 828-833.
[36] Yu X D, Xu Y R, Yan S P. Salicylic acid and ethylene coordinately promote leaf senescence. Journal of Integrative Plant Biology, 2021, 63(5): 823-827.
[37] Derksen H, Rampitsch C, Daayf F. Signaling cross-talk in plant disease resistance. Plant Science, 2013, 207: 79-87.
[38] 李光哲, 李玲美, 姚展鹏, 柳福丹. 乙烯和水杨酸信号转导在拟南芥对聚乙二醇胁迫应答中的相互作用. 沈阳师范大学学报(自然科学版), 2017, 35(2): 214-219.
Li G Z, Li L M, Yao Z P, Liu F D. Interaction between ethylene- and salicylic acid-signaling inresponse to polyethylene glycol stress. Journal of Shenyang Normal University (Natural Science Edition), 2017, 35(2): 214-219. (in Chinese)
[39] Wang X Y, Meng H C, Tang Y X, Zhang Y S, He Y X, ZHOU G J, MENG X Z. Phosphorylation of an ethylene response factor by MPK3/MPK6 mediates negative feedback regulation of pathogen- induced ethylene biosynthesis in. Journal of Genetics and Genomics, 2022, 49(8): 810-822.
Bioinformatics and expression pattern analysis of maizegene family
WANG ChengZe1, ZHANG Yan1, FU Wei2, JIA JingZhe1, DONG JinGao1, SHEN Shen1, HAO ZhiMin1
1College of Life Science, Hebei Agricultural University/State Key Laboratory of North China Crop Improvement and Regulation/ Hebei Bioinformatic Utilization and Technological Innovation Center for Agricultural Microbes/Hebei Key Laboratory of Plant Physiology and Molecular Pathology, Baoding 071000, Hebei;2Handan College, Handan 056005, Hebei
【Objective】The objective of this study is to perform the genome-wide identification of the maize(1-aminocyclopropane- 1-carboxylate oxidase) gene family, analyze its expression patterns in different organs and developmental stages of maize, as well as in response to exogenous hormones and pathogen infection, and to lay the foundation for clarifying the function of the maizegene family.【Method】Using bioinformatics methods, thewas identified in the genome of maize B73 inbred line, and its gene structure, protein physicochemical properties, phylogenetic relationships among family members, and conserved motifs were analyzed. The expression patterns of thegene family were analyzed using real-time fluorescence quantitative PCR (qRT-PCR) technology.【Result】Except for ZmACO11, all members of the ZmACO family have Fe2+binding sites and substrate ascorbic acid binding sites. The phylogenetic tree showed thatandare in the same branch and have a close genetic relationship, with a Bootstrap value of 98. The gene expression analysis indicated that,,,,andwere actively expressed at various developmental stages and exhibited dominant expression in leaves, so the six genes mentioned above were selected for the next step of testing. Spraying ethephon resulted in fluctuations in the expression of all six genes mentioned above, the expression level ofwas significantly affected, with a variation multiple of about 8 times. The expression levels of these six genes fluctuated within 0-24 h of ethephon treatment. But after 24 h of treatment, all gene expression levels were close to 0. After salicylic acid treatment, the expression level ofwas significantly affected, with a variation multiple of about 2 times. The expression levels of other genes were close to 0 at 24 h after treatment. The expression levels of,fluctuated between 3 to 12 h, and the expression levels of,,showed a downward trend. In response to biological stress, the expression levels of,showed the greatest changes after inoculation with the, and on the 10th day after inoculation, the expression levels of these two genes increased by 50 and 60 times, respectively, compared to the control group. After inoculation with the, the expression level ofchanged significantly, with a variation multiple of 40-90 times. After inoculation with, the expression levels of,showed the greatest changes, reaching 200 times on the 3rd day of inoculation.【Conclusion】The expression changes of,,andare most active during the growth and development of maize; The application of exogenous ethephon and salicylic acid can significantly affect the expression level ofgenes. The expression level ofgenes significantly changes after bacterial infection in maize, which is closely related to the response to biological stress.
maizegene family; qRT-PCR; gene expression; ethephon; salicylic acid;;;
10.3864/j.issn.0578-1752.2024.07.008
2023-10-31;
2023-12-09
河北省自然科学基金(C2021204112)、河北省省级科技计划(23567601H)、国家玉米产业技术体系(CARS-02)
王程泽,E-mail:2060848550@qq.com。张燕,E-mail:2419298400@qq.com。王程泽和张燕为同等贡献作者。通信作者郝志敏,E-mail:haozhimin@hebau.edu.cn。通信作者申珅,E-mail:shenshen0428@163.com
(责任编辑 岳梅)
