重度窒息新生儿耳聋基因突变的检出率分析*
2024-04-11甘进锦柯燕玲冯海燕
甘进锦 柯燕玲 冯海燕 李 超
广东省茂名市人民医院新生儿科 525000
新生儿窒息是因为在产前、产中或是产后由多种病因,造成胎儿因氧气不足而出现了宫内窘迫或在分娩的过程中发生了呼吸功能障碍、循环障碍等,致使新生儿出生后1min内没有自主呼吸或无法建立规律呼吸,以高碳酸血症、低氧血症以及酸中毒等为其主要病理生理变化的疾病[1]。重度新生儿窒息会导致新生儿出现严重缺氧,进而发生缺氧缺血性脑病。遗传性耳聋症是临床中最为普遍的一种先天畸形,严重地危害着人们的身体健康,现已成为一个全球热议问题[2]。研究[3]表明,我国新生儿耳聋发生率高达3%左右,其中基因是导致耳聋的主要原因,高达60%以上。耳聋相关基因具有较强的遗传与民族差异,其中GJB2、SLC26A4、12SrRNA以及GJB3是我国现阶段最普遍的4个致病基因。基因突变位点的确定鉴定,为耳聋病因的精确诊断,新生儿遗传筛查,育龄夫妇的婚育指导、防止药源性耳聋等诸多方面具有重要意义[4]。基于此,本研究通过对我院30例重度窒息耳聋新生儿及30例耳聋新生儿进行基因突变位点检测,并对其基因突变位点进行分析,现报道如下。
1 资料与方法
1.1 一般资料 收集2021年1月—2023年4月我院遗传中心30例重度窒息耳聋新生儿(观察组)以及30例耳聋新生儿(对照组)作为研究对象。两组新生幼儿父母均知情本次研究,并签署知情合同书。
1.2 耳聋基因筛查方法 耳聋基因筛查是通过血液提取DNA,采取基因芯片技术结合数据分析,对四个耳聋相关基因(GJB2、SLC26A4、GJB3和线粒体12SrRNA)的20个致聋突变位点进行检测。
1.2.1 DNA提取方法。重度窒息耳聋新生儿采集其足跟血干血斑,耳聋新生儿采集其抗凝全血3mL,根据广东凯普生物技术有限公司提供的血干血斑基因 DNA萃取试剂盒以及天根生物技术提供的血液基因组DNA提取试剂盒,严格按照使用说明书对样品的纯度及其浓度进行测定,其中抗凝性的全血DNA含量≥1μg,干血斑点DNA含量≥200ng,并且A260/A280值为1.4~2.5,符合要求的样品DNA暂时存放在-20℃环境下,以待处理。
1.2.2 PCR 扩增。使用潮州凯普生物化学有限公司的导流杂交技术(Flow-through hybridization)以及耳聋易感基因检测试剂盒(PCR+导流杂交法)对常见耳聋基因进行检测,包括遗传性耳聋的4个相关基因,共有20个热点突变位点:GJB2基因包含:299-300delAT、176-191del16、235delC、167delT、35delG突变;GJB3基因包含:538C>T及547G>A突变;SLC26A4基因包含:589G>A、281C>T、IVS7-2A>G、1975G>C、1226G>A、1174A>T、1229C>T、2162C>T、2027T>A、IVS15+5G>A以及2168A>G突变;12SrRNA基因包含:1494C>T及1555A>G突变。扩增结束后,继续进行杂交和显色。
2 结果
2.1 两组患者总突变率对比 观察组中共检出耳聋基因突变11例,总突变携带率为36.67%(11/30),对照组中共检出耳聋基因突变2例,总突变携带率为6.67%(2/30)。
2.2 两组单杂合突变检测对比 观察组单杂合单基因突变有11例,其中GJB2基因突变携带率为16.67%(5/30),SLC26A4基因突变携带率为13.33%(4/30),GJB3基因突变携带率为3.33%(1/30),12SrRNA基因突变携带率为3.33%(1/30);对照组单杂合单基因突变有2例,其中GJB2基因突变携带率为3.33%(1/30),SLC26A4基因突变携带率为3.33%(1/30),见表1。
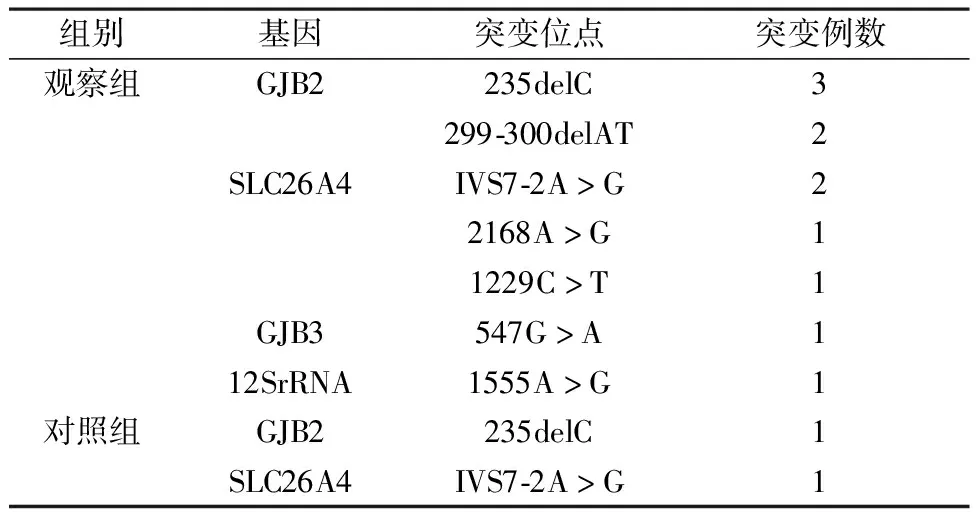
表1 两组耳聋基因单杂合突变检测对比
2.3 两组复合杂合突变检测对比 观察组复合杂合基因突变检测结果显示,有2例单基因复合杂合突变,2例双基因复合杂合突变,对照组未发生复合杂合基因突变,见表2。
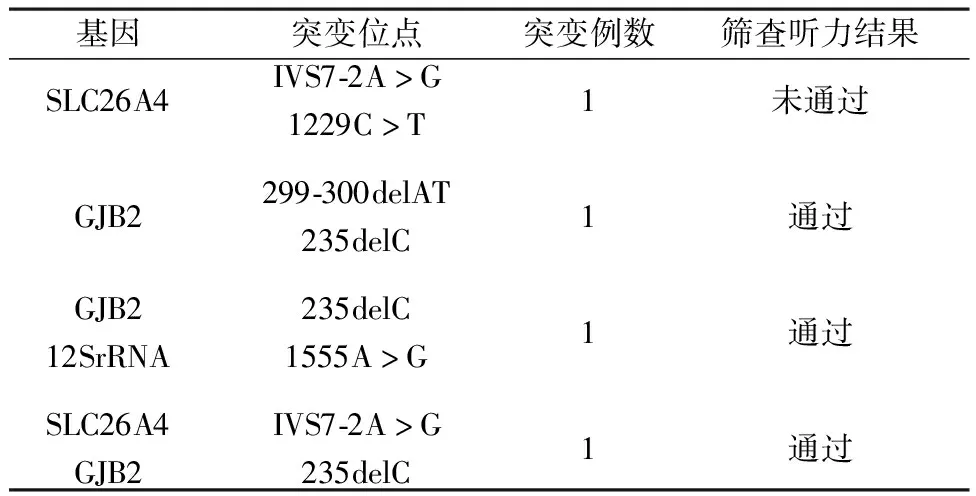
表2 观察组耳聋基因复合杂合突变检测对比
2.4 突变位点数检测 观察组在20个突变点位当中,共检出7个突变点位,其中GJB2基因的235delC点位检出率最高,合计检出3例,占总检出率的27.27%(3/11);而GJB2基因的299-300delAT点位与SLC26A4基因的IVS7-2A>G点位均各检测出2例,均占总检出率的18.18%(2/11),见表1和表2。
3 讨论
3.1 对重度窒息新生儿耳聋基因突变筛查的重要性及必要性 耳聋是造成新生儿质量下降的主要原因之一[5]。我国对耳聋十分关注,随着社会的不断进步,新生儿的听力检查也逐渐发展起来。在我国广东地区对新生婴儿已实行免费的听力检查,且在筛查的同时发现,并非所有的耳聋患儿都会在出生后很短时间内表现出来,延迟性耳聋和药源性聋儿都可以顺利通过新生儿听力筛选[6]。研究[7]显示,60%左右的先天性耳聋患儿会伴有不同程度的遗传。通过对新生儿进行耳聋基因筛选,既能弥补听力检查的缺陷,又能对带有耳聋基因的先天性耳聋儿童做到尽早发现、尽早诊断以及尽早干预,尽可能地减少因耳聋致哑的发生,同时也能发现药物敏性的基因携带者。另外,对于具有耳聋基因且听力正常者,也可以为其在婚配、生育提供遗传优生方面的指导,进而避免遗传性耳聋的发生。
3.2 重度窒息新生儿耳聋基因突变点位与筛查携带情况分析 本研究结果显示,30例重度窒息新生儿中检出耳聋基因突变11例,总的突变携带率为36.67%。本次研究耳聋基因突变的检出率明显高于其他研究报道[8-9],考虑其原因,可能与本研究的样本量较少以及突变位点的选择上有着一定的关系。与耳聋有关的基因较多,其突变位点区域和种族也存在一定的差异。在我国,GJB2、SLC26A4以及12SrRNA是最主要的致病基因,这3种基因突变所导致的耳聋大约占遗传性耳聋80%以上,GJB2、SLC26A4以及12SrRNA所导致的耳聋占比分别在55%、17%以及6.8%。因此,大多数的新生儿耳聋的遗传学检查都是以这3种最常用的遗传学检查为主。本研究根据流行病学资料,在筛选出GJB2、SLC26A4和12SrRNA等基因时,增加了2个GJB3基因的突变位点,从而增加了筛选位点数量。GJB3是首个由我国自主克隆并鉴定的耳聋致病基因,可导致常染色体显性抑或者隐性遗传性非综合征性耳聋,在临床中被认为和高频听力下降有着一定关系[10]。本文结果显示,观察组共检出11例,总突变携带率为36.67%,其中为12SrRNA基因突变携带率为3.33%;GJB3基因突变携带率为3.33%。表示GJB3基因和12SrRNA基因在耳聋筛查上具有相同的重要作用。GJB3的携带有明显的遗传性或显性遗传病,其携带的GJB3需要对其进行长期的听力检测。同时,对发现12SrRNA基因突变的患者,也给予相应的心理辅导,告诉他们终身禁止使用氨基糖苷类药品,以免出现“一针致聋”的情况。此外,30例重度窒息新生儿共检出GJB2基因突变5例(16.67%);SLC26A4基因突变4例(13.33%),这两种基因突变的携带率与其他研究结果基本相吻合,同时也是4种基因突变携带率最高的,其中GJB2的235delC突变位点,共检出3例,占总突变的27.27%,而GJB2基因的299-300delAT点位与SLC26A4基因的IVS7-2A>G点位均各检测出2例,均占总检出率的18.18%。这3个位点在本次研究中检出率最高,占总突变的23.33%,说明这3个突变位点为重度窒息新生儿主要致聋位点。针对发现的235delC位点、299-300delAT位点以及IVS7-2A>G位点的基因突变患儿,均对其父母进行一次遗传咨询,并告诉他们在未来再次生育时,要做一次伴侣的耳聋基因检测,若伴侣是同型突变,那么孩子发生耳聋的概率是1/4。SLC26A4基因突变患儿可能会发展成后天中或重度的感音神经性耳聋,因此需要密切跟踪观察。
3.3 研究局限性亟待解决问题 本研究对20个耳聋突变位点进行了检测,但是这些突变位点并未全部涵盖所有耳聋基因,因此仍有一些遗漏,仅能用于耳聋基因的筛选。对于筛选出来的听力正常耳聋患儿,还需要进一步进行遗传学检查,以确定其致病原因,以便重新妊娠时进行产前的诊断,进而防止家庭再次出现耳聋患儿。此外,由于本研究样本数量过少,得到的结论具有一定的限制,差值比例相差较大,并不能代表所有临床,还需要后期加大样本量或通过多中心进行研究。另外,现有的筛选方法无法改善患儿耳聋这一现状,而传统的药物治疗和中药治疗对耳聋也并不具备很好的疗效。若能以此研究作为基础,对孕妇进行耳聋基因变异筛查,并对携带耳聋基因夫妇实施产前检查,可做好提前预防,避免幼儿发生遗传性耳聋,为家庭及社会减轻负担。
综上所述,重度窒息新生儿耳聋基因突变携带率相对较高,对其实施耳聋基因筛查有助于早期防治。同时还会对孕妇进行耳聋基因筛选,做好提前预防,避免出现遗传性耳聋幼儿。
