玉米芯功能性低聚糖分级纯化及抗氧化活性研究
2024-04-10孙元琳白宇仁蔡文强王晓闻
孙元琳,白宇仁,蔡文强,刘 瑞,王晓闻
(运城学院生命科学系1,运城 044000)
(农产品加工与质量安全运城市重点实验室2,运城 044000)
(山西农业大学食品科学与工程学院3,太谷 030801)
玉米芯是玉米加工过程中的主要副产物,其不溶性膳食纤维含量非常高,主要为阿拉伯木聚糖[1]。玉米芯中还含有丰富的酚酸类物质。Torre 等[2]研究表明,玉米芯中含有的酚酸物质主要是阿魏酸和对香豆酸。玉米芯中含有质量分数1.4%的阿魏酸,其阿魏酸质量分数高于麦麸(0.4% ~0.7%)、蔗渣(1.0%)、小麦秸秆(1.2%)等,是农业副产品中较具潜力的阿魏酸资源[3]。利用木聚糖酶酶解玉米芯不溶性膳食纤维,可作用于阿拉伯木聚糖链的β -1,4糖苷键,会产生功能性阿魏酰低聚糖(FOs),和阿拉伯低聚木糖(AXOs)[4]。
功能性低聚糖是由2 ~10 个单糖分子通过糖苷键连接形成,属于直链或支链的低度聚合糖[5],具有抗氧化、抗肿瘤、抑菌、调节肠道菌群结构等功能[6]。FOs和AXOs作为新型的益生元,可以特异性地促进双歧杆菌等益生菌的增殖,还可以通过发挥抗氧化作用调节肠道菌群结构,增强机体免疫力,效果优于低聚果糖[7]。FOs兼具阿魏酸和低聚木糖的功能特性,且因结构中特殊的酯键,增加了阿魏酸的水溶性,更有利于发挥其抗氧化作用[9]。目前,FOs 和AXOs因其独特的生理功效引起了越来越多学者的关注。本实验采用活性炭柱层析对玉米芯功能性低聚糖酶解液进行分离纯化,对其组成、理化性质和抗氧化活性进行分析,以期为玉米资源的综合利用和有效增值提供参考。
1 材料与方法
1.1 材料与试剂
玉米芯:山西省太谷县,大丰30;活性炭:市售。
木糖、阿拉伯糖、阿魏酸标准品、2,2 -联氮-二(3 -乙基-苯并噻唑-6 -磺酸)二铵盐、50%氢氧化钾溶液、氢氧化钠溶液、DPPH(分析纯);木聚糖酶EC3.2.1.8 酶活(60 000 U/mg);甲醇、冰乙酸、异丙醇、溴化钾(色谱纯)。
1.2 仪器与设备
Z系列层析柱,BS - 100A 自动部分收集器,DHL-A型电脑恒流泵,Cary5000 紫外-可见-近红外分光光度计,LC1200 型高效液相色谱仪,TENSOR27 型傅里叶变换红外光谱仪,ICS 1100 型离子色谱仪,FreeZone2.5 型冷冻干燥机。
1.3 实验方法
1.3.1 玉米芯功能性低聚糖酶解液分级纯化
酶解:利用木聚糖酶对玉米芯不溶性膳食纤维进行酶解,具体条件为:加酶量89.7 mg/L、酶解时间16 h、底物质量浓度111 g/L、pH 3.65、酶解温度53℃。酶解结束后于沸水浴中灭酶10 min,加入3 倍体积无水乙醇,4 ℃下醇沉过夜,之后3 000 r/min离心15min,所得上清液为玉米芯功能性低聚糖酶解液。
分级纯化:玉米芯不溶性膳食纤维酶解液上样量10 mL,加入到已经平衡好的活性炭柱(26 ×300 mm)中,依次用脱气蒸馏水和不同梯度的乙醇溶液(体积分数10%、20%、40%、60%、80%)洗脱,流速控制为1.5 mL/min,自动部分收集器以4 mL/管收集,用苯酚-硫酸法隔管在线检测总糖含量,直至检测不到糖为止,绘制洗脱曲线。
1.3.2 低聚糖聚合度分析
低聚糖检测条件:色谱柱CarboPac PA200;检测器为电化学检测器;柱温30 ℃;150 mmol/L NaOH溶液等度洗脱;流速0.4 mL/min;进样体积25 μL。通过比较样品图谱与标准品(阿拉伯糖、木糖、低聚木糖)的相对保留时间,进而判断低聚糖聚合度。
1.3.3 单糖组成分析
将待测样品溶于4 mol/L 三氟乙酸,121 ℃酸水解2 h。N2吹干后,加30 mL 超纯水溶解,进样离子色谱。检测条件:CarboPac PA 200 色谱柱;检测器为电化学检测器;柱温30 ℃;10 mmol/L KOH 溶液进行等度洗脱;流速0.4 mL/min;进样体积25 μL。通过比较样品离子色谱图与单糖标准品的相对保留时间,来判断样品中单糖种类,依据峰面积的比值确定样品单糖组成的量比。A/X 为阿拉伯糖与木糖的摩尔比值。
1.3.4 阿魏酰基团检测
分别提取各洗脱组分中游离态阿魏酸和结合态阿魏酸,用HPLC进行检测。
游离阿魏酸提取:水洗和醇洗脱组分→乙酸乙酯萃取(3 次)→有机溶剂蒸干→1 mL甲醇复溶。
结合阿魏酸提取:萃取后的水相→2 mol/L NaOH酯解→40 ℃恒温振荡过夜→离心→调酸→浓缩→萃取→蒸干→甲醇复溶[11]。
色谱条件:色谱柱C18 柱(4. 6 mm ×150 mm,5 μm);流动相:甲醇-2%乙酸;流速1.0 mL/min;检测波长:320 nm;柱温:室温;进样量10 μL;运行时间为1 h。
1.3.5 紫外光谱扫描
将待测样品溶于MOPS 缓冲液中,在220 ~400 nm波长范围内进行紫外光谱扫描。
1.3.6 红外光谱扫描
称取约2 mg的样品与KBr混合压片,于4 000 ~400 cm-1范围内进行红外光谱测试。
1.3.7 DPPH·清除能力测定
参照郭刚军等[12]的方法。将2 mL 不同浓度的3 种样品溶液与2 mL 0.2 mmol/L DPPH乙醇溶液充分混合,室温避光放置30 min 后,于517 nm 处测定吸光度值。按式(1)计算。
式中:Ai为2 mL DPPH乙醇溶液+2 mL 样液的吸光值;Aj为2 mL 无水乙醇+2 mL 样液的吸光值;Ac为2 mL 无水乙醇+2 mL DPPH 乙醇溶液的吸光值。
1.3.8 ·OH清除能力测定
参照Lee等[13]方法。吸取9 mmol/L FeSO4溶液2mL,9 mmol/L水杨酸乙醇溶液2 mL,不同浓度的样品溶液2 mL,置于比色管中,摇匀,加入2 mL 8. 8 mmol/L H2O2溶液,置于37 ℃水浴锅中恒温水浴30 min,于510 nm处测定吸光度值。按式(2)计算。
式中:Ai为样品吸光值;Aj为用蒸馏水代替H2O2的吸光值;Ac为用蒸馏水代替样液的吸光值。
1.3.9 ABTS+·清除能力测定
参照Kwon 等[14]的方法。分别配制7 mmol/L ABTS溶液和2.45 mmol/L 过硫酸钾溶液。将两者等体积混合,室温避光放置16 h。准确吸取0.1 mL样液,加入3. 9 mL ABTS 溶液,室温避光放置10 min,于734 nm处测其吸光度值。按式(3)计算。
式中:Ai为0.1 mL 样液+3.9 mL ABTS 样液的吸光值;Aj为0.1 mL 样液+3.9 mL 蒸馏水的吸光值;Ac为0.1 mL 蒸馏水+3.9 mL ABTS 溶液的吸光值。
1.3.10 脂质过氧化抑制能力测定
参照田敏等[15]方法。向比色管中依次加入0.5 mL 10 g/100 mL 蛋黄匀浆液、0. 5 mL 样品溶液、0.07 mol/L FeSO4,充分混匀,于37 ℃下水浴30 min。取出后加入1.5 mL 体积分数10%三氯乙酸溶液和1.5 mL体积分数0.8%硫代巴比妥酸溶液,沸水浴20 min,冷却后,离心10 min(3 000 r/min),取上清液于532 nm处测吸光度值。按式(4)计算。
式中:Ai为样品吸光值;Aj为未添加硫代巴比妥酸的样品反应液吸光值;Ac为用蒸馏水代替样液的吸光度值。
1.4 数据分析
所有实验均重复3 次,结果表示为平均值±标准差,运用Excel 和SPSS 软件对实验数据进行统计分析,采用Origin8.6 软件进行绘图。
2 结果与分析
2.1 活性炭柱层析洗脱曲线
采用活性炭柱层析对玉米芯功能性低聚糖酶解液(EH)进行梯度洗脱,洗脱曲线如图1 所示。EH 经分离得到6 个洗脱峰,分别为水洗脱组分(WO)、体积分数10%乙醇洗脱组分(EO -10)、体积分数20%乙醇洗脱组分(EO -20)、体积分数40%乙醇洗脱组分(EO -40)、体积分数60%乙醇洗脱组分(EO -60)、体积分数80%乙醇洗脱组分(EO -80)。
2.2 低聚糖聚合度分析
采用离子色谱对活性炭柱层析洗脱组分的低聚糖聚合度进行检测,其中各洗脱组分中低聚糖的含量如表1 所示。WO组分主要由DP2、DP3 和DP4 构成,EO-10 组分主要由DP2 和DP3 构成,EO-20 组分主要由DP2、DP3 和DP4 构成。EO -40、EO -60和EO-80组分不仅含有聚合度较低的低聚糖(DP2 ~DP4),还含有聚合度更高的低聚糖。随着乙醇浓度的升高,DP2 和DP3 的含量逐渐降低,而DP5 和DP7的含量逐渐升高。研究结果表明,低聚糖聚合度越高所需洗脱的乙醇浓度也就越高。

表1 活性炭柱层析洗脱组分的低聚糖组成
2.3 单糖组成分析
WO和EO的单糖组成如表2 所示。WO、EO 的单糖均由木糖和阿拉伯糖组成,且木糖是主要的单糖组成成分,另外还含有少量的葡萄糖和半乳糖。WO中各单糖摩尔比为Ara∶Xyl∶Glc∶Gal =1.00∶1.86∶0.17∶0.13,分支度A/X =0.54;EO中各单糖的摩尔比为Ara∶Xyl∶Glc∶Gal =1.00∶3.12∶0.19∶0.12,分支度A/X =0.32。WO 较高的分支度更有利于阿魏酰基团连接在阿拉伯糖残基上。

表2 活性炭柱层析洗脱组分的低聚糖组成
2.4 阿魏酰基团检测
通过HPLC对活性炭水洗脱组分和醇洗脱组分中的游离态及结合态阿魏酸进行检测。由图2 可以看出,水洗脱组分WO 中的阿魏酸主要以结合态形式存在,而游离态形式阿魏酸未检出(图略);醇洗脱组分EO 中的游离态和结合态阿魏酸均未检出(图略),表明醇洗脱组分EO 中不含阿魏酰基团。

图2 水洗脱组分(WO)结合态阿魏酸HPLC图谱
2.5 红外光谱分析
采用傅里叶变换红外光谱对洗脱组分进行检测,结果如图3 所示。WO和EO均具有糖类物质的特征吸收峰,3 200 ~3 600 cm-1出现的宽峰是O—H伸缩振动吸收的结果,2 925 cm-1附近出现的吸收峰是由于糖类的C—H伸缩振动引起的,1 200 ~1 400 cm-1的一组峰属于糖类C—H 的变角振动。897 cm-1附近的吸收峰,是吡喃糖β-型C—H变角振动的特征吸收峰。WO 在1 735 cm-1附近出现的吸收峰是酯键的特征吸收峰,表明WO 中阿魏酸酯的存在。而EO在1 735 cm-1不存在明显的吸收峰,表明样品中不含阿魏酰基团。

图3 水洗脱组分(WO)和醇洗脱组分(EO)红外光谱图
2.6 紫外光谱分析
分别对标准品阿魏酸(FA)、活性炭水洗组分WO及醇洗组分EO 进行紫外波长扫描,结果如图4所示。阿魏酸标准品在286 nm附近有最大吸收峰,而WO在325 nm附近有最大吸收值,由此推断WO中含有结合态阿魏酸。而EO 在286 nm 和325 nm处均未出现明显吸收峰,表明EO 中不含阿魏酰基团。此结果与阿魏酰基团检测、单糖组成和红外光谱分析结果相符合。

图4 水洗脱组分(WO)和醇洗脱组分(EO)紫外波长扫描图
2.7 抗氧化活性
2.7.1 DPPH·清除能力
酶解组分EH、纯化组分WO、EO对DPPH·清除能力如图5 所示。3 种不同组分均对DPPH·有不同程度的清除作用。当样品质量浓度为10 mg/mL时,EH的清除率可达到87.29%、经纯化后WO 可以达到92.29%、EO 为73.59%,其清除能力强弱依次为WO >EH >EO。酚酸抗氧化剂可以通过酚羟基的O-H键直接断裂给出氢原子,清除DPPH·,还可以直接将电子转移给DPPH·,转化为反应活性低的阴离子[17]。WO和EO相比,WO的DPPH·清除能力强于EO,是因为WO 结构中含有结合态阿魏酸,抗氧化活性较高,然而EO 结构中不含结合态阿魏酸,因此清除率较低。

图5 酶解组分及其纯化组分对DPPH·的清除能力
2.7.2 ·OH清除能力
酶解组分EH、纯化组分WO、EO 对·OH 清除能力如图6 所示。实验采用的是Fenton反应体系,3 种不同组分均具有清除·OH 的能力,且呈剂量效应关系,当样品质量浓度为10 mg/mL 时,WO 清除能力最强为91.54%,EH 次之为47.75%,EO 清除能力最弱为40.47%。EH和WO具有清除羟基自由基的作用与结构中阿魏酸的存在密切相关[18]。阿魏酸苯环上的给电子基团能有效终止自由基链式反应,而EO结构中含有大量活性羟基,羟基是活泼的氢供体,氢离子可以为自由基提供电子,生成稳定的碳自由基和水,从而起到清除·OH的作用,但相对于WO,其清除能力较低[19]。
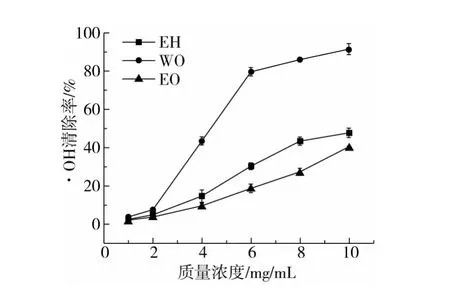
图6 酶解组分及其纯化组分对·OH的清除能力
2.7.3 ABTS+·清除能力
酶解组分EH、纯化组分WO、EO清除ABTS+·能力如图7 所示。3 种不同组分对ABTS+·均具有较强的清除作用,当样品质量浓度为10 mg/mL时,EH的清除率达到85.92%,经纯化后WO清除率最高为93.04%,EO 清除效果略弱为82.65%,其清除能力强弱依次为WO >EH >EO。EH 及其纯化组份WO、EO均为多羟基化合物,羟基可以提供氢离子与ABTS+·有效结合,从而起到消除ABTS+·的作用。

图7 酶解组分及其纯化组分对ABTS +·的清除能力
2.7.4 脂质过氧化抑制能力
酶解组分EH、纯化组分WO、EO 抑制脂质过氧化能力如图8 所示。酶解组分EH、纯化组分WO、EO均对脂质过氧化具有一定的抑制作用。当样品质量浓度为1 ~6 mg/mL 时,EO 与EH、WO 相比相差较大;当样品质量浓度>6 mg/mL,三者相差较小,其清除能力强弱依次为WO >EH >EO。低聚糖结构中含有大量的羟基、羧基等活性基团可以直接作用于自由基,阻断或减缓脂质过氧化的进行。阿魏酸结构中所含的羧基可以通过结合酚酸和脂质双分子层,减少脂质过氧化的发生[20]。EO结构中不含阿魏酸,因此抑制脂质过氧化的能力低于WO。
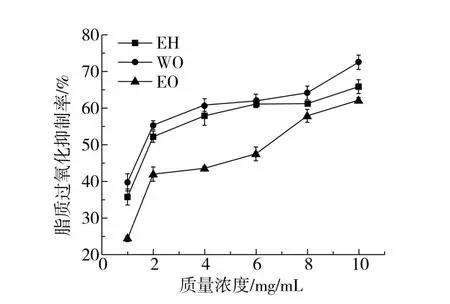
图8 酶解组分及其纯化组分抑制脂质过氧化能力
3 结论
玉米芯酶解液(EH)经活性炭柱层析分离纯化得到水洗脱组分(WO)和不同浓度醇洗脱组分(EO)。WO 的低聚糖聚合度主要为DP2 ~DP4,EO-10、EO - 20 的低聚糖聚合度主要为DP2 和DP3,EO - 40、EO - 60 和EO - 80 组分不仅含有DP2 ~DP4,还含有聚合度更高的低聚糖。单糖组成表明,WO和EO主要由Ara和Xyl组成,分支度A/X分别为0.54 和0.32。WO含有结合态阿魏酸,为阿魏酰阿拉伯低聚木糖;而EO 不含阿魏酸,为阿拉伯低聚木糖。EH及其纯化组分WO、EO均具有一定的清除自由基(DPPH·、·OH、ABTS+·)能力和抑制脂质过氧化能力,且WO抗氧化活性最高。结果表明,阿魏酰阿拉伯低聚木糖具有较强的抗氧化能力,且抗氧化活性主要来源于阿魏酰基团。
