透析通路相关的肿胀手综合征合并缺血综合征1例
2024-04-10魏媛媛许姝琦唐利军孔祥雷王尊松
魏媛媛 许姝琦 唐利军 曹 维 孔祥雷 王尊松
1.山东第一医科大学第一附属医院(山东省千佛山医院)肾病学科,山东 济南 250014;2.寿光市人民医院肾内科,山东 潍坊 262700
自体动静脉内瘘(autologous arteriovenous fistula, AVF)是维持性血液透析患者常用的透析通路,随着患者透析龄延长,内瘘血管狭窄、血栓形成、动脉瘤形成、感染、透析通路相关肿胀手综合征(swelling hand syndrome, SHS)及透析通路相关缺血综合征(dialysis access-associated ischemic steal syndrome, DASS)等血管通路相关的并发症发生风险逐渐升高。在临床实践中,SHS 同时合并DASS的病例相对少见,现将我科成功诊治的1例AVF 相关的SHS多次复发合并DASS的病例进行报道。
1 病例资料
1.1 一般资料
患者,女,55岁,因蛋白尿15年,血液透析2年,左前胸壁静脉曲张5个月于2020年8月15日第1次来山东第一医科大学第一附属医院就诊。患者诊断系统性红斑狼疮、狼疮性肾炎15 年余,期间未规律用药及随访。4 年前血肌酐开始升高,初为200 μmol/L左右,3年前出现纳差、憋喘,伴双下肢水肿、尿量减少,血肌酐逐渐升高至689.5 μmol/L,考虑肾衰合并心力衰竭,经右侧颈内静脉置管行血液透析治疗,病情缓解后行右侧AVF 术,同时给予免疫抑制剂治疗,透析半年后,患者尿量逐渐恢复,血肌酐波动在300 μmol/L 左右,暂停血液透析,期间右侧AVF失功。2年前患者再次出现恶心、纳差、乏力,血肌酐波动在570 ~ 600 μmol/L,超声提示双肾萎缩,实质回声增强,诊断为慢性肾脏病5 期、狼疮性肾炎,后行左侧肱动脉—头静脉内瘘术,内瘘成熟后维持每周3次透析治疗。2020年4月14日患者因左上肢肿胀、前胸壁静脉曲张1月于外院就诊,行血管造影示左锁骨下静脉闭塞,于4月21日在数字减影血管造影(digital subtraction angiography,DSA)下行左锁骨下静脉支架置入术(金属裸支架,具体型号不详),患者上肢肿胀缓解,病情好转出院。1 月前患者颈部及左侧前胸壁静脉曲张加重,左上肢较右侧肿胀,指端发绀、发凉,伴有静息痛,透析时静脉压力为200 mmHg(1 mmHg = 0.133 kPa),为进一步诊治来我院住院治疗。
1.2 诊疗经过
血管通路物理检查:左上肢肿胀,指端发绀,局部皮温低,触之有疼痛感,内瘘杂音及震颤减弱,左上臂至胸壁血管迂曲,局部可触及震颤,血管杂音明显。血管超声检查:端侧吻合口直径约8 mm,静脉流出道经肘窝正中静脉汇合到贵要静脉、腋静脉及锁骨下静脉,血管迂曲通畅,未见明显狭窄(图1)。
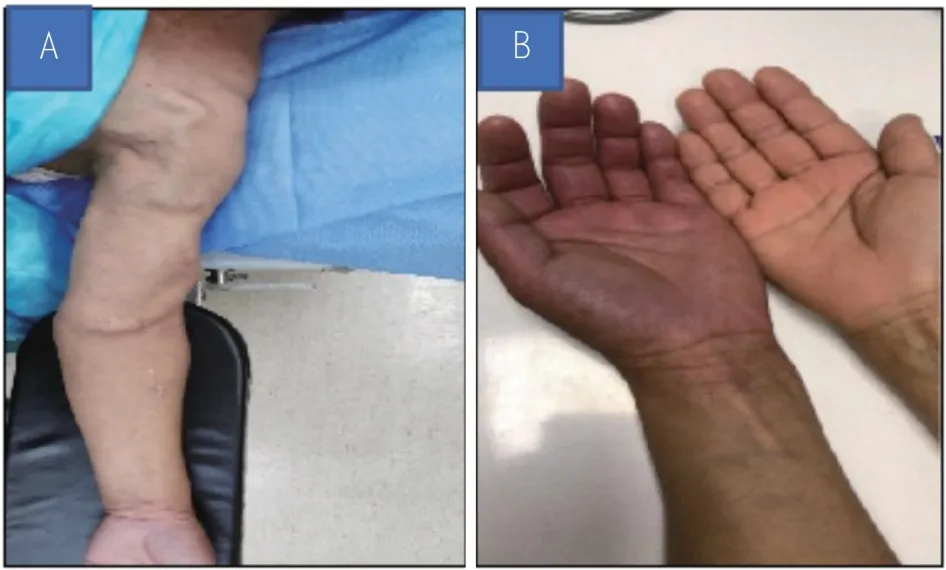
图1 SHS合并DASS患者术前评估
患者知情同意后,于2020 年8 月19 日行AVF及中心静脉造影术,结果显示左侧头臂静脉支架远端管腔狭窄,右侧锁骨下静脉血管通畅,颈内静脉起始段管腔狭窄,行经皮血管内成形术(percutaneous transluminal angioplasty,PTA),沿导丝送入PTA 球囊扩张导管反复扩张左侧头臂静脉支架狭窄段2次,再次造影显示血流恢复(图2)。
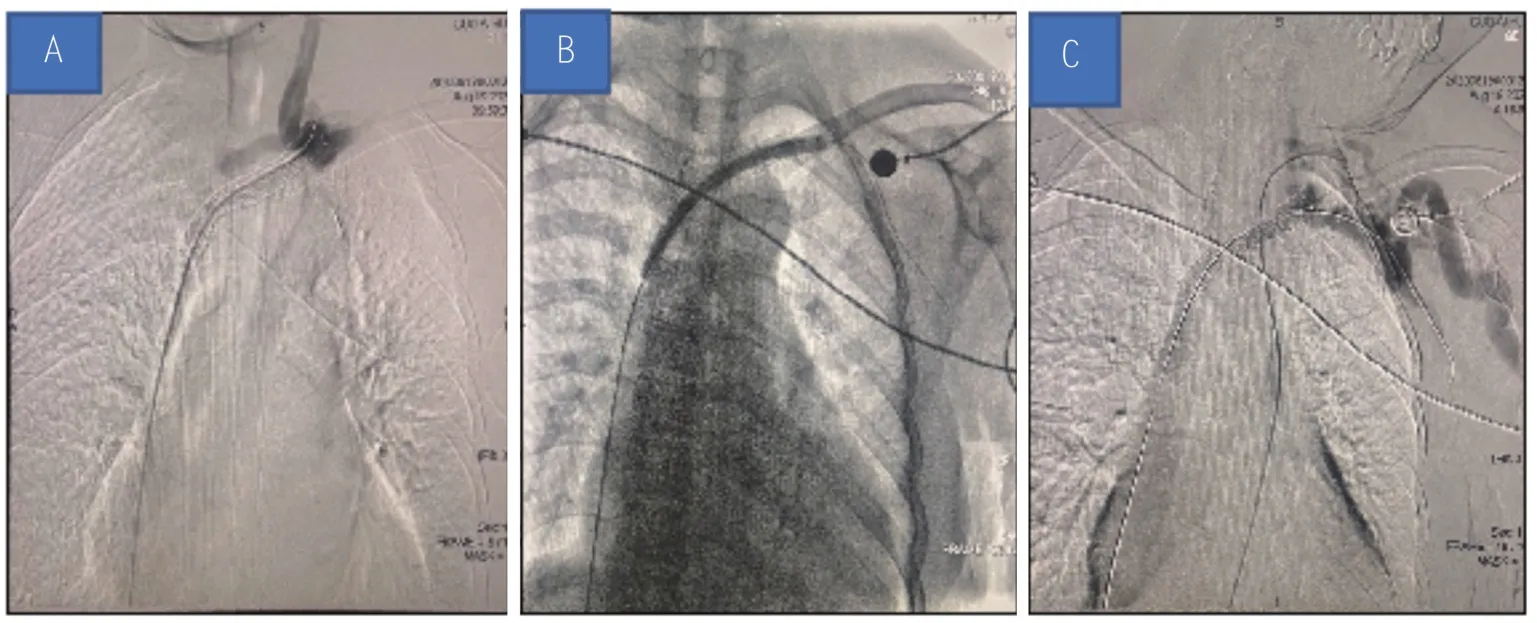
图2 SHS合并DASS患者经皮血管内成形术
患者经PTA 治疗后,中心静脉通畅,但内瘘侧肢体远端仍发凉,疼痛未缓解。完善左上肢血管B超,测上臂肱动脉血流量1 389 mL/min,考虑合并DASS,取得患者知情同意后,于2020年8月21日在局麻下行AVF改良Miller法限流术。手术过程简介如下:(1)在肘窝内侧上方2 cm 处做3 cm 斜行手术切口,钝性分离皮下组织,充分游离肱动脉;(2)在肘窝外侧上方4 cm处做一斜行手术切口,钝性分离皮下组织,游离头静脉;(3)静脉下方置双股扎线2 根备用,用血管夹阻断桡动脉血流,在游离出的头静脉上方放1根吸引器内芯(一次性使用吸引管内芯,直径4 mm),方向与头静脉走形一致;(4)将头静脉与内芯共同结扎后,抽出吸引器内芯。松开肱动脉血管夹,开放血流。术中监测肱动脉血流量下降至989 mL/min,触及头静脉张力较前明显减弱,内瘘震颤良好(图3)。
AVF限流术后,患者指端疼痛消失,颜色红润,病情好转出院。此后,患者又因内瘘侧肢体肿胀分别于2020 年12 月28 日及2021 年1 月19 日再次入院,造影显示左上肢静脉略增宽、迂曲,见多发侧支形成,左侧头臂静脉支架远段狭窄,沿导丝送入8 mm × 10 cm 及10 mm × 6 cm Mustang PTA 球囊扩张导管反复扩张左侧头臂静脉支架内狭窄段,开通血流(图4)。
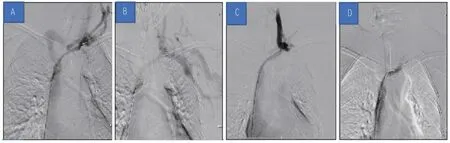
图4 SHS合并DASS患者两次经皮血管内成形术
患者后因“内瘘功能不良1 月”于2023 年3 月12 日再次住院,DSA 下行AVF 及上腔静脉造影,显示左侧头静脉、头臂静脉支架内管腔狭窄,周围见多发侧支循环形成,经股静脉及左上肢内瘘双入路沿导丝送入12 mm × 6 cm Mustang PTA 球囊扩张导管扩张支架内狭窄段,5 mm × 6 cm 及8 mm × 6 cm Mustang PTA 球囊扩张导管扩张左侧头静脉弓,再次造影显示支架内血流恢复,周围侧支循环明显减少,左侧头静脉局部仍有残存狭窄(图5)。术后患者病情好转出院,于2023年8月28日再次随访,左上肢肿胀及前胸静脉曲张减轻,肱动脉血流量约580 mL/min,血液透析泵控血流量约230 ~ 250 mL/min。

图5 SHS合并DASS患者再次经皮血管内成形术
2 讨 论
随着血液净化技术的不断发展完善,以及新药物的开发应用,透析患者的生存期逐渐延长,透析通路并发症的问题逐渐凸显。AVF 是透析患者常用的血管通路,但由于反复穿刺、留置导管及血流动力学的改变,也容易发生狭窄、血栓形成、感染、假性动脉瘤、SHS 以及DASS 等并发症[1]。SHS 是AVF 术后常见并发症,肿胀区域多局限在手部、前臂,临床上可表现为疼痛、静脉曲张,严重者出现冻疮样或湿疹样改变。动静脉内瘘回流受阻是SHS发病的主要机制,位于近心端的中心静脉狭窄和远心端的前臂侧支静脉返流是常见的原因。治疗方法包括保守治疗、狭窄部位补片成形术、移植血管间置术、介入治疗或瘘管关闭术。通畅的中心静脉对维持良好的血管通路功能至关重要,中心静脉狭窄(central venous stenosis,CVS)可能与以下几个因素有关:(1)血液湍流导致血小板聚集、沉积和内皮增生;(2)中心静脉受到外压;(3)动静脉内瘘的高血流量;(4)慢性疾病损伤血管[2]。Taal 等[3]研究发现,有颈内静脉插管史的患者出现CVS的人数是无插管史的2倍以上。Levent等[4]发现,在无中心静脉置管史的患者中,部分患者内瘘平均血流量高达2 347 mL/min,推测CVS 的发生也与内瘘的高流量导致静脉瓣增生狭窄有关。对于CVS患者,如无明显临床表现可密切随访,当出现明显的临床表现时,主要的治疗手段有介入手术、关闭内瘘、重新置管、开放外科手术等。据肾脏病预后质量倡议(kidney disease outcome quality initiative,K/DOQI),首选的治疗方式为经皮血管腔内介入治疗,即PTA及经皮血管支架置入术(percutaneous transluminal stenting,PTS)[5],非介入的外科手术需开胸手术,手术创伤大,尿毒症患者手术风险较高。介入治疗具有创伤小、可重复性高、不损耗外周血管资源等优点,已成为回流静脉狭窄所致SHS的首选治疗方法。
本例患者因锁骨下静脉及左侧无名静脉狭窄,放置支架,支架反复狭窄导致SHS 反复复发,球囊扩张效果欠佳。研究显示,单纯的PTA 治疗后,中心静脉的再狭窄率高于外周静脉,术后管腔内再次出现新生内膜,甚至程度加重,考虑与PTA 致血管内皮细胞的损伤加重有关[6]。有文献报道,随着高压球囊、切割球囊以及紫杉醇药涂球囊的应用,PTA治疗的中远期通畅率较前明显改善[7-8]。当血管出现弹性回缩时,根据K/DOQI指南建议,可考虑置入支架以提高通畅率[5]。裸支架的缺点是容易形成再狭窄,覆膜支架可减少血管内皮损伤,预防支架内狭窄,但锚定性差,容易移位,支架选择尚存争议[9]。介入治疗后反复狭窄的常见原因总结为单纯PTA术后出现内膜增生及周围组织的纤维化,血管管腔在术后出现回缩,PTS 中金属的裸支架刺激血管内皮细胞增生,累及支架全长,支架移位、断裂,支架两端再狭窄等[10]。因此无论是通过何种腔内治疗开通病变的中心静脉段,都需术后规律随访,以获得满意的远期通畅率。
DASS 是指由于AVF 手术将动静脉直接相连,部分动脉血通过内瘘吻合口经静脉直接回流,远端肢体动脉供血不足、出现肢体缺血性改变的一组临床症状综合征,其主要表现为指端发凉、苍白、麻木、疼痛、组织坏死等,内瘘高流量及动脉病变是DASS 发生的主要病因。AVF 自然血流量≥ 1 500 mL/min 和(或)自然血流量/心输出量≥ 20%称为高流量内瘘[5],可增加心脏负荷导致高输出量心力衰竭、动脉瘤形成及中心狭窄或闭塞[11]。本例患者虽然测上臂肱动脉血流量1 389 mL/min,但存在CVS,考虑符合内瘘高流量。目前对于症状较轻的DASS,内瘘成熟过程中可自行缓解,需密切观察;症状较重的有保守治疗和手术治疗方式,可以通过局部保暖、采取超滤曲线透析模式等保守干预,提高基础血压,改善缺血症状,手术治疗的目的在于增加远端灌注,维持内瘘功能。近年来Miller 手术作为一种新型的术式在国外报道较多[12],传统的Miller手术主要通过减小吻合口附近静脉流出道或动脉流入道的直径,增加血管阻力来实现流量控制,其主要操作方法为在缩窄的血管腔内放置1 个球囊导管(3 ~ 4 mm PTA 球囊),球囊充起后再套圈血管,撤除球囊后缩减的管腔就和球囊一样大,优点在于其缩减直径可以精确量化,但应用球囊导管花费较高。本中心在Miller手术原理的基础上对其改良,无需使用PTA 球囊导管,改用一次性吸引器内芯进行套圈限流,余同Miller手术,在超声引导下实时监测,对于手术中缩窄的肱动脉流量进行精确量化,术式简单、费用低,治疗效果佳。限流手术的目的是减少内瘘血流量,增加远端动脉供血。有文献指出,肢体缺血较少发生是因为即使桡动脉供血不足,还可以通过掌弓动脉、尺动脉供血[13]。成熟的AVF应具有充足的血流量,国内指南要求内瘘自然血流量应至少大于500 mL/min[11],K/DOQI指南要求至少大于600 mL/min[5],充足的血流量是保证患者透析充分性的关键。结合文献及平时临床工作经验,本中心认为理想的内瘘流量应在800 ~ 1 000 mL/min 左右。因此,本研究据此为限流的最佳目标值。
本例患者存在免疫系统基础病,长期口服激素治疗,血管条件较差,AVS 后出现SHS 反复复发和DASS 综合征,经中心静脉球囊扩张术联合内瘘限流术治疗,患者内瘘侧上肢肿胀、血管曲张及内瘘功能好转,创伤小,不影响AVF 用于既定透析方案的治疗,值得临床推广应用。
利益冲突所有作者均声明不存在利益冲突